ANIMALES TRANSGENICOS NO HUMANOS CAPACES DE PRODUCIR ANTICUERPOS HETEROLOGOS.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US96/16433.
Solicitante: GENPHARM INTERNATIONAL, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2350 QUME DRIVE,SAN JOSE, CA 95131.
Inventor/es: LONBERG, NILS, KAY, ROBERT, M.
Fecha de Publicación: .
Fecha Concesión Europea: 5 de Mayo de 2010.
Clasificación Internacional de Patentes:
- A01K67/027M2
- A01K67/027M4
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/28A14
- C07K16/30A
- C12N15/85A1
Clasificación PCT:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- C07K16/00 C07K […] › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/28 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C07K16/30 C07K 16/00 […] › de células tumorales.
- C12N15/00 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
Clasificación antigua:
- C12N15/00 C12N […] › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
Fragmento de la descripción:
Animales transgénicos no humanos capaces de producir anticuerpos heterólogos.
Campo técnico
La invención se refiere a animales transgénicos no humanos capaces de producir anticuerpos heterólogos, a transgenes usados para producir dichos animales transgénicos, a transgenes capaces de reorganizar funcionalmente un gen D heterólogo en recombinación V-D-J, a células B inmortalizadas capaces de producir anticuerpos heterólogos, a métodos y transgenes para producir anticuerpos heterólogos de múltiples isotipos, a métodos y transgenes para producir anticuerpos heterólogos en los que una secuencia de región variable comprende una mutación somática en comparación con secuencias de región variable reorganizadas de la línea germinal, a animales transgénicos no humanos que producen anticuerpos que tienen una secuencia primaria humana y que se unen a antígenos humanos, a hibridomas generados a partir de células B de dichos animales transgénicos y a anticuerpos monoclonales expresados por dichos hibridomas.
Antecedentes de la invención
Uno de los impedimentos principales de cara al desarrollo de aplicaciones terapéuticas y de diagnóstico in vivo para anticuerpos monoclonales en seres humanos es la inmunogenicidad intrínseca de inmunoglobulinas no humanas. Por ejemplo, cuando se administran dosis terapéuticas de anticuerpos monoclonales de roedor a pacientes humanos inmunocompetentes, los pacientes producen anticuerpos contra las secuencias de inmunoglobulina de roedor; estos anticuerpos anti-ratón humanos (HAMA) neutralizan los anticuerpos terapéuticos y pueden causar una toxicidad aguda. Por lo tanto, es deseable producir inmunoglobulinas humanas que sean reactivas con antígenos humanos específicos que sean dianas terapéuticas y/o de diagnóstico prometedoras. Sin embargo, la producción de inmunoglobulinas humanas que se unen específicamente con antígenos humanos es problemática.
La presente tecnología para generar anticuerpos monoclonales implica pre-exponer o sensibilizar a un animal (habitualmente una rata o ratón) con antígeno, recoger células B de ese animal y generar una biblioteca de clones de hibridoma. Mediante la exploración en una población de hibridoma de la especificidad de unión a antígeno (idiotipo) y también la exploración de clase de inmunoglobulina (isotipo), es posible seleccionar clones de hibridoma que secreten el anticuerpo deseado.
Sin embargo, cuando los presentes métodos para generar anticuerpos monoclonales se aplican con el fin de generar anticuerpos humanos que tengan especificidades de unión por antígenos humanos, la obtención de linfocitos B que produzcan inmunoglobulinas humanas es un obstáculo serio, puesto que típicamente los seres humanos no generarán respuestas inmunes contra antígenos propios.
Por lo tanto, los presentes métodos de generación de anticuerpos monoclonales humanos que son específicamente reactivos con antígenos humanos son claramente insuficientes. Es evidente que las mismas limitaciones en la generación de anticuerpos monoclonales contra autoantígenos auténticos son aplicables cuando se usan especies no humanas como fuente de células B para generar el hibridoma.
La construcción de animales transgénicos que alberguen un transgén de inmunoglobulina heterólogo funcional es un método por el que pueden producirse anticuerpos reactivos con autoantígenos. Sin embargo, para obtener la expresión de anticuerpos terapéuticamente útiles o clones de hibridoma que produzcan dichos anticuerpos, el animal transgénico debe producir células B transgénicas que sean capaces de madurar a través de la ruta de desarrollo de linfocitos B. Dicha maduración requiere la presencia de IgM de superficie en las células B transgénicas, sin embargo se desean isotipos distintos de IgM para usos terapéuticos. Por lo tanto, existe la necesidad de transgenes y animales que alberguen dichos transgenes que sean capaces de experimentar una reorganización V-D-J funcional para generar una diversidad de recombinación y una diversidad de unión. Además, dichos transgenes y animales transgénicos incluyen preferiblemente secuencias que actúan en cis que facilitan el cambio de isotipo de un primer isotipo que es necesario para la maduración de células B a un isotipo posterior que tiene una utilidad terapéutica superior.
Varios experimentos han notificado el uso de líneas celulares transfectadas para determinar las secuencias de ADN específicas necesarias para la reorganización de genes de Ig (revisado por Lewis y Gellert (1989), Cell, 59, 585-588). Dichos informes han identificado secuencias supuestas y concluido que la accesibilidad de estas secuencias a las enzimas recombinasas usadas para la reorganización está modulada por la transcripción (Yancopoulos y Alt (1985), Cell, 40, 271-281). Las secuencias para la unión de V(D)J son, según se informa, un heptámero casi palindrómico altamente conservado y un nanómero rico en AT peor conservado separados por un espaciador de 12 ó 23 pb (Tonegawa (1983), Nature, 302, 575-581; Hesse, et al. (1989), Genes in Dev., 3, 1053-1061). Según se informa, la recombinación eficaz se produce sólo entre sitios que contienen secuencias señal de recombinación con regiones espaciadoras de longitud diferente.
La reorganización de genes de Ig, aunque se ha estudiado en células de cultivo de tejidos, no se ha examinado exhaustivamente en ratones transgénicos. Sólo se han publicado un puñado de informes que describen construcciones de ensayo de reorganización introducidas en ratones [Buchini, et al. (1987), Nature, 326, 409-411 (transgén ? de pollo sin reorganizar); Goodhart, et al. (1987), Proc. Natl. Acad. Sci. USA, 84, 4229-4233) (gen ? de conejo sin reorganizar); y Bruggemann, et al. (1989), Proc. Natl. Acad. Sci. USA, 86, 6709-6713 (cadena pesada humana-de ratón híbrida)]. Los resultados de dichos experimentos, sin embargo, han sido variables en algunos casos, produciendo una reorganización incompleta o mínima del transgén.
Además se ejerce una diversidad de funciones biológicas de moléculas de anticuerpo por la porción Fc de moléculas, tales como la interacción con mastocitos o basófilos por medio de Fc
Aunque se han generado animales transgénicos que incorporan transgenes que codifican una o más cadenas de un anticuerpo heterólogo, no ha habido informes de transgenes heterólogos que experimenten un cambio de isotipo con éxito. Los animales transgénicos que no pueden realizar un cambio de isotipo están limitados a producir anticuerpos heterólogos de un solo isotipo y, más específicamente, están limitados a producir un isotipo que es esencial para la maduración de células B, tal como IgM y posiblemente IgD, que pueden ser de una utilidad terapéutica limitada. Por lo tanto, existe la necesidad de transgenes de inmunoglobulina heterólogos y animales transgénicos que sean capaces de cambiar de un isotipo necesario para el desarrollo de células B a un isotipo que tenga una característica deseada para uso terapéutico.
Basándose en lo anterior, está claro que existe la necesidad de métodos para producir eficazmente anticuerpos heterólogos, por ejemplo anticuerpos codificados por secuencias genéticas de una primera especie que se producen en una segunda especie. Más particularmente, existe la necesidad en la técnica de transgenes de inmunoglobulina heterólogos y animales transgénicos que sean capaces de experimentar una reorganización de genes V-D-J funcional que incorpore toda o una porción de un segmento génico D que contribuya a la diversidad de recombinación. Además, existe la necesidad en la técnica de transgenes y animales transgénicos que puedan soportar la recombinación V-D-J y el cambio de isotipo de modo que (1) pueda producirse el desarrollo de células B funcionales y (2) puedan producirse anticuerpos heterólogos terapéuticamente útiles. También existe la necesidad de una fuente de células B que pueda usarse para generar hibridomas que produzcan anticuerpos monoclonales para uso terapéutico o de diagnóstico en la especie particular para la que se diseñan. Un transgén de inmunoglobulina heterólogo capaz de una recombinación V-D-J funcional y/o capaz de un cambio de isotipo podría satisfacer estas necesidades.
De acuerdo con el objeto anterior, se proporcionan animales transgénicos no humanos que son capaces de producir un anticuerpo heterólogo, tal como un anticuerpo humano.
Reivindicaciones:
1. Inmunoglobulina de secuencia humana que se une a proteína CD4 humana que comprende un segmento VH4-34, un segmento JH5 y una región CDR3 de cadena pesada que comprende la secuencia polipeptídica VINWFDP.
2. Inmunoglobulina de secuencia humana de acuerdo con la reivindicación 1, en la cual dicha inmunoglobulina comprende una secuencia polipeptídica de cadena pesada sustancialmente idéntica a una secuencia polipeptídica codificada por:
a)
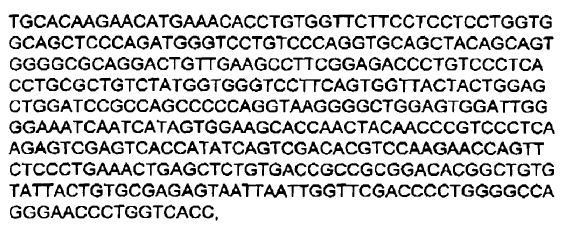
o
b)

3. Inmunoglobulina de la secuencia humana de acuerdo con las reivindicaciones 1 ó 2, que comprende además un segmento VkL19, un segmento Jk2 y una región CDR3 de cadena ligera que comprende la secuencia polipeptídica QQANSFPYT.
4. Inmunoglobulina de secuencia humana de acuerdo con la reivindicación 3, en la cual dicha inmunoglobulina comprende una secuencia polipeptídica de cadena ligera sustancialmente idéntica a una secuencia polipeptídica codificada por:
a)
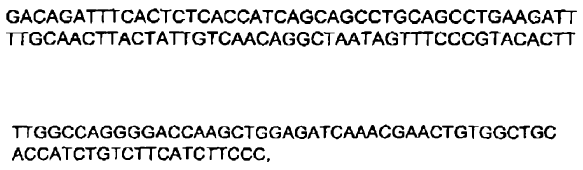
o
b)
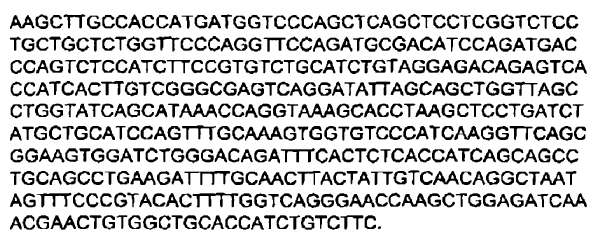
5. Inmunoglobulina de secuencia humana de acuerdo con la reivindicación 1, en la que dicha inmunoglobulina comprende una secuencia polipeptídica de una cadena pesada idéntica a una secuencia polipeptídica codificada por:
a)
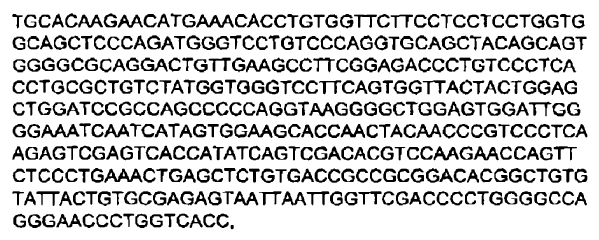
o
b)

y en la cual la inmunoglobulina de secuencia humana comprende además un segmento VkL19, un segmento Jk2 y una secuencia polipeptídica de cadena ligera idéntica a una secuencia polipeptídica codificada por:
a)

o
b)

6. Inmunoglobulina de la secuencia humana de acuerdo con cualquiera de las reivindicaciones 1 a 5 que tiene una constante de avidez (Ka) de al menos 2 x 109 M-1.
7. Inmunoglobulina de la secuencia humana de acuerdo con cualquiera de las reivindicaciones 1 a 5, que tiene una constante de avidez (Ka) de al menos 1 x 1010 M-1.
8. Inmunoglobulina de la secuencia humana de acuerdo con cualquiera de las reivindicaciones 1 a 5, que tiene una constante de avidez (Ka) de al menos 1,1 x 1010 M-1.
9. Gen artificial que codifica un polipéptido de una cadena pesada de la inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 ó 2.
10. Vector de expresión que codifica un polipéptido de una cadena pesada de la inmunoglobulina de secuencia humana como se define de acuerdo con las reivindicaciones 1 ó 2.
11. Vector de expresión de acuerdo con la reivindicación 10 que codifica además un polipéptido de una cadena ligera de la inmunoglobulina de secuencia humana como se define de acuerdo con las reivindicaciones 3 ó 4.
12. Célula que comprende un gen artificial que codifica un polipéptido de una cadena pesada de la inmunoglobulina de secuencia humana como se define de acuerdo con las reivindicaciones 1 ó 2 y un gen artificial que codifica un polipéptido de una cadena ligera de la inmunoglobulina de secuencia humana como se define de acuerdo con las reivindicaciones 3 ó 4.
13. Célula de acuerdo con la reivindicación 12, en la que los dos genes artificiales están en un solo vector.
14. Composición que comprende la inmunoglobulina de secuencia humana de cualquiera de las reivindicaciones 1 a 8.
15. Procedimiento para expresar un polipéptido de inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 5 que implica:
16. Procedimiento para expresar un polipéptido de inmunoglobulina de secuencia humana que comprende:
17. Inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 8 para su uso como producto farmacéutico.
18. Inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 8 para su uso en la reducción de la actividad de células CD4.
19. Inmunoglobulina de secuencia humana de acuerdo con la reivindicaciones 1 a 8 para su uso en el tratamiento de la inmunosupresión.
20. Inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 8 para su uso en el tratamiento de reacciones autoinmunes.
21. Inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 8 para su uso en el tratamiento de respuestas inflamatorias.
22. Inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 8 para su uso en el tratamiento del rechazo de órganos trasplantados.
23. Inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 8 para su uso en el tratamiento para su uso en el tratamiento de la artritis reumatoide.
24. Inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 8 para su uso en el tratamiento de micosis fungoide.
25. Composición farmacéutica que comprende una inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 8.
26. Uso in vitro de una inmunoglobulina de secuencia humana de acuerdo con las reivindicaciones 1 a 8 para diagnóstico.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]
Proteínas y péptidos modificados, del 24 de Junio de 2020, de GLAXO GROUP LIMITED: Un dominio variable de inmunoglobulina único, que se une a TNFR1 y que se selecciona de cualquiera de las siguientes secuencias de aminoácidos: (a) DOM1h-131-206 caracterizada […]
Métodos para purificar una proteína objetivo de una o más impurezas en una muestra, del 17 de Junio de 2020, de EMD Millipore Corporation: Un metodo para purificar una proteina objetivo que contiene una region Fc de una o mas impurezas en una muestra, el metodo comprende las etapas de: a) poner en contacto […]
Dominios variables de inmunoglobulina, del 10 de Junio de 2020, de Ablynx NV: Dominio variable individual de inmunoglobulina de cadena pesada (ISVD), en que el residuo aminoacídico en la posición 89 es L y el residuo […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]