NUEVOS D-HOMO-ESTRA-1,3,5(10)-TRIENOS SUSTITUIDOS EN LA POSICION 2 COMO AGENTES INHIBIDORES DE LA 17BETA-HIDROXIESTEROIDE DESHIDROGENASA DEL TIPO 1.
D-homo-estratrienos de la fórmula general I sustituidos en la posición 2
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/007314.
Solicitante: BAYER SCHERING PHARMA AKTIENGESELLSCHAFT.
Nacionalidad solicitante: Alemania.
Dirección: MULLERSTRASSE 178,13353 BERLIN.
Inventor/es: ELGER, WALTER, HILLISCH, ALEXANDER, PETERS, OLAF, SCHNEIDER, BIRGITT, ADAMSKI,JERZY, GEGE,CHRISTIAN, REGENHARDT,WILKO, MOLLER,GABRIELE, DELUCA,DOMINGA.
Fecha de Publicación: .
Fecha Concesión Europea: 24 de Febrero de 2010.
Clasificación Internacional de Patentes:
- C07J63/00D
Clasificación PCT:
- A61K31/56 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos que contienen el sistema cíclico del ciclopenta[a]hidrofenantreno; Sus derivados, p. ej. esteroides.
- A61P5/32 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 5/00 Medicamentos para el tratamiento de trastornos del sistema endocrino. › Antiestrógenos.
- C07J63/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por expansión de un solo ciclo por uno o dos átomos.
Clasificación antigua:
- A61K31/56 A61K 31/00 […] › Compuestos que contienen el sistema cíclico del ciclopenta[a]hidrofenantreno; Sus derivados, p. ej. esteroides.
- A61P5/32 A61P 5/00 […] › Antiestrógenos.
- C07J63/00 C07J […] › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por expansión de un solo ciclo por uno o dos átomos.
Fragmento de la descripción:
Nuevos D-homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 como agentes inhibidores de la 17ß-hidroxiesteroide deshidrogenasa del tipo 1.
El presente invento se refiere a nuevos D-homo-estra-1,3,5(10)-trienos sustituidos en la posición 2, a su preparación y a su utilización como un medicamento para el tratamiento de enfermedades dependientes de estrógenos, que se dejan influir por inhibición de la 17ß-hidroxi-esteroide deshidrogenasa del tipo 1, así como a composiciones farmacéuticas que contienen estos compuestos.
El documento de solicitud de patente internacional WO-A-03/017973 describe un compuesto de estradiol sustituido en la posición 16 para la inhibición de la 17ß-hidroxiesteroide deshidrogenasa del tipo 1.
Las hormonas sexuales controlan la proliferación y la función de tejidos normales así como malignos, que son sensibles a esteroides [E. E. Baulieu, Hormones, a complex communication network [Hormonas, una compleja red de comunicación]. En Hormones, coordinadores de edición E. E. Baulieu y P.A. Kelly, Herman Publisher Paris y Chapman and Hall Nueva York, 1990, páginas 147-149; D.D. Thomas, Cancer 53 (1984) 595-601].
El estradiol es la hormona sexual femenina más activa que, aparte de los conocidos efectos sobre el sistema de reproducción, ejerce otras funciones adicionales en el caso del metabolismo de los huesos y de los lípidos, en el sistema cardiovascular, así como unos efectos reguladores en el sistema nervioso central. Éste se produce, en el caso de mujeres en una fase anterior a la menopausia, principalmente en los ovarios. Otra gran parte adicional de los estrógenos activos se forma en el tejido periférico a partir de compuestos precursores de esteroides inactivos, que son segregados en grandes cantidades en la sangre, en las cápsulas suprarrenales en el caso de seres humanos.
Después de la menopausia, el nivel de estradiol en la sangre disminuye hasta aproximadamente 1/10 del contenido de mujeres en una fase anterior a la menopausia [T. Thorsten, M. Tangen, K. F. Stoa, Eur. J. Cancer Clin. Oncol. 18 (1982) 333-337; A. A. van Landeghem y colaboradores, Cancer Res. 45 (1985) 2900-2906]. A partir de este momento los estrógenos se ponen a disposición principalmente a través de la biosíntesis en el tejido periférico [F. Labrie, Intracrinology. Mol. Cell. Endocrinol. 78(1991) C113-C118].
Los estrógenos son asimilados por el tejido tumoral a través de la sangre y estimulan su crecimiento.
La concentración del estradiol intratumoral se mantiene, sin embargo, también después de la menopausia en un alto nivel, comparable con el que se presenta en el caso de mujeres en una fase previa a la menopausia [A. A. van Landeghem y colaboradores, Cancer Res. 45 (1985) 2900-2906]. La alta concentración de estradiol en el tejido tumoral en el caso de mujeres en una fase posterior a la menopausia es causada mediante una biosíntesis de estrógenos en el tejido tumoral.
El estradiol (E2) es formado en el tejido de un cáncer de mama o bien a través de la ruta de la aromatasa o de la ruta de la sulfatasa [Y.J. Abul-Hajj, R. Iverson, D. T. Kiang, Steroids 33 (1979) 205-222; A. Lipton y colaboradores, Cancer 59 (1987), 779-782; E. Perel y colaboradores, J. Steroid Biochem. 29 (1988) 393-399]. La androstenodiona es asimilada a partir de la sangre por el tejido tumoral, es aromatizada para formar la estrona (E1) y a continuación es reducida para formar el estradiol (E2) (ruta de la aromatasa). En el caso de la ruta de la sulfatasa, el sulfato de estrona es transformado en la E1 mediante la esteroide sulfatasa y ésta es de nuevo reducida para formar el E2.
La ultima etapa decisiva de la síntesis de esteroides es catalizada por las 17ß-hidroxiesteroide deshidrogenasas (17ß-HSD), pertenecientes a la familia de las 17ß-hidroxiesteroide deshidrogenasas y de las 17-cetoesteroide reductasas. Estas enzimas transforman a unos 17-ceto-esteroides poco activos en sus 17ß-hidroxiesteroides activos y a la inversa. Tanto los estrógenos como también los andrógenos muestran la más alta afinidad para los correspondientes receptores en la forma de 17ß-hidroxi, es decir que las 17ß-HSD regulan la actividad biológica de las hormonas sexuales [H. Peltoketo y colaboradores, J. Mol. Endocrinol. 23 (1999), 1-11; P. Vihko y colaboradores, Mol. Cell. Endocrinol. 171 (2001) 71-76].
Determinados tejidos extragonadales, tales como tejidos de mama y de próstata, expresan 17-HSD's reductoras y transforman de esta manera a los compuestos precursores con una menor actividad, que circulan en la sangre, en los tejidos dianas en las formas más activas [F. Labrie y colaboradores, Steroids 62 (1997) 148-158; H. Peltoketo y colaboradores, Horm. 55 (1999) 353-398].
Hasta hoy en día se conocen 11 diferentes 17ß-HSD's. Ellas se diferencian en su distribución en los tejidos, en la actividad catalítica, en su especificidad para ciertos substratos, en la localización subcelular y mediante el mecanismo de regulación. Para un gran número de las hidroxiesteroide deshidrogenasas se pudo mostrar su participación en la patogénesis de enfermedades de los seres humanos, por ejemplo para el pseudohermafroditismo [17ß-HSD 3, W. M. Geissler y colaboradores Nat. Genet. 7 (1994) 34-39], un déficit de enzimas bifuncionales [17ß-HSD 4, E. G. van Grunsven y colaboradores, Proc. Natl. Acad. Sci. USA 95 (1998) 2128-2133], una enfermedad renal poliquística [17ß-HSD 8, M. M. Maxwell y colaboradores, J. Biol. Chem. 270 (1995) 25213-25219] y la enfermedad de Alzheimer [17ß-HSD 10, S. D. Yan y colaboradores, Nature 389 (1997) 689-695; X. Y. He y colaboradores, J. Biol. Chem. 274 (1999) 15014-15019].
Las 17ß-hidroxiesteroide deshidrogenasas placentarias humanas del tipo 1 y del tipo 2 pertenecen a la misma familia de proteínas de esteroide deshidrogenasas reductasas (SDR, Steroiddehydrogenase-Reduktase). Ellas se diferencian unas de otras, entre otras cosas, por la dirección de la reacción, que es catalizada por las enzimas.
La 17ß-HSD 1 regula sobre todo la reducción de la estrona para formar el estradiol [T. Puranen y colaboradores, Endocrinology 138 (1997) 3532-3539] mediando participación del NADPH como cofactor [J. Z. Jin, S. X. Lin, Biochem. Biophys. Res. Commun. 259 (1999) 489-493].
En células cultivadas, la HSD 1 apoya parcialmente la reducción de la androstenodiona y de la androstanodiona. Sin embargo, se pudo mostrar de manera inequívoca que son preferidos los substratos fenólicos [M. Poutanen y colaboradores, Endocrinology 133 (1993) 2639-2644]. En comparación con la 17ß-HSD 1, la 17ß-HSD 2 cataliza por el contrario a la reacción opuesta, a saber la transformación del estradiol en la estrona y de la androstenodiona y de la dihidrotestosterona para formar la androstanodiona [L. Wu y colaboradores, J. Biol. Chem. 268 (1993) 12964-12969] y actúa de manera preferente en presencia de la forma no fosforilada del cofactor NAD [F. Labrie y colaboradores Steroids 62 (1997) 148-158].
Las 17ß-HSD 1 y 2 son expresadas en un tejido normal de glándulas mamarias [G. Söderqvist, J. Clin. Endocrinol. Metab. 83 (1998) 1190-1193; M. Miettinen, Breast Cancer Res, Treat. 57(1999) 175-182].
Al contrario que un tejido de mama normal, en las células malignas epiteliales de mama se ha aumentado la actividad reductora (mediante la 17ß-HSD 1) con relación a la actividad oxidante (mediante la 17ß-HSD 2) [M. M. Miettinen y colaboradores, Biochem. J. 314 (1996) 839-845; V. Speirs, J. Steroid Biochem. Mol. Biol. 67 (1998) 267-274]. Se observó que el estradiol se acumula en células malignas de mama, lo cual apunta asimismo a una actividad de la 17ß-HSD 1 [A. Vermeulen y colaboradores, Eur. J. Cancer Clin. Oncol. 22 (1986) 515-525]. Además, se encontró que, en presencia de la 17ß-HSD 1, la administración de estrona conduce a un crecimiento de células cancerosas malignas de mama de igual manera que la administración del estradiol a solas. Al contrario que esto, la administración de la estrona a solas sin la 17ß-HSD 1 no produce este efecto [M. M. Miettinen y colaboradores, Int. J. Cancer 68 (1996) 600-604].
La dominancia de la 17ß-HSD 1 en un tejido maligno conduce a un reforzado crecimiento dependiente de estrógenos y a un progreso de los tumores, mientras que la 17ß-HSD 2 oxidante protege a células de tejidos de mama normales con respecto de un excesivo efecto del estradiol [P. Vihko y colaboradores, Mol. Cell. Endocrinol. 171 (2000) 71-76].
En el caso de la endometriosis, el equilibrio entre la 17ß-HSD 1 y la 2 tiene una cierta importancia. La 17ß-HSD 1 es...
Reivindicaciones:
1. D-homo-estratrienos de la fórmula general I sustituidos en la posición 2
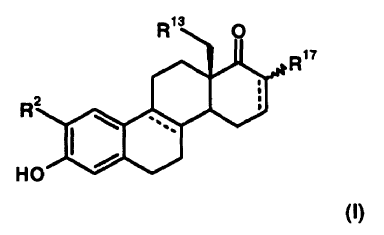
en la que
R2 significa un grupo alquilo de C1-C8 saturado o insaturado, un radical aralquilo o alquilarilo, un grupo alquiloxi de C1-C8 o un átomo de halógeno,
R13 significa un átomo de hidrógeno o un grupo metilo,
R17 significa un átomo de hidrógeno o de flúor,
pudiendo las líneas de trazos en los anillos B y D de la molécula del esteroide ser dobles enlaces adicionales, así como sus sales farmacéuticamente aceptables, con excepción del compuesto 2-metoxi-17a-oxo-17a-homoestra-1,3,5(10)-trien-3-ol.
2. D-Homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con la reivindicación 1, caracterizados porque R2 es un alcoxi de C1-C5, alquilo de C1-C5 o alquenilo de C2-C3 o respectivamente bromo o cloro.
3. D-Homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con la reivindicación 1, caracterizados porque R2 es un radical metoxi o etoxi, o un radical metilo, etilo o propilo, así como un radical alilo.
4. D-Homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con la reivindicación 1, caracterizados porque R13 es un átomo de hidrógeno.
5. D-Homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con la reivindicación 1, a saber
6. D-Homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con una de las reivindicaciones 1 a 5, o el 2-metoxi-17a-oxo-17a-homoestra-1,3,5(10)-trien-3-ol, destinados a la producción de un medicamento.
7. Utilización de D-homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con una de las reivindicaciones 1-5, o del 2-metoxi-17a-oxo-17a-homoestra-1,3,5(10)-trien-3-ol, para la producción de un medicamento destinado a la profilaxis y a la terapia de enfermedades dependientes de estrógenos, que se dejan influir positivamente mediante la inhibición de la 17ß-hidroxiesteroide deshidrogenasa.
8. Utilización de D-homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con la reivindicación 7, utilizándose por lo menos una sustancia activa adicional en combinación para la producción de un medicamento.
9. Utilización de D-homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con la reivindicación 8, siendo la otra sustancia activa adicional un agente antiandrógeno, antigestágeno, inhibidor de aromatasa o antiestrógeno.
10. Utilización de D-homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con una de las reivindicaciones 7 a 9, para la producción de un medicamento destinado a la profilaxis y a la terapia de enfermedades tumorales dependientes de hormonas de las glándulas germinativas masculinas y femeninas, y de los órganos sexuales masculinos y femeninos, incluyendo las glándulas mamarias.
11. Utilización de D-homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con la reivindicación 10, para la producción de un medicamento destinado a la profilaxis y a la terapia del carcinoma de mama.
12. Utilización de D-homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con la reivindicación 10, para la producción de un medicamento destinado a la profilaxis y a la terapia del carcinoma de próstata.
13. Utilización de D-homo-estra-1,3,5(10)-trienos sustituidos en la posición 2 de acuerdo con la reivindicación 10, para el tratamiento de la endometriosis.
14. Composiciones farmacéuticas que contienen por lo menos un compuesto de la fórmula general I de acuerdo con una de las reivindicaciones 1 a 5 o el 2-metoxi-17a-oxo-17a-homoestra-1,3,5(10)-trien-3-ol, y eventualmente por lo menos una sustancia activa adicional, en común con sustancias auxiliares y/o de vehículo farmacéuticamente compatibles, siendo la otra sustancia activa adicional un agente antiandrógeno, antigestágeno, inhibidor de aromatasa o antiestrógeno.
Patentes similares o relacionadas:
PROCEDIMIENTOS PARA PRODUCIR UNA FRACCIÓN ENRIQUECIDA HASTA 100% DE ÁCIDO 3-0-ACETIL-11-CETO-BETA-BOSWÉLICO A PARTIR DE UN EXTRACTO QUE CONTIENE UNA MEZCLA DE ÁCIDOS BOSWÉLICOS, del 7 de Noviembre de 2011, de LAILA IMPEX: Un procedimiento para producir una fracción enriquecida hasta 100% de ácido 3-O-acetil-11-ceto-ß-boswélico a partir de un extracto que contiene una […]
PROCEDIMIENTO MEJORADO PARA LA OBTENCIÓN DE ÁCIDO BETULÍNICO, del 13 de Mayo de 2011, de BOEHRINGER INGELHEIM PHARMA GMBH & CO.KG: Procedimiento para la obtención de ácido betulínico de elevada pureza mediante extracción a partir de corteza y/o capa externa de plátano, […]
ESTEROIDES QUE TIENEN UN PERFIL MIXTO DE EFECTOS ANDROGENOS Y PROGESTAGENOS, del 14 de Diciembre de 2009, de N. V. ORGANON: Un compuesto representado por la fórmula 1: **(Ver fórmula)** en la que: R1 es O, (H,H), (H,OH) o NOR, siendo R hidrógeno, alquilo de (C1-C6), o acilo de […]
 MODULADORES DE SHIP 1, del 4 de Noviembre de 2009, de THE UNIVERSITY OF BRITISH COLUMBIA: Un compuesto de Fórmula I o una sal del mismo, ** ver fórmula** donde R 1 y R 2 se seleccionan independientemente del grupo que consiste en: -CH 3, -CH 2CH 3, -CH 2OH, […]
MODULADORES DE SHIP 1, del 4 de Noviembre de 2009, de THE UNIVERSITY OF BRITISH COLUMBIA: Un compuesto de Fórmula I o una sal del mismo, ** ver fórmula** donde R 1 y R 2 se seleccionan independientemente del grupo que consiste en: -CH 3, -CH 2CH 3, -CH 2OH, […]
 Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Derivados de ácidos biliares como agonistas FXR/TGR5, del 1 de Julio de 2020, de ENANTA PHARMACEUTICALS, INC: Un compuesto representado por la Formula I, o una sal o ester aceptable farmaceuticamente de este: **(Ver fórmula)** en donde: Ra es hidrogeno o -C1-C8 alquilo […]
Yoduro de povidona, un conservante alternativo novelo para composiciones oftálmicas, del 3 de Junio de 2020, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Una composición oftálmica estable adecuada para administración tópica en el ojo, que comprende una mezcla de: a. yoduro de povidona (PVP-I) a una concentración entre 0,01% […]
Composiciones y métodos para suprimir las proliferaciones endometriales, del 13 de Mayo de 2020, de Allergan Pharmaceuticals International Limited: Antagonista de progesterona seleccionado de 21-metoxi-17a-acetoxi-11b-(4-N,N-dimetilaminofenil)-19- norpregna-4,9-dieno-3,20-diona (CDB-4124) o 17α-acetoxi-11β-(4-N,N-dimetilaminofenil)-19-norpregna-4,9- […]