PROCESO PARA LA PREPARACION DE LAMBDA-LACTONA DE ACIDO 17-HIDROXI-6-BETA,7-BETA; 15-BETA,16-BETA-BISMETILEN-17 ALFA-PREGN-4-ENO-3-ONA 21-CARBOXILICO Y DE INTERMEDIOS CLAVE PARA ESTE PROCESO.
Proceso para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß; 15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula (I):
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/HU2005/000111.
Solicitante: RICHTER GEDEON NYRT.
Nacionalidad solicitante: Hungría.
Dirección: GYOMROI UT 19-21,1103 BUDAPEST.
Inventor/es: HORVATH, JUDIT, TUBA, ZOLTAN, BALOGH, GABOR, MAHO, SANDOR, GALIK,GYORGY, SOROS,BELA.
Fecha de Publicación: .
Fecha Concesión Europea: 24 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07J1/00B2
- C07J53/00C1D
Clasificación PCT:
- C07J1/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, androstano.
- C07J53/00 C07J […] › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por condensación con ciclos carbocíclicos o por formación de un ciclo adicional por un enlace directo entre dos átomos de carbono cíclicos.
Fragmento de la descripción:
Proceso para la preparación de ?-lactona de ácido 17-hidroxi-6-ß,7-ß; 15-ß,16-ß-bismetilen-17a-pregn-4-eno-3-ona-21-carboxílico y de intermedios clave para este proceso.
El objeto de la invención consiste en un proceso para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico (en adelante drospirenona), de fórmula (I):

a partir de 15a-hidroxiandrost-4-eno-3,17-diona, de fórmula (II):
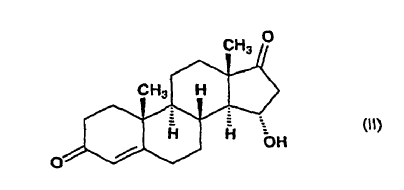
En terapia, la drospirenona se utiliza como una progestina sintética que posee también efectos anti-mineralocorticoides y antiandrogénicos. Combinada con etinilestradiol, se comercializa con el nombre de Yasmin como contraceptivo oral.
Para la preparación de la drospirenona de fórmula (I), se conocen en la literatura química diversos procesos que difieren en el material de partida utilizado y en el orden de las etapas de reacción. La introducción de los grupos funcionales se lleva a cabo por medio de métodos químicos conocidos.
Se describe por primera vez la especificación de patente alemana DE 2.652.761 una síntesis de drospirenona. La síntesis arranca con 3ß-hidroxi-15ß,16ß-metilenandrost-5-eno-17-ona, que se somete a reacción con 1-bromo-3,3-dimetoxipropano en tetrahidrofurano en presencia de litio, seguida de ciclación en la posición 17 en ácido acético al 70%, para producir el "lactol-éter". Los grupos hidroxi y éter presentes en la molécula se oxidan con ciclohexanona en presencia de isopropilato de aluminio, después se isomeriza el doble enlace mediante la utilización de ácido sulfúrico 2N para producir ?-lactona de ácido 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregn-4-eno-21-carboxílico.
La "?-lactona" así obtenida se somete a reacción con cloranil (tetraclorobenzoquinona) en t-butanol para formar el "3-oxoandrost-4,6-dieno", donde se introduce un grupo metileno en las posiciones 6,7 (mediante la utilización de yoduro de trimetilsulfoxonio e hidruro de sodio, produciendo un "metiluro" in situ), lo cual lleva a la drospirenona.
Para la preparación del 3ß-hidroxi-15ß,16ß-metilenandrost-5-eno-17-ona (material de partida para la síntesis mencionada anteriormente), en la especificación de patente alemana DE 1.593.500 se describe una vía de reacción en cinco etapas.
La primera síntesis de drospirenona se llevó a cabo mediante reacciones difíciles de realizar y dio escasos rendimientos. La purificación de los intermedios y del producto final realizada por cromatografía produjo también bajos rendimientos (respectivamente, 49%, 26% y 16%).
En la especificación de patente alemana DE 2.746.298 se describen intermedios que también se pueden utilizar para la preparación de drospirenona. Para formar los dobles enlaces (que son necesarios para la introducción de los grupos metileno), en primer lugar se llevaron los grupos hidroxilo dentro de la molécula a través de un proceso microbiológico. La dehidroepiandrosterona
Cuando el derivado de 7a,15a-dihidroxi fue acetilado con anhídrido acético en piridina, se obtuvo en una etapa 3ß-acetoxi-7a-hidroxiandrost-5,15-dieno-17-ona. Se introdujo el grupo metileno en las posiciones 15,16 tal como se ha expuesto anteriormente y se oxidó microbiológicamente el compuesto obtenido. La eliminación posterior del agua produjo 15ß,16ß-metilenandrost-4,6-dieno-3,17-diona. Después, el compuesto que tenía la estructura "dieno" en los anillos AB del esteroide se trató con etilenglicol en presencia del trialquil éster de ácido ortofórmico y el catalizador ácido p-toluensulfónico para producir el cetal de forma conocida por sí, dicho cetal se sometió a reacción con dimetoxibromopropano en presencia de litio tal como se ha descrito anteriormente para producir el "17-acetal", que después se cicló para formar el "lactolmetil éter" correspondiente y el conjunto se sometió a una oxidación de Jones para producir la "lactona" correspondiente. El intermedio obtenido de esta forma tiene un doble enlace en la posición 6,7 donde se puede introducir de manera conocida un grupo metileno.
Se describe teóricamente otra vía de síntesis para la preparación de drospirenona en la especificación de patente europea EP 051.143 y sus equivalentes (US 4.416.985 y US 4.614.616). El proceso está publicado también en Angew. Chem. 94, 718-719 (1982). La novedad es que se forma el grupo 6ß,7ß-metileno de forma esteroespecífica por medio de la reacción de Simmons-Smith.
El material de partida del proceso es 3ß-hidroxi-15ß,16ß-metilenandrost-5-eno-17-ona. El hidroxi en la posición 7ß se introduce en un proceso de fermentación utilizando Botryodiplodia malorum, el compuesto resultante es acetilado de forma regioselectiva con anhídrido piválico en presencia de 4-dimetilaminopiridina, produciendo el derivado correspondiente 3ß-pivaloiloxi. Dicho derivado pivaloiloxi se sometió a reacción con hidroperóxido de tert-butilo en presencia del catalizador VO (acetonilacetonato)2 para producir el derivado 5ß,6ß-epoxi, que, a su vez, se sometió a reacción con trifenilfosfina y tetracloruro de carbono en diclorometano para producir el derivado 7a-cloro. Dicho derivado 7a-cloro se sometió a reacción con zinc en una mezcla de ácido acético y tetrahidrofurano, produciendo la 5ß-hidroxi-15ß,16ß-metilen-3ß-pivaloiloxiandrost-6-en-17-ona que después se hidrolizó con hidróxido de potasio para producir 3ß,5ß-dihidroxi-15ß,16ß-metilenandrost-6-en-17-ona.
En el compuesto que tiene un doble enlace en la posición 6, el grupo metileno se introdujo utilizando diyodometano en presencia de zinc en un disolvente de dimetil éter de etilenglicol, y el derivado "6ß,7ß;15ß,16ß-dimetileno" así obtenido fue propinilado en la posición 17 en presencia de etilato de potasio en tetrahidrofurano. Dicho 17ß-(3-hidroxi-1-propinil)-6ß,7ß;15ß,16ß-dimetilenandrostan-3ß,5ß,17ß-triol fue hidrogenado en una mezcla de tetrahidrofurano, metanol y piridina en presencia del catalizador Pd/CaCO3 o Pd/C y el compuesto obtenido fue oxidado, lactonizado y deshidratado en una etapa mediante la utilización de trióxido de cromo en piridina acuosa.
Según la EP 0.051.143, en lugar del grupo protector pivaloiloxi, es también adecuado el sustituyente tert-butildimetilsililo, dimetil-(3-metilbutil)sililo o tribencilsililo.
La síntesis se compone de 15 etapas. En la etapa de epoxidación, la utilización de hidroperóxido de tert-butilo conlleva cierto riesgo. Cuando se aplica polvo de zinc a un sistema heterogéneo bajo fuerte agitación, se necesita un aparato especial. El perclorato de sodio es un material peligroso, el tetracloruro de carbono como reactivo ya no se puede utilizar ni a escala de laboratorio, mientras que el etilato de potasio es inflamable. En base a la experimentación, cuando un grupo etinilo es hidrogenado, aparte del producto totalmente hidrogenado se encuentran siempre impurezas parcialmente hidrogenadas y dichas impurezas sólo se pueden separar con una pérdida considerable del compuesto útil, bien sea una cadena lineal o una cíclica.
Las especificaciones de las patentes EP 075.189 y US 4.435.327 se refieren a procesos sintéticos/microbiológicos combinados. El material de partida para la síntesis es, nuevamente, dehidroepiandrosterona, que es hidroxilada mediante un proceso de fermentación (Colletotrichum phomoides) para producir la 3ß,7a,15a-trihidroxiandrost-5-en-17-ona; el sustituyente hidroxi en la posición 7 de dicho compuesto entonces es epimerizado con ácido perclórico al 35% como catalizador, por ejemplo en una mezcla de acetona y diclorometano; finalmente, el derivado de 3ß,7ß,15a-trihidroxi se somete a reacción con cloruro de pivaloílo en piridina, en presencia del catalizador 4-dimetilaminopiridina, para producir el derivado 3,15-pivaloilado. Se describe también un proceso alternativo para la preparación del compuesto.
Las etapas posteriores de la síntesis...
Reivindicaciones:
1. Proceso para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß; 15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula (I):
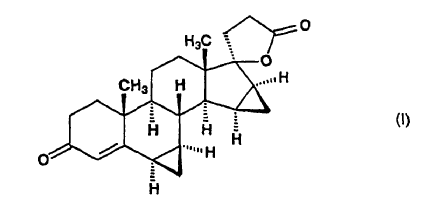
a partir de 15a-hidroxiandrost-4-eno-3,17-diona, de fórmula (II):
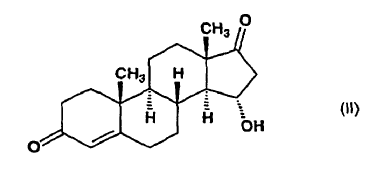
caracterizado porque
la 15a-hidroxiandrost-4-eno-3,17-diona de fórmula (II):
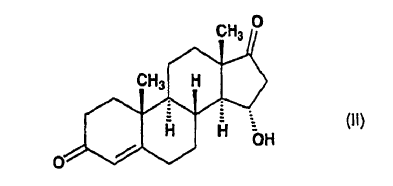
se acetila con anhídrido acético en tetrahidrofurano seco en presencia del catalizador 4-dimetilaminopiridina a temperatura ambiente, para producir la 15a-acetoxiandrost-4-eno-13,17-diona de fórmula (III):
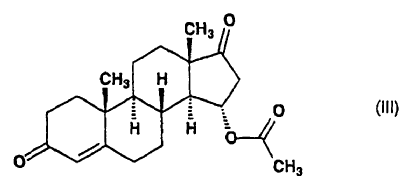
dicho compuesto de fórmula (III) en tetrahidrofurano seco se somete a reacción con un ortoformiato de trialcoxi conteniendo grupos alquilo de 1 a 5 átomos de carbono, en presencia del catalizador ácido sulfúrico, a una temperatura de 0-10ºC, para producir 15a-acetoxi-3-alcoxiandrost-3,5-dieno-17-ona de fórmula general (IV):
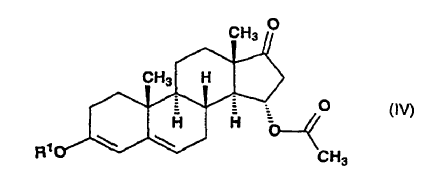
en la que R1 significa un grupo alquilo de 1-4 átomos de carbono, dicho compuesto de fórmula general (IV) se somete a reacción con un metiluro de trimetilsulfoxonio in situ, preparado en sulfóxido de dimetilo a partir de una sal de trimetilsulfoxonio con un hidróxido de metal alcalino, para producir 15ß,16ß-metilen-3-alcoxiandrost-3,5-dieno-17-ona de fórmula general (V):
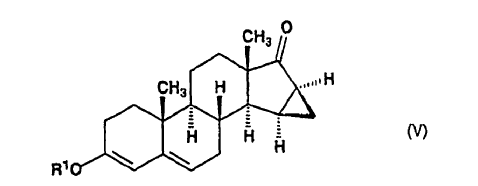
dicho compuesto de fórmula general (V), en la que R1 representa un grupo alquilo de 1 a 4 átomos de carbono, en sulfóxido de dimetilo, se somete a reacción con yoduro de trimetilsulfonio en presencia de tert-butilato de potasio a una temperatura de 15-25ºC, para producir 15ß,16ß-metilen-3-alcoxiespiro[androst-3,5-dieno-17ß2'-oxirano], de fórmula general (VI):
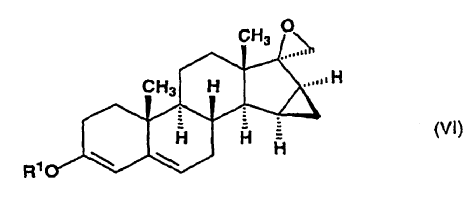
en la que R1 representa un grupo alquilo de 1 a 4 átomos de carbono, dicho compuesto de fórmula general (VI), en etanol, se somete a reacción con un malonato de di(alquilo(C1-4)) en presencia de etóxido de sodio en ebullición para producir ?-lactona de alquil éster de ácido 17-hidroxi-15ß,16ß-metilen-3-alcoxi-17a-pregna-3,5-dieno-21,21-dicarboxílico, de fórmula general (VII):
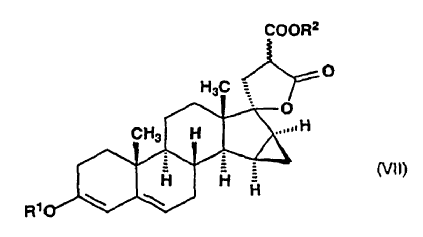
en la que R1 y R2 significan un grupo alquilo de 1 a 4 átomos de carbono, y el enlace ~ representa la configuración a y ß, dicho compuesto de fórmula general (VII) es deshidrogenado con tetraclorobenzoquinona en acetona para producir ?-lactona de alquil éster de ácido 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregna-4,6-dieno-21,21-dicarboxílico, de fórmula general (VIII):

en la que R2 significa un grupo alquilo de 1 a 4 átomos de carbono y el enlace ~ representa la configuración a y ß, dicho compuesto de fórmula general (VIII) se somete a reacción con metiluro de trimetilsulfoxonio in situ, preparado en sulfóxido de dimetilo a partir de una sal de trimetilsulfoxonio y un hidróxido de metal alcalino, para producir ?-lactona de alquil éster de ácido 17-hidroxi-6?,7?;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21,21-dicarboxílico de fórmula general (IX):
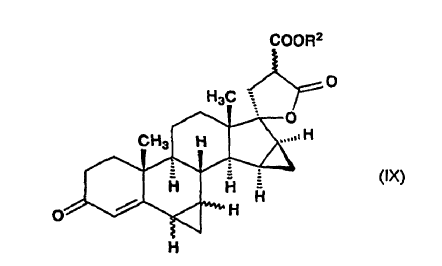
en la que R2 es un grupo alquilo de 1 a 4 átomos de carbono y el enlace ~ representa la configuración a y ß, y cualquiera de dicho compuesto de fórmula general (IX) o de ?-lactona de alquil éster de ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21,21-dicarboxílico (isómero de fórmula general (IXa)) es aislado por cromatografía y recristalización
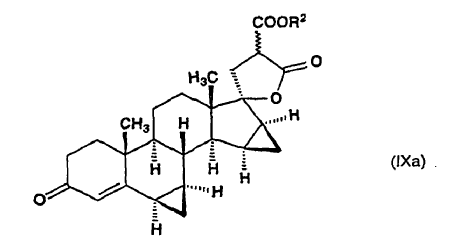
y dicho isómero de fórmula general (IXa), en dimetilformamida, es descarboxilado a una temperatura de alrededor del punto de ebullición de la mezcla de reacción, para producir ?-lactona del ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula (I), que se aísla, o ?-lactona de alquil éster de ácido 17-hidroxi-6?,7?;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21,21-dicarboxílico de fórmula general (IX):
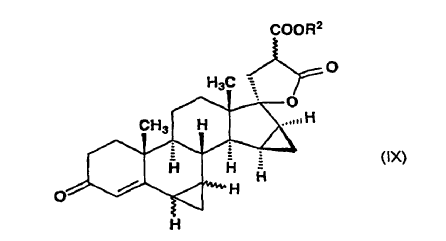
en la que R2 indica un grupo alquilo de 1 a 4 átomos de carbono y el enlace ~ representa la configuración a y ß, se descarboxila en dimetilformamida a una temperatura de alrededor del punto de ebullición de la mezcla de reacción para producir ?-lactona de ácido 17-hidroxi-6?,7?;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico, de fórmula general (X):
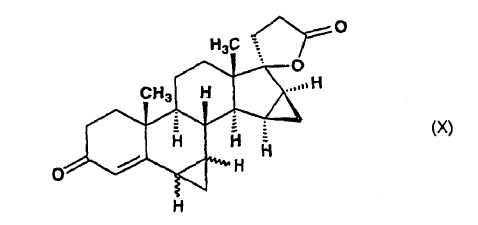
en la que el enlace ~ representa la configuración a y ß, a partir de la cual se separa la ?-lactona de ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de formula (I) por cromatografía y recristalización; o
la ?-lactona de alquil éster de ácido 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregna-4,6-dieno-21,21-dicarboxílico de fórmula general (VIII)
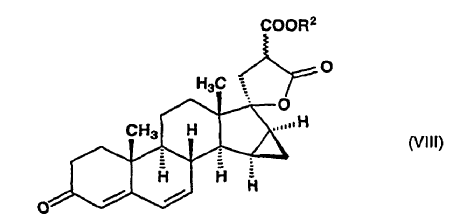
en la que R2 indica un grupo alquilo de 1 a 4 átomos de carbono y el enlace ~ representa la configuración a y ß, se descarboxila en dimetilformamida a una temperatura de alrededor del punto de ebullición de la mezcla de reacción, para producir ?-lactona de ácido 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregna-4,6-dieno-21-carboxílico de fórmula (VIIIa), que se aísla:
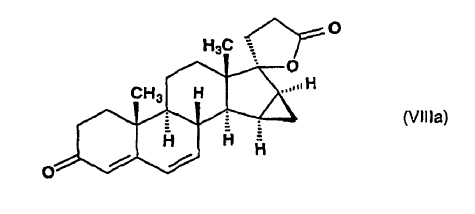
dicho compuesto de fórmula (VIIIa) se somete a reacción con metiluro de trimetilsulfoxonio preparado in situ en sulfóxido de dimetilo a partir de una sal de trimetilsulfoxonio y un hidróxido de metal alcalino, para producir ?-lactona de ácido 17-hidroxi-6?,7?;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula general (X):
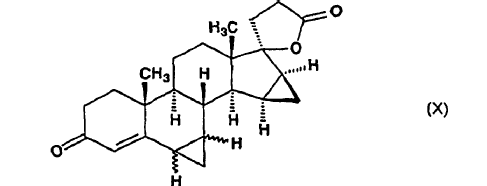
en la que el enlace ~ representa la configuración a y ß, y, a partir de dicho compuesto de fórmula (X), se separa la ?-lactona de ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de formula (I) por cromatografía y recristalización.
2. Proceso según la reivindicación 1, caracterizado porque la separación cromatográfica de los productos isoméricos de fórmula (X), en la que el enlace ~ representa la configuración a y ß, se lleva a cabo en gel de sílice.
3. Proceso según la reivindicación 1, caracterizado porque la separación cromatográfica de los productos isoméricos de fórmula (X), en la que el enlace ~ representa la configuración a y ß, se lleva a cabo en gel de sílice en dos etapas utilizando una etapa cromatográfica preliminar y una en capa fina.
4. Proceso según la reivindicación 1, caracterizado porque la separación cromatográfica de los productos isoméricos de la fórmula (X), en la que el enlace ~ representa la configuración a y ß, se lleva a cabo mediante la utilización de una mezcla ciclohexano/acetato de etilo/acetona compuesta del 64:18:18% en volumen de los componentes, o una mezcla ciclohexano/acetato de etilo/acetonitrilo compuesta del 55:35:10% en volumen de los componentes, o una mezcla ciclohexano/metil tert-butil éter/acetona compuesta del 50:30:20% en volumen de los componentes o una mezcla ciclohexano/acetona compuesta del 73:27% en volumen de los componentes como eluyente.
5. Proceso según la reivindicación 1, caracterizado porque la drospirenona de fórmula (I) obtenida en el proceso se cristaliza a partir de metanol, etanol, propanol, isopropanol, acetato de etilo, mezclas acuosas que contienen hasta un 10% en volumen de agua seleccionadas de entre metanol/agua, etanol/agua, propanol/agua, isopropanol/agua o una mezcla acetona/diisopropil éter que contiene hasta un 50% en volumen de acetona, una mezcla ciclohexano/acetato de etilo que contiene hasta un 50% en volumen de acetato de etilo, una mezcla diclorometano/diisopropil éter que contiene hasta un 10% en volumen de diclorometano, o una mezcla diclorometano/hexano que contiene hasta un 10% en volumen de diclorometano.
6. Proceso según la reivindicación 1, caracterizado porque la cromatografía de los isómeros de ?-lactona de alquil éster de ácido 17-hidroxi-6?,7?;15ß,16ß-bismetilen-3-oxo-17a-pregna-4-eno-21,21-dicarboxílico de fórmula general (IX), en la que R2 representa un grupo alquilo de 1 a 4 átomos de carbono y el enlace ~ representa la configuración a y ß, se lleva a cabo con una mezcla acetato de etilo/ciclohexano compuesta del 55:45% en volumen de los componentes.
7. ?-Lactonas de alquil éster de ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregna-4-eno-21,21-dicarboxílico de fórmula general (IXa):
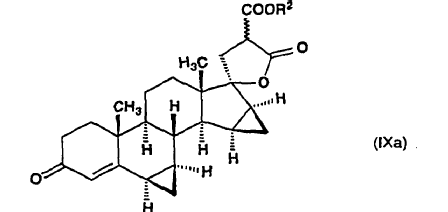
donde R2 y el enlace ~ son como se han definido anteriormente, que se utilizan como intermedios en el proceso de acuerdo con la invención.
8. ?-Lactonas de alquil éster de ácido 17-hidroxi-6?,7?;15ß,16ß-bismetilen-3-oxo-17a-pregna-4-eno-21,21-dicarboxílico de fórmula general (IX):
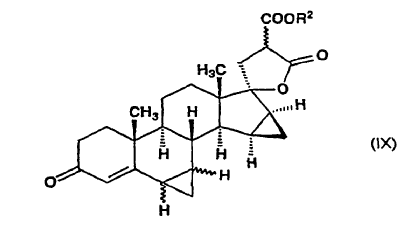
donde R2 indica un grupo alquilo de 1 a 4 átomos de carbono y el enlace ~ representa la configuración a y ß, que se utilizan como intermedios en el proceso de acuerdo con la invención.
9. ?-Lactonas de alquil éster de ácido 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregna-4,6-dieno-21,21-dicarboxílico de fórmula general (VIII):
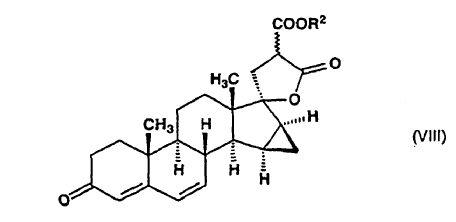
en la que R2 indica un grupo alquilo de 1 a 4 átomos de carbono y el enlace ~ representa la configuración a y ß, que se utilizan como intermedios en el proceso de acuerdo con la invención.
10. 15ß,16ß-metilen-3-alcoxiespiro[androst-3,5-dieno-17oxo-17ß2'-oxirano] de fórmula general (VI):
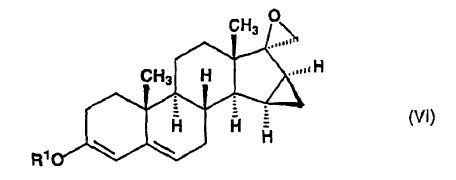
donde R1 representa un grupo alquilo de 1 a 4 átomos de carbono, que se utilizan como intermedios en el proceso de acuerdo con la invención.
11. ?-Lactonas de alquil éster de ácido 17-hidroxi-15ß,16ß-metilen-3-alcoxi-17a-pregna-3,5-dieno-21,21-dicarboxílico de fórmula general (VII):
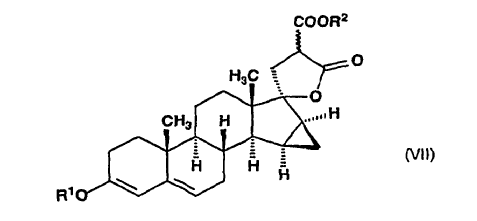
donde R1 y R2 significan un grupo alquilo de 1 a 4 átomos de carbono y el enlace ~ representa la configuración a y ß.
12. Los intermedios siguientes utilizados en el proceso de acuerdo con la invención:
15ß,16ß-metilen-3-metoxiespiro[androst-3,5-dieno-17ß2'-oxirano],
?-lactona de etil éster de ácido 17-hidroxi-15ß,16ß-metilen-3-metoxi-17a-pregna-3,5-dieno-21,21-dicarboxílico,
?-lactona de etil éster de ácido 17-hidroxi-15ß,16ß-metilen-3-oxo-17a-pregna-4,6-dieno-21,21-dicarboxílico,
?-lactona de etil éster de ácido 17-hidroxi-6?,7?;15ß,16ß-bismetilen-3-oxo-17a-pregna-4-eno-21,21-dicarboxílico,
?-lactona de etil éster de ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregna-4-eno-21,21-dicarboxílico, esto es carbetoxi-drospirenona.
Patentes similares o relacionadas:
18-METIL-19-NOR-ANDROST-4-EN-17,17-ESPIROÉTERES (18-METIL-19-NOR-20-ESPIROX-4-EN-3-ONAS), ASÍ COMO PREPARACIONES FARMACÉUTICAS QUE LOS CONTIENEN, del 28 de Abril de 2011, de BAYER SCHERING PHARMA AKTIENGESELLSCHAFT: 18-metil-15ß,16ß-metilen-19-nor-20-espirox-4-en-3-onas de la fórmula general I **Fórmula** en donde Fórmula I Z es un átomo de oxígeno, dos átomos de hidrógeno, […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE DROSPIRENONA, del 1 de Abril de 2011, de INDUSTRIALE CHIMICA S.R.L.: Procedimiento para la preparación de drospirenona, que comprende la oxidación de 17α-(3-hidroxipropil)6β, 7β,115aβ,16β-dimetilen-5β-androstan-3β,5,17β-triol […]
PROCEDIMIENTO DE PREPARACIÓN DE DROSPIRENONA, del 29 de Marzo de 2011, de NEWCHEM S.P.A: Un procedimiento para la preparación de 6 ,7 ,15 ,16 -dimetilen-3-oxo-17 -pregn-4-en-21,17-carbolactona (I) que comprende las siguientes etapas: 1) hacer reaccionar […]
PROCEDIMIENTO INDUSTRIAL PARA LA PREPARACION DE GAMMA-LACTONA DE ACIDO 17-HIDROXI-6-BETA, 7-BETA, 15-BETA, 16-BETA-BISMETILEN-3-OXO-17-ALFA-PREGN-4-ENO-21-CARBOXILICO E INTERMEDIOS CLAVE PARA ESTE PROCEDIMIENTO, del 27 de Septiembre de 2010, de RICHTER GEDEON NYRT: Procedimiento industrial para la preparación de ?-lactona de ácido 17-hidroxi-6ß,7ß;15ß,16ß-bismetilen-3-oxo-17a-pregn-4-eno-21-carboxílico de fórmula […]
PROCEDIMIENTO PARA LA PREPARACION DE 6BETA,7BETA;15BETA,16BETA-DIMETILEN-5BETA-HIDROXI-3-OXO-17ALFA-ANDROSTANO-21,17-CARBOLACTONA, del 6 de Abril de 2010, de SCHERING AKTIENGESELLSCHAFT: Procedimiento para la preparación de 6ß,7ß;15ß,16ß-dimetilen-5ß-hidroxi-3-oxo-17a-androstano-21,17-carbolactona (5ß-OH-DRSP) por oxidación del 17a-(3-hidroxi-1-propil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstano-3ß,5,17ß-triol […]
18-METIL-19-NOR-17-PREGN-4-ENO-21,17-CARBOLACTONAS, ASI COMO PREPARADOS FARMACEUTICOS QUE CONTIENEN ESTOS COMPUESTOS, del 29 de Diciembre de 2009, de BAYER SCHERING PHARMA AKTIENGESELLSCHAFT: 18-metil-19-nor-17-pregn-4-eno-21,17-carbolactonas de la fórmula general I **(Ver fórmula)** en la que Z significa un átomo de oxígeno, dos átomos de hidrógeno, una […]
PROCESO PARA EL AISLAMIENTO SELECTIVO, PURIFICACIÓN Y SEPARACIÓN DE COMPUESTOS 3,17-DICETOESTEROIDES MONOHIDROXILADOS, del 28 de Julio de 2011, de RICHTER GEDEON NYRT: Proceso para el aislamiento selectivo, purificación y separación de compuestos 3,17-dicetoesteroides monohidroxilados a partir de una solución obtenida […]
COMPUESTO GLUCOCORTICOSTEROIDE ESPECIFICO QUE TIENE ACTIVIDAD ANTIINFLAMATORIA, del 6 de Agosto de 2010, de GLAXO GROUP LIMITED: Un compuesto de fórmula (I)