METODOS PARA PRODUCIR PROTEINAS RECOMBINANTES.
Un método para seleccionar una tasa de crecimiento para controlar la distribución de una proteína recombinante entre el sobrenadante y el periplasma en cultivos de células hospedantes de E.
coli de modo que la distribución de la proteína recombinante sea más adecuada para la recuperación primaria de la proteína recombinante, en la que la expresión de la proteína recombinante por dichas células está bajo el control de un sistema inducible, cuyo método comprende:
a) proporcionar un cultivo de células hospedantes de E. coli
b) cambiar la tasa de crecimiento de las células hospedantes de E. coli tal que la tasa de crecimiento esté en el intervalo de 0,0005 a 0,04/h.
c) inducir la expresión de la proteína recombinante en la que las etapas (b) y (c) pueden ser realizadas en cualquier orden o simultáneamente; y subsiguientemente
d) determinar el rendimiento de proteína recombinante en el sobrenadante de cultivo y el periplasma de las células hospedantes de E. coli
e) comparar el rendimiento determinado en la etapa (d) con el rendimiento determinado cuando al menos una otra tasa de crecimiento ha sido usada en la etapa (b)
f) seleccionar una tasa de crecimiento a partir de la comparación hecha en la etapa (e) en la que la distribución de la proteína recombinante entre el sobrenadante y el periplasma es más adecuado para la recuperación primaria de la proteína recombinante
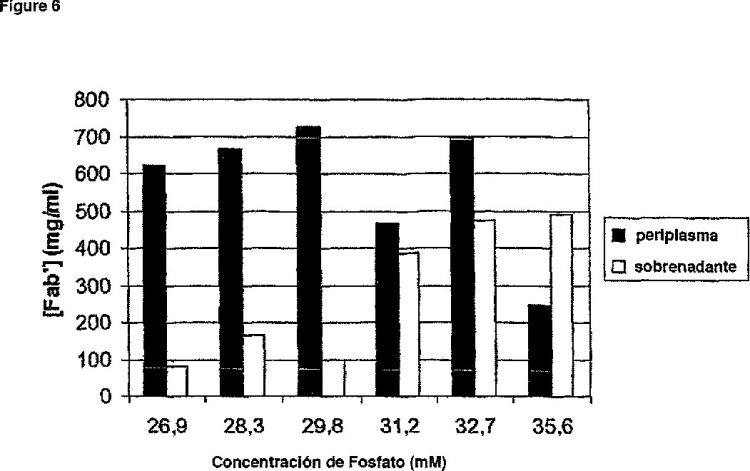
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2004/003747.
Solicitante: UCB PHARMA, S.A..
Nacionalidad solicitante: Bélgica.
Dirección: ALLEE DE LA RECHERCHE 60,1070 BRUSSELS.
Inventor/es: GLOVER,DAVID JOHN,CELLTECH R & D LIMITED, SEHDEV,MUKESH,CELLTECH R & D LIMITED, REEKS,DOMINIC GAMBIER,CELLTECH R & D LIMITED.
Fecha de Publicación: .
Fecha Concesión Europea: 6 de Enero de 2010.
Clasificación Internacional de Patentes:
- C12N1/20 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Bacterias; Sus medios de cultivo.
- C12P21/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
Clasificación PCT:
- C07K16/00 C […] › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/72 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Sistemas de expresión que utilizan secuencias reguladoras derivadas del operón lac.
- C12P21/02 C12P 21/00 […] › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
Clasificación antigua:
- C07K16/00 C07K […] › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/72 C12N 15/00 […] › Sistemas de expresión que utilizan secuencias reguladoras derivadas del operón lac.
- C12P21/02 C12P 21/00 […] › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
Fragmento de la descripción:
Métodos para producir proteínas recombinantes.
Campo del invento
El presente invento se refiere generalmente a métodos para producir proteínas recombinantes en cultivos de células hospedantes de Escherichia coli y más específicamente proporciona un método para controlar la partición de dichas proteínas entre el periplasma de las células hospedantes de E. coli y el sobrenadante del cultivo.
E. coli es un sistema ampliamente usado y muy conveniente para la producción de proteínas recombinantes. Las ventajas de este sistema comprenden la facilidad de la manipulación génica, la disponibilidad de reactivos que incluyen los vectores de expresión génica, la facilidad de producir cantidades de proteína, la velocidad y la alta adaptabilidad del sistema para expresa una amplia variedad de proteínas. Para una revisión véase Bañéis, Current Opinión in Biotehcnology, 1999, 10, 411-421. E. coli es ahora ampliamente usada para la producción a gran escala de proteínas terapéuticas tales como insulina, hormona de crecimiento y antibióticos (Swartz, Current Opinion in Biotechnology, 2001, 12, 195-201; Humphreys y Glover, Current Opinion in Drug Discovery and Development, 2001, 4, 172-185; Verma y otros, Journal of Immunological Methods, 1998, 216, 165-181; Simmons y otros, Journal of Immunological Methods, 2002, 263, 133-147.
La expresión de cualquier gen externo en E. coli comienza con la inserción de una copia de cADN del gen en un vector de expresión. Muchas formas del vector de expresión están disponibles. Tales vectores comprenden normalmente un origen de replicación del ADN plasmídico, un marcador de selección por antibióticos y un promotor y terminador transcripcional separado por un sitio de clonaje múltiple (casete de expresión) y una secuencia de ADN que codifica al menos un sitio de unión al ribosoma. La transcripción del gen externo es normalmente controlada por un promotor regulable, que permite que el crecimiento celular se separe del producto de síntesis resultante en mayores cantidades que si la proteína estuviera expresada de modo constitutivo. Un rendimiento máximo de la proteína puede ser logrado determinado el punto óptimo durante la fermentación para la expresión a ser inducida, típicamente una vez que las células han sido hechas crecer a una alta densidad celular.
Proteínas recombinantes expresadas en E. coli pueden ser producidas en el citoplasma, o secretadas en el periplasma o el sobrenadante dependiendo de la naturaleza de la proteína y sus requerimientos de plegamientos (Makrides, Microbiological Reviews, 1996, 60, 512-538). Por ejemplo, las proteínas pueden ser dirigidas al periplasma vía una secuencia señal y la expresión en el periplasma puede ofrecer varias ventajas sobre la expresión en el citoplasma, incluyendo números bajos de proteínas de las células hospedantes, menor degradación de la proteína recombinante y un entorno oxidante que facilita el plegamiento proteico adecuado.
Mientras que el rendimiento proteico durante la fermentación es un factor esencial que influyen en el coste de producción de proteínas recombinantes en E. coli, el coste del procesamiento aguas abajo (DSP) de la proteína producida es también importante a la hora de determinar el coste final de los bienes. El término DSP comprende todas las etapas que siguen a la fermentación de E. coli que da como resultado un proteína funcional purificada final. Dependiendo de la localización celular de la proteína recombinante producida, estas etapas pueden incluir típicamente las etapas de recuperación primaria tal como centrifugación, filtración, extracción y concentración/diafiltración seguida por una o más etapas de purificación. Maximizar la eficacia de estas etapas para obtener un alto rendimiento de proteína funcional es clave para minimizar costes durante la producción a gran escala de proteínas recombinantes. La naturaleza de las primeras etapas de recuperación usadas durante DSP afectaran al rendimiento y calidad de la proteína recombinante obtenida y dependerá de varios factores incluyendo, la escala de producción, la naturaleza de la proteína y su localización celular al final de la fermentación. Por ejemplo, una consideración importante para las proteínas recombinantes producidas en el periplasma es el nivel de escapes de la proteína recombinante en el sobrenadante, ya que un nivel natural de escapes tiene lugar durante la fermentación y esto puede tener efectos perjudiciales en el rendimiento y calidad de la proteína recombinante obtenida a partir del periplasma. Shokri y otros, 2002, Applied Microbiology and Biotechnology, 58, 3, 386-392 describe el efecto de la tasa de crecimiento en los escapes de una proteína recombinante de E. coli. Las tasas de crecimiento ensayadas estuvieron en el intervalo de 0,05/h-0,6/h. los escapes de proteínas periplasmáticas en el medio se encontró que tenían un valor óptimo a 0,3/h.
En los casos en que niveles elevados de proteína recombinante se escapan en el sobrenadante, la viscosidad del sobrenadante aumenta, haciendo la recuperación primaria de las células mediante centrifugación o filtración mas difícil y por tanto reduciendo el rendimiento de proteínas obtenidas a partir del periplasma. Las células en sí mismas son también menos robustas durante la centrifugación y son más susceptibles de lisarse dando como resultado un daño a la proteína y aumentando los niveles de proteínas en el sobrenadante reduciendo de nuevo el rendimiento. Un problema adicional es que la calidad de la proteína recuperada del periplasma durante la extracción puede también ser reducida por la contaminación con una proteína recombinante a partir del sobrenadante que puede no plegarse correctamente o puede estar parcialmente degradada.
Es por lo tanto deseable mejorar la eficacia de la recuperación primaria de las proteínas recombinante y por tanto mejorar el rendimiento final y calidad de la proteína funcional obtenida controlando la distribución de las proteínas recombinantes entre el periplasma y el sobrenadante.
En el presente invento, los autores han sido capaces de demostrar que es posible controlar la distribución de las proteínas recombinantes entre el sobrenadante y el periplasma en los cultivos de células hospedantes de E. coli ajustando la tasa de crecimiento de células hospedantes de E. coli. Seleccionando una tasa de crecimiento adecuada basado en la distribución de la proteína entre el sobrenadante y el periplasma y no necesariamente en el rendimiento solo, la calidad y/o rendimiento proteico puede ser aumentado.
Así, según el presente invento, se proporciona un método para seleccionar una tasa de crecimiento para controlar la distribución de una proteína recombinante entre el sobrenadante y el periplasma en cultivos de células hospedantes de E. coli de tal modo que la distribución de la proteína recombinante se ajusta más a la recuperación primaria de la proteína recombinante, mientras que la expresión de la proteína recombinante por dichas células está bajo el control de un sistema inducible, método que comprende:
La proteína recombinante para usar en el presente invento puede ser cualquier péptido, polipéptido o proteína que tenga más de alrededor de 10 aminoácidos. La proteína puede ser derivada de cualquier fuente incluyendo bacterias pero más particularmente a partir de fuentes mamíferas. En un ejemplo la proteína recombinante...
Reivindicaciones:
1. Un método para seleccionar una tasa de crecimiento para controlar la distribución de una proteína recombinante entre el sobrenadante y el periplasma en cultivos de células hospedantes de E. coli de modo que la distribución de la proteína recombinante sea más adecuada para la recuperación primaria de la proteína recombinante, en la que la expresión de la proteína recombinante por dichas células está bajo el control de un sistema inducible, cuyo método comprende:
2. El método según la reivindicación 1, en el que los rendimientos comparados en la etapa (e) son de al menos dos cultivos hechos crecer simultáneamente usado una tasa de crecimiento diferente en cada cultivo en la etapa (b).
3. El método según la reivindicación 1, en el que los rendimientos comparados en el etapa (e) son de al menos dos cultivos hechos crecer secuencialmente usando una tasa de crecimiento diferente en cada cultivo en la etapa (b).
4. El método según la reivindicación 1, en el que los rendimientos comparados en la etapa (e) son de un cultivo hecho crecer a al menos dos tasa de crecimiento diferentes llevando a cabo etapas (a) a (d) usando una tasa de crecimiento en la etapa (b) y luego llevando a cabo las etapas (b) y (d) al menos una vez más variando la tasa de crecimiento en la etapa (b) cada vez.
5. El método según las reivindicaciones 1 a 4, en el que la tasa de crecimiento en la etapa (b) es reducida.
6. El método según las reivindicaciones 1 a 5 en el que cambiando la tasa de crecimiento de las células hospedantes de E. coli en la etapa (b) comprende ajustar el nivel de carbono disponible en las células.
7. El método de la reivindicación 6, en el que la fuente de carbono es seleccionada de glucosa, lactosa, sacarosa, fructosa, glicerol, succinato y lactato.
8. El método de la reivindicación 7, en el que la fuente de carbono es glicerol.
9. El método según las reivindicaciones 1 a 8, en el que cambiando la tasa de crecimiento de las células hospedantes de E. coli en la etapa (b) comprende ajustar el nivel de fosfato disponible a las células.
10. El método según las reivindicaciones 1 a 9, en el que cambiando la tasa de crecimiento de las células hospedantes de E. coli en la etapa (b) comprende ajustar el nivel de oxígeno disponible a las células.
11. El método según las reivindicaciones 1 a 10, en el que la proteína recombinante es dirigida al periplasma.
12. El método de la reivindicación 11, en el que la tasa de crecimiento seleccionada en la etapa (f) es una tasa de crecimiento en la que más del 80% de la proteína recombinante producida por las células hospedantes está expresada en el periplasma.
13. El método según las reivindicaciones 1 a 10, en el que la proteína recombinante es dirigida al sobrenadante.
14. El método de la reivindicación 13, en el que la tasa de crecimiento seleccionada en al etapa (f) es una tasa de crecimiento en la que más del 80% de la proteína recombinante producida por las células hospedantes es producida en el sobrenadante.
15. El método según las reivindicaciones 1-14, en el que el sistema inducible comprende un promotor derivado de lac.
16. El método de la reivindicación 15, en el que el promotor derivado de lac es lac, tac o trc.
17. El método según las reivindicaciones 15 ó 16, en el que el promotor es inducido con lactosa o IPTG.
18. El método según las reivindicaciones 1-17, en el que la proteína recombinante es un anticuerpo o un fragmento del mismo.
19. El método según la reivindicación 18, en el que el anticuerpo es una IgG.
20. El método según la reivindicación 18, en el que el fragmento es un Fab, Fab', F(ab')2 o scFv.
Patentes similares o relacionadas:
Método para producir carne capaz de reducir el consumo de ácidos grasos saturados, del 22 de Julio de 2020, de Biobalance Co., Ltd: Lactobacillus plantarum BB-PLT (NITE BP-02097).
Composición adecuada para proteger microorganismos, del 15 de Julio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición que comprende un material soporte formado por un polisacárido, al menos un antioxidante y una combinación de aminoácidos seleccionados entre cisteína y […]
Consorcio de microorganismos y su uso para reducir la demanda química de oxígeno del fluido consumido para trabajar metales, del 15 de Julio de 2020, de FORD MOTOR COMPANY LIMITED: Un consorcio de microorganismos que comprende, consiste o consiste esencialmente en Rhizobium radiobacter NCIMB 42280, Bacillus subtilis NCIMB […]
PROCEDIMIENTO DE OBTENCIÓN DE SUBPRODUCTOS A PARTIR DE RESIDUOS DE CAFÉ Y APLICACIONES DE LOS MISMOS, del 13 de Julio de 2020, de UNIVERSIDAD DE GRANADA: Procedimiento de obtención de subproductos a partir de residuos de café y aplicaciones de los mismos. La presente invención consiste en un proceso […]
UNA FORMULACIÓN PARA LA PROTECCIÓN CONTRA LA BACTERIOSIS DEL KIWI, CAUSADA POR LA BACTERIA PSEUDOMONAS SYRINGAE PV. ACTINIDIAE (PSA), del 9 de Julio de 2020, de UNIVERSIDAD DE CONCEPCION: La tecnología corresponde a una formulación para la protección contra la bacteriosis del kiwi, causada por la bacteria Pseudomonas syringae […]
Novedosa cepa de Gluconacetobacter diazotrophicus (Gd) y uso de la misma en agricultura, del 8 de Julio de 2020, de Azotic Technologies Ltd: Una cepa fijadora de nitrógeno de Gluconacetobacter diazotrophicus (Gd) depositada por CABI en el Reino Unido con el número de acceso del depósito IMI 504958.
Selección y uso de cepas de bacilos tolerantes al frío como fitoestimuladores biológicos, del 8 de Julio de 2020, de Abitep GmbH: Composición para estimular el crecimiento de plantas de cultivo, caracterizada por el hecho de que contiene la cepa tolerante al frío Bacillus atrophaeus ABI02A […]
PROCEDIMIENTO PARA REDUCIR EL CONTENIDO DE HISTAMINA EN VINOS, del 7 de Julio de 2020, de PAGO DE CARRAOVEJAS, S.L: Procedimiento para reducir el contenido de histamina en vinos. La invención consiste en un proceso a través del cual, seleccionando una serie de poblaciones de bacterias […]