Procedimiento para la preparación de 2-hidroxi-4-fenil-3,4-dihidro-2H-cromen-6-il-metanol y (R)-feso-deacilo.
Procedimiento para la preparación de 2-hidroxi-4-fenil-3,4-dihidro-2H-cromen-6-il-metanol de fórmula (I),
**Fórmula**
que comprende:
a. la sililación del 4-hidroximetilfenol de fórmula (A)**Fórmula**
con un agente de sililación para obtener el compuesto bis-sililado de fórmula (B)**Fórmula**
en la que PG es un grupo protector sililado;
b. la desprotección selectiva del hidroxilo fenólico del compuesto bis-sililado de fórmula (B) para obtener el compuesto monosililado de fórmula (C)**Fórmula**
c. la reacción del compuesto de fórmula (C) con trans-cinamaldehído y una amina secundaria cíclica de fórmula (F)**Fórmula**
en la que
- R4 y R5 iguales o diferentes entre sí son hidrógeno, alquilo C1-C6 o arilo y n varía entre 1 y 4;
- W es (CH2)m variando m entre 0 y 1, NR6 (siendo R6 ≥ alquilo C1-C6 o arilo), O o S;
para obtener el compuesto de fórmula (D)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2011/051896.
Solicitante: Chemi SPA.
Nacionalidad solicitante: Italia.
Dirección: Via Dei Lavoratori, 54 20092 Cinisello Balsamo (MI) ITALIA.
Inventor/es: TURCHETTA, STEFANO, ZENONI, MAURIZIO, DE FERRA, LORENZO, CIAMBECCHINI,UMBERTO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C215/54 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 215/00 Compuestos que contienen grupos amino e hidroxi unidos a la misma estructura carbonada. › unidos a través de cadenas carbonadas con al menos tres átomos de carbono entre los grupos amino y el ciclo aromático de seis miembros o el sistema cíclico condensado que contenga este ciclo.
- C07C219/28 C07C […] › C07C 219/00 Compuestos que contienen grupos amino e hidroxi esterificados unidos a la misma estructura carbonada. › con grupos amino unidos a átomos de carbono acíclicos de la estructura carbonada.
- C07D311/20 C07 […] › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 311/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que contienen un átomo de oxígeno como único heteroátomo, condensados con otros ciclos. › hidrogenados en el heterociclo.
PDF original: ES-2522549_T3.pdf




Fragmento de la descripción:
Procedimiento para la preparación de 2-h¡droxi-4-fen¡l-3,4-d¡h¡dro-2H-cromen-6-il-metanol y (R)-feso-deacilo
La presente invención se refiere a un procedimiento mejorado y ventajoso industrialmente para la preparación de los productos intermedios 2-hidroxi-4-fen¡l-3,4-d¡h¡dro-2H-cromen-6-¡l-metanol, también denominado feso-cromenilo y 5 (R)-2-[3-(diisopropilamino)-1-fenilpropil]-4-(hidroximetil)fenol, también denominado (R)-feso-deacilo, que a su vez se usan en la síntesis de la fesoterodina y en particular del fumarato de fesoterodina. Este procedimiento utiliza reactivos que no son tóxicos y son manejables a nivel industrial y permite obtener una forma cristalina estable y no higroscópica nueva del producto intermedio clave (R)-feso-deacilo, denominado forma B.
Estado de la técnica
Fumarato de fesoterodina es la denominación común internacional (DCI) del principio activo hidrogenofumarato de isobutirato de 2-[(R)-3-diisopropilammonio-(1 -fenilpropil)-4-(hidroximetil)]fenilo, cuya fórmula estructural se indica a continuación.
**(Ver fórmula)**El fumarato de fesoterodina se aprobó en Europa y en los EE.UU. para el tratamiento del síndrome de vejiga 15 hiperactiva con el nombre comercial de TOVIAZ®.
Se describió el fumarato de fesoterodina por primera vez en el documento US685865, que da a conocer la preparación del principio activo a través de la salificación de fesoterodina con ácido fumárico, según el esquema indicado a continuación.
**(Ver fórmula)**A su vez, la preparación de fesoterodina (también denominada fesoterodina de base) se describe en el documento US6713464, donde se prepara partiendo del precursor desacetilado (R)-feso-deacilo, según el esquema indicado a continuación.
**(Ver fórmula)** **(Ver fórmula)**(R)-FESO-DEACILO FESOTERODINA DE BASE
(R)-Feso-deacilo constituye un producto intermedio clave para la preparación de fumarato de fesoterodina.
La preparación del (R)-feso-deacilo se describe por primera vez en el documento US5559269. En esta patente, se prepara a partir de para-bromofenol; el procedimiento de síntesis relativo consiste en numerosas etapas. Además, utiliza reactivos que son difíciles de usar a nivel Industrial tales como hidruro de aluminio y litio y reactivos de Grignard.
La preparación de (R)-feso-deacllo puede realizarse según la descripción dada a conocer en el documento US689214. Pero también en este caso, la síntesis revela desventajas debido a las utilizaciones que son difíciles de ¡mplementar a nivel industrial tales como DIBAL, hidruro de aluminio y litio y agentes redisolventes caros tales como clnconldina. Siguiendo el ejemplo de las síntesis conocidas en la técnica, puede observarse que la síntesis breve para la preparación de (R)-feso-deacllo también podría proporcionarse partiendo de 2-hidroxi-4-fenil-3,4-dihidro-2H- cromen-6-ll-metanol, también denominado feso-cromenllo, descrito en el esquema indicado a continuación.
**(Ver fórmula)** **(Ver fórmula)**En la bibliografía, diversos métodos usados para obtener productos intermedios relacionados con feso-cromenilo que merece la pena mencionar incluyen el artículo de Jurd que da a conocer la reacción entre fenoles, clnamaldehído y morfollna para preparar 2-morfol¡n¡l-4-fen¡lbenzopiranos (Journal of Heterocycllc Chemlstry, vol. 28 (4), páginas 983-986(1991)).
Siguiendo tal bibliografía de referencia, el documento W2713844 describe la preparación de fesoterodina usando (2-hidroxi-4-fenil-3,4-dihidro-2H-cromen-6-il)metanol. Tal síntesis, con respecto a lo que se conoce en la técnica anterior, es aparentemente ventajosa porque requiere pocas etapas y el uso de reactivos comunes. Sin embargo, el rendimiento indicado en el documento W2713844 para (R)-feso-deacllo asciende al 12%. Tal rendimiento no es satisfactorio en lo que se refiere a la aplicación industrial, y se debe esencialmente al bajo rendimiento del paso con respecto a la preparación del derivado de feso-cromenllo, que es equivalente al 53,4%.
El documento W27/13844 da a conocer la conversión de 4-hidroximetil-fenol en (2-hidroxi-4-fenil-3,4-dihidro- 2H-cromen-6-il)-metanol pasando a través de 3,4-d¡hidro-2-(4-metil-1-piperazinil)-4-fenil-(2H)-1-benzopiran-6- metanol.
El documento WO21/18484 da a conocer además la conversión de 4-hidroximetil-fenol y cinamaldehído en (2- h¡drox¡-4-fenil-3,4-d¡h¡dro-2H-cromen-6-ll)-metanol.
La preparación del 4-hidroximetil-fenol monoprotegido se da a conocer en Tetrahedron Letters, vol. 1. 28, n.° 37, páginas 437-431, 1987.
El documento US685865 da a conocer compuestos altamente puros, cristalinos, estables de 3,3-difenilpropilaminas en forma de sus sales.
El documento EP95773 enseña un procedimiento para la monoprotección selectiva de 2-[3-(düsoprop¡lam¡no)-1-
fenilprop¡l]-4-(hidrox¡met¡l)-fenol.
Por tanto, todavía surge la necesidad de proporcionar un método eficaz, que pueda utilizar reactivos que pueden usarse a nivel industrial para la síntesis de (R)-feso-deacilo.
Breve descripción de los dibujos
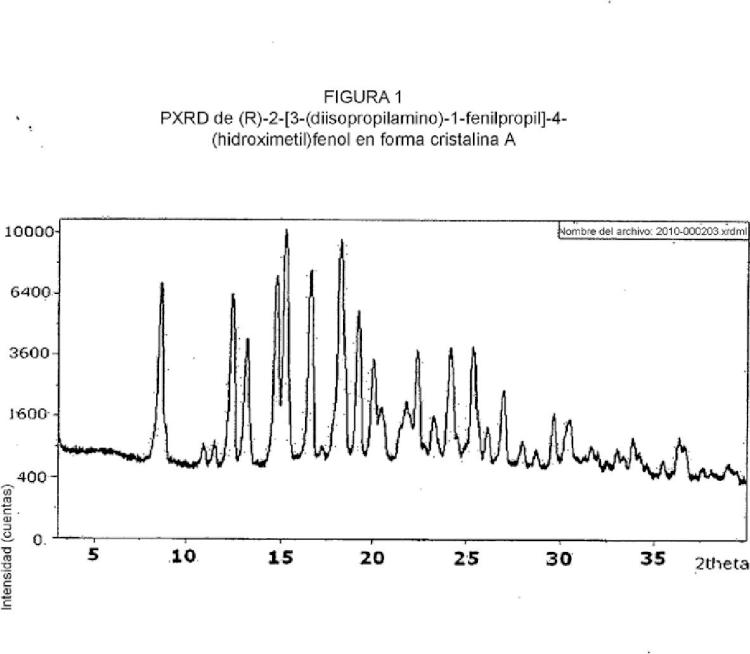
Figura 1: PXRD de la forma cristalina A del (R)-feso-deacilo.
Figura 2: DSC de la forma cristalina A del (R)-feso-deacilo.
Figura 3: TGA de la forma cristalina A del (R)-feso-deacilo.
Figura 4: FT-IR de la forma cristalina A del (R)-feso-deacilo.
Figura 5: PXRD de la forma cristalina B de (R)-feso-deacilo.
Figura 6: DSC de la forma cristalina B de (R)-feso-deacilo.
Figura 7: TGA de la forma cristalina B de (R)-feso-deacilo.
Figura 8: FT-IR de la forma cristalina B de (R)-feso-deacilo.
Descripción
Ahora, se ha descubierto sorprendentemente un nuevo procedimiento para la preparación de feso-cromenilo, en algunas etapas y usando reactivos manejables a nivel industrial.
Con el objetivo de mejorar la síntesis descrita en el documento W2713844, en particular con respecto a la etapa de síntesis a partir de 4-hidroximetilfenol para dar iso-cromenilo, se descubrió sorprendentemente que proteger el grupo metileno del 4-hidroximetilfenol con un grupo sililado y someter tal producto a la reacción con cinamaldehído y morfolina permite obtener (2-hidroxi-4-fenil-3,4-dihidro-2H-cromen-6-il)metanol, es decir, feso- cromenilo, con rendimientos que exceden el 6%.
Se indica una descripción esquemática de este nuevo método de síntesis en el esquema a continuación.
**(Ver fórmula)**Los grupos protectores sililados de los hidroxilos, es decir, los silil éteres, al igual que los métodos de desprotección correspondientes, se conocen bien en la bibliografía y se describen, por ejemplo, en Green et al. Protective groups in 25 organic synthesis, 3a edición, páginas 113-148, Wiley Interscience, 1999. Con respecto a la presente invención, el término agente de sililación se usa por tanto para indicar cualquier reactivo que pueda formar un silil éter con las funciones hidroxilo del p-hidroximetilfenol. Ejemplos de agentes de sililación son:
R1R2R3SÍX en el que R-i, R2 y R3 son grupos iguales o diferentes entre sí y representan alquilo C1-C6 lineal o ramificado o residuos arilo sustituidos de manera diversa y X es un halógeno o un grupo sulfonato tal como 3 metanosulfonato o trifluorometanosulfonato; ejemplos preferidos son clorotrimetilsilano, clorotrietilsilano, cloruro de t-
butil-dimetil-sMNo, cloruro de t-but¡l-difenil-sililo, triflato de trimetilsililo.
CY3CO(Me3S¡)=NH(Me3S¡) representa reactivos en los que Y puede ser hidrógeno o halógenos, tales como bis- trlmetllsllllacetamida y bis-trimetilsilil-trifluoroacetamida.
(Me3SINH)2C=, es decir la bis-trimetilsililurea.
Los agentes de sililación particularmente preferidos con respecto a la presente invención son cloruro de trimetilsililo y cloruro de t-butlldimetilsililo.
El término PG se usa para indicar un grupo protector sililado obtenido tras la reacción del p-hidroximetilfenol con un agente de sililación y, en particular, con uno de los agentes de sililación descritos anteriormente. Por ejemplo, usando un compuesto del tipo de R1R2R3SÍX como agente de sililación, el grupo PG derivado del mismo es -S¡RiR2R3.
La expresión una sola etapa se usa para indicar una serie de reacciones consecutivas en las que no se aíslan los diferentes productos intermedios.
El 4-hldroxlmetllfenol de fórmula (A), disponible en el mercado,
HO
**(Ver fórmula)**OH
(A)
se hace reaccionar con un agente de sililación. En una realización preferida de la presente invención, el agente de sililación se hace reaccionar en presencia de una base. Dicha base es preferiblemente una base orgánica, incluso más preferiblemente una amina, tal como trietilamina,... [Seguir leyendo]
Reivindicaciones:
Procedimiento para la preparación de 2-hidroxi-4-fenil-3,4-dihidro-2H-cromen-6-il-metanol de fórmula (I),
**(Ver fórmula)**que comprende:
a. la sililación del 4-hidroximetilfenol de fórmula (A)
hoJlX
(A)
con un agente de sililación para obtener el compuesto bis-sililado de fórmula (B)
PG-
**(Ver fórmula)**O-PG
(B)
en la que PG es un grupo protector sililado;
b. la desprotección selectiva del hidroxilo fenólico del compuesto bis-sililado de fórmula (B) para obtener el
compuesto monosililado de fórmula (C)
**(Ver fórmula)**c. la reacción del compuesto de fórmula (C) con trans-cinamaldehído y una amina secundaria cíclica de fórmula (F)
/(CFWn
HN ,W
(CR4Rs)n
(F)
en la que
- R4 y Rs iguales o diferentes entre sí son hidrógeno, alquilo C1-C6 o arilo y n varia entre 1 y 4;
- W es (CH2)m variando m entre y 1, NR6 (siendo R6 = alquilo C1-C6 o arilo), O o S; para obtener el compuesto de fórmula (D)
PG-
**(Ver fórmula)**(D)
d. la desprotección del compuesto de fórmula (D), para obtener el compuesto de fórmula (E)
/ W
**(Ver fórmula)**HO
**(Ver fórmula)**(CR4Rs)n
(E)
2.
3.
4. 15
6.
7.
8. 25
9.
e. la hidrólisis del compuesto de fórmula (E).
Procedimiento según la reivindicación 1, caracterizado porque dicho agente de sililación se selecciona de entre R1R2R3SÍX en el que R1, R2, R3 son residuos de arilo o alquilo lineales o ramificados C1-C6 posiblemente sustituidos, X es un halógeno o un grupo sulfonato; CY3CO(Me3Si)=NH(Me3S¡), en el que Y es hidrógeno o halógeno; o (Me3S¡NH)2C=; preferiblemente dicho agente de sililación es cloruro de trimetilsililo o cloruro de t-butil-dimetilsililo.
Procedimiento según la reivindicación 1, caracterizado porque dicho agente de sililación se usa en presencia de una base, preferiblemente una base orgánica, incluso más preferiblemente una amina tal como por ejemplo trietilamina, diisopropiletilamina, ¡midazol o dimetilaminopiridina.
Procedimiento según la reivindicación 1, caracterizado porque dicha desprotección selectiva del hidroxilo fenólico del compuesto de fórmula (B) se realiza en presencia de una sal de metales alcalinos, preferiblemente acetato de litio o carbonato de ceslo.
Procedimiento según la reivindicación 1, caracterizado porque dicha amina secundaria cíclica se selecciona de entre morfolina, N-metil-piperazina, N-bencil-piperazina, pirrolidina, piperazina, preferiblemente morfolina.
Procedimiento según la reivindicación 1, caracterizado porque dicha desprotección del compuesto de fórmula (D) se realiza en presencia de ión fluoruro, preferiblemente en presencia de fluoruro de tetrabutilamonlo.
Procedimiento según la reivindicación 1, caracterizado porque dicha hidrólisis se produce mezclando la mezcla de reacción con una disolución acuosa que tiene un pH por debajo de 1.
Procedimiento según la reivindicación 7, caracterizado porque se usan de 5 a 1 volúmenes de disolución acuosa por volumen de mezcla de reacción, preferiblemente 1 volúmenes aproximadamente.
Procedimiento según la reivindicación 1, caracterizado porque los compuestos de fórmula (B), (D) y/o (E) no se aíslan.
Procedimiento para la preparación de (R)-2-[3-(diisopropilamino)-1-fenilpropil]-4-(hidroximetil)fenol de fórmula (III),
HO
**(Ver fórmula)**(III)
11. 12.
que comprende:
a. obtener 2-hidroxi-4-fen¡l-3,4-d¡h¡dro-2H-cromen-6-¡l-metanol de fórmula (I) según el procedimiento según una cualquiera de las reivindicaciones 1 a 9;
b. la amlnación reductora del 2-hidroxi-4-fenil-3,4-dihidro-2H-cromen-6-il-metanol de fórmula (I) así obtenido, en presencia de düsopropilamina y un hidruro de metal, para obtener el racemato de 2-[3- (dNsoprop¡lam¡no)-1-fen¡lprop¡l]-4-(h¡droximetil)fenol de fórmula (II),
c. la resolución del compuesto de fórmula (II).
Procedimiento según la reivindicación 1, caracterizado porque dicho hidruro de metal es borohidruro de sodio, hidruro de aluminio y litio, cianoborohidruro de sodio, preferiblemente es borohidruro de sodio.
Procedimiento para la preparación de fesoterodina o fumarato de fesoterodina, que comprende un procedimiento según una cualquiera de las reivindicaciones 1 a 11.
HO
**(Ver fórmula)**CU)
Patentes similares o relacionadas:
Fosfato de tapentadol cristalino, del 13 de Noviembre de 2019, de RATIOPHARM GMBH: Fosfato de tapentadol cristalino
Modificaciones cristalinas del (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)fenol, del 6 de Noviembre de 2019, de GRUNENTHAL GMBH: Un medicamento para uso oral, que contiene una modificación cristalina A del (1R,2R)-3-(3- dimetilamino-1-etil-2-metilpropil)fenol que comprende una reflexión […]
Proceso para la preparación de (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)fenol, del 22 de Marzo de 2017, de GRUNENTHAL GMBH: Procedimiento para preparar (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)- fenol de fórmula (IV)**Fórmula** o una sal de adición de […]
Modificaciones cristalinas de (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)fenol, del 25 de Enero de 2017, de GRUNENTHAL GMBH: Modificación cristalina A de (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)enol que incluye un pico de difracción de rayos X a 15,58 +- 0,20 (2Θ ), adicionalmente […]
Procedimiento para la obtención de 3,3-difenilpropilaminas, del 27 de Julio de 2016, de INTERQUIM, S.A.: El procedimiento para la obtención de 3,3-difenilpropilaminas (I), donde R1 es H, alquilo, haloalquilo o alcoxialquilo, R2 es alquilo, alcoxi, halógeno, NO2, CN, CHO libre o […]
Sales de desfesoterodina, del 23 de Marzo de 2016, de RATIOPHARM GMBH: Una sal succinato de desfesoterodina.
 Nuevo proceso para la síntesis de tapentadol y productos intermedios del mismo, del 24 de Febrero de 2016, de Euticals S.P.A: Proceso para la síntesis de tapentadol que comprende la alquilación de la cetona (VII) con un haluro de etil-metal en un disolvente orgánico**Fórmula**
para […]
Nuevo proceso para la síntesis de tapentadol y productos intermedios del mismo, del 24 de Febrero de 2016, de Euticals S.P.A: Proceso para la síntesis de tapentadol que comprende la alquilación de la cetona (VII) con un haluro de etil-metal en un disolvente orgánico**Fórmula**
para […]
Desfesoterodina en forma de una sal de ácido tartárico, del 11 de Febrero de 2015, de RATIOPHARM GMBH: (R)-2-(3-Diisopropilamino-1-fenilpropil)-4-hidroximetilfenol (desfesoterodina) en forma de una sal de ácido tartárico, en el que la proporción molar de desfesoterodina con respecto […]