Un procedimiento novedoso para la síntesis de sal disódica de pemetrexed.
Un procedimiento para la preparación de éster dietílico de pemetrexed 2 **Fórmula**
que comprende la etapa de purificar la mezcla obtenible haciendo reaccionar los compuestos 1 y 1a en presenciade un agente químico que puede promover la formación de un enlace peptídico en un disolvente orgánicoaprótico**Fórmula**
caracterizado por que se somete la mezcla a las siguientes etapas:
a) lavado con una solución básica acuosa que tiene un pH de desde 7 hasta 10;
b) concentración de la fase orgánica;
c) adición de un disolvente orgánico polar y/o una mezcla de disolventes orgánicos polares;
d) precipitación del éster dietílico de pemetrexed 2 calentando la mezcla obtenida en la etapa c) hasta unatemperatura de desde 50 hasta 80 ºC y a continuación enfriándola hasta una temperatura de desde 0 hasta10 ºC.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E11174646.
Solicitante: Chemi SPA.
Nacionalidad solicitante: Italia.
Dirección: Via Dei Lavoratori, 54 20092 Cinisello Balsamo (MI) ITALIA.
Inventor/es: TURCHETTA, STEFANO, ZENONI, MAURIZIO, DE FERRA, LORENZO, CIAMBECCHINI,UMBERTO, BRANDI,PAOLO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D487/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 487/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del ciclo en el sistema condensado, no previstos por los grupos C07D 451/00 - C07D 477/00. › Sistemas condensados en orto.
PDF original: ES-2438720_T3.pdf
Fragmento de la descripción:
Un procedimiento novedoso para la síntesis de sal disódica de pemetrexed La presente invención se refiere a un procedimiento novedoso para la preparación de éster dietílico de pemetrexed2
que comprende la etapa de purificar la mezcla obtenible haciendo reaccionar los compuestos 1 y 1a en presencia de un agente químico que puede promover la formación de un enlace peptídico en un disolvente orgánico aprótico caracterizado por que se somete la mezcla a las siguientes etapas:
a) lavado con una solución básica acuosa; 10 b) concentración de la fase orgánica;
c) adición de un disolvente orgánico polar y/o una mezcla disolventes orgánicos polares;
d) precipitación del éster dietílico de pemetrexed 2.
La presente invención también se refiere a un procedimiento para la preparación de la sal disódica5
que comprende el procedimiento mencionado anteriormente para la preparación del éster dietílico de pemetrexed2. Descripción de la invención Pemetrexed es la denominación común internacional (DCI) del ingrediente activo ácido N-[4-[2- (2-amino-4, 7-dihidro-4-oxo-1H-pirrolo[2, 3-d]pirimidin-5-il) etil]benzoil]-L-glutámico, compuesto 4:
La sal disódica relacionada, el compuesto 5,
es el ingrediente activo contenido en la especialidad farmacéutica ALIMTA® que se usa ampliamente en el tratamiento de carcinoma de pulmón no microcítico (NSCLC) y mesotelioma pleural maligno y está siendo investigado para su aplicación en el tratamiento de otras patologías oncológicas.
Pemetrexed pertenece a la clase de los antifolatos multi dirigidos, es decir, los ingredientes activos antitumorales que actúan en el nivel de varios sistemas de enzimas dependientes de folato implicados en la biosíntesis de purinas y pirimidinas, el punto de partida para la biosíntesis de ADN y ARN.
Se describió la síntesis de pemetrexed por primera vez en el documento US 5.344.932. Esa síntesis comienza a partir del compuesto 2-amino-7H-pirrolo[2, 3-d]pirirnidin-4-ol que, después de la protección del grupo amina y la posterior
yodinación del anillo pirrol, se hace reaccionar con 2- (4-etinilbenzamido) pentanodioato de (S) -dimetilo. El producto de esta reacción, después de una secuencia de reacciones simples, se convierte en pemetrexed. De acuerdo con el documento US 5.416.211 más reciente, que está incorporado en el presente documento por referencia, pemetrexed se puede sintetizar a partir de ácido 4-[2- (2-amino-4, 7-dihidro-4-oxo-1H-pirrolo[2, 3-d]pirimidin-5-il) etil]benzoico de fórmula 1, obtenido a partir de precursores simples, de acuerdo con el siguiente esquema 1:
Esquema 1
Parece que también este segundo procedimiento se usa para la preparación industrial del ingrediente activo. De hecho, también se describe el mismo tipo deesquema de síntesis en C. J. Barnett, T. W.Wilson y M. E. Kobierski, Org. Proc. Res. & Develop., 1999, 3, 184-188, en el que los ejemplos experimentales se refieren a una escala del orden de decenas de kg.
En el transcurso de los experimentos destinados a optimizar y mejorar la metodología de síntesis del esquema 1, sorprendentemente ahora se ha descubierto que se puede aislar el éster dietílico de pemetrexed 2 con rendimientos altos en forma cristalina con un alto grado de pureza. Este resultado experimental es totalmente inesperado porque los únicos ejemplos de la literatura que informan del aislamiento del éster dietílico de pemetrexed 2 como un sólido se 25 refieren a preparaciones analíticas en las que el compuesto en bruto se purifica de forma cromatográfica, se recoge en solución y a continuación se aísla por la evaporación del disolvente (E. C. Taylor y B. Liu, J. Org. Chem. 2003, 6S, 9938-9947 en la página 9945, síntesis del compuesto 25a, p.f. 84-86 ºC, con caracterización IR; C. J. Barnett, T. W. Wilson y M. E. Kobierski, Org. Proc. Res. & Develop., 1999, 3, 184-188 en la página 188, síntesis del compuesto 13.
p.f. 169-171) .
Por lo tanto, la presente invención se refiere a un procedimiento novedoso para la preparación de éster dietílico de pemetrexed 2
que comprende la etapa de purificar la mezcla obtenible haciendo reaccionar los compuestos 1 y 1a en presencia de un agente químico que puede promover la formación de un enlace peptídico en un disolvente orgánico aprótico caracterizado por que se somete la mezcla a las siguientes etapas: a) lavado con una solución básica acuosa y posterior separación de la fase acuosa de la fase orgánica así obtenida; b) concentración de la fase orgánica; c) adición de un disolvente orgánico polar y/o una mezcla disolventes orgánicos polares; d) precipitación del éster dietílico de pemetrexed 2. De acuerdo con la invención, el agente químico que puede promover la formación de un enlace peptídico se selecciona
preferentemente de CDMT (2-cloro-4, 6-dimetoxi-1, 3, 5-triazina) , DCC (N, N'-diciclohexilcarbodiimida) , HOBT (hidroxibenzotriazol) , EDC (1-etil-3- (3-dimetilaminopropil) carbodiimida) , más preferentemente CDMT (2-cloro-4, 6-dimetoxi-1, 3, 5-triazina) .
De acuerdo con la invención, el disolvente orgánico aprótico se selecciona preferentemente de dimetilformamida, dimetilacetamida, diclorometano, cloroformo, acetato de etilo y/o una mezcla de los mismos, y más preferentemente es una mezcla de dimetilformamida y diclorometano.
De acuerdo con la invención, preferentemente la solución acuosa básica es una solución de hidróxidos, fosfatos, carbonatos o bicarbonatos de metales alcalinos o metales alcalinotérreos, más preferentemente de bicarbonato de sodio.
La solución básica acuosa tiene un pH de desde 7 hasta 10, preferentementemayor de 7 y menor de o igual a 8.
De acuerdo con la invención, preferentemente el disolvente orgánico polar es un alcohol C1-C4, una cetona alifática o aromática, dimetilsulfóxido o mezclas de los mismos, más preferentemente etanol. Preferentemente, se usan de 5 a 15 volúmenes de disolvente orgánico polar (ml) , más preferentemente de 8 a 12, para
parte en peso del éster de pemetrexed 2 titrado en el residuo obtenido después de concentrar la fase orgánica (g) . De acuerdo con la invención, la precipitación se efectúa calentando la mezcla obtenida en la etapa c) hasta una temperatura de desde 50 hasta 80 ºC, preferentemente de desde 60 hasta 65 ºC, y a continuación enfriándola hasta
una temperatura de desde 0 hasta 10 ºC, preferentemente hasta aproximadamente 5 ºC; preferentemente esta temperatura se mantiene durante un periodo de desde 1 hasta 10 horas, preferentemente 4 horas. En un modo de realización preferente de la presente invención, la precipitación tiene lugar a una temperatura de desde
hasta 60 ºC, preferentemente a aproximadamente 45 ºC.
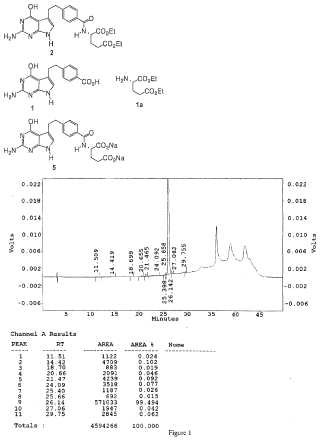
Preferentemente, el éster dietílico de pemetrexed 2 en forma cristalina se caracteriza por una pureza mayor de un 99, 0 % en peso. La pureza del éster dietílico de pemetrexed 2 se puede evaluar por procedimientosconocidos en la técnica. A modo de ejemplo, a continuación se da un procedimiento de HPLC usado durante el desarrollo del procedimiento de
acuerdo con la presente invención. También se informa de las condiciones experimentales para obtener el espectro PXRD, PT-1R y DSC/TGS.
Condiciones de funcionamiento Instrumento:
Longitud de onda: Columna:
Volumen de inyección: Temperatura de columna: Temperatura de muestra: Flujo: Fases móviles:
Tiempo de funcionamiento: Diluyente: Blanco: Funcionamiento:
Programa de gradiente:
• SHIMADZU HPLC: LC-10AD
• Detector UV: SPD 10AVP
• automuestreador: SIL-ADVP 254 nm
• columna: Halo CIS
• longitud: 150 mm
• Diámetro interior: 4, 6 mm
• tamaño de partícula: 2, 7 μm (HALO, n.º cat. 92814-702 o equivalente) 5 μl 30 ± 1ºC Temperatura ambiente 0, 4 ml/min Eluyente A: ácido trifluoroacético al 0, 3 % v/v en agua para HPLC Eluyente B: acetonitrilo 45 minutos (incluido reacondicionamiento) acetonitrilo-agua para HPLC =1:1 sólo se usa inyección de diluyente como blanco gradiente
PROGRAMA DE GRADIENTE
Tiempo (min) Eluyente A % (v/v) Eluyente B % (v/v)
00 85 15
2 85 15
15 60 40
30 60 40
35 85 15
36 85 15
45 (fin de func.) 15
DRXP (Difracción de rayos X de polvo)
Condiciones experimentales
Tipo de instrumento: X'Pert PRO PANalytical
Tipo de medida: Un barrido
5 Longitud de onda de medida: Cu Kαl
Material que constituye el ánodo: Cu
Voltaje del tubo de rayos X: 40
Corriente el tubo de rayos X (tnA) : 40
Tipo de movimiento... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para la preparación de éster dietílico de pemetrexed 2
que comprende la etapa de purificar la mezcla obtenible haciendo reaccionar los compuestos 1 y 1a en presencia de un agente químico que puede promover la formación de un enlace peptídico en un disolvente orgánico aprótico caracterizado por que se somete la mezcla a las siguientes etapas: a) lavado con una solución básica acuosa que tiene un pH de desde 7 hasta 10;
b) concentración de la fase orgánica; c) adición de un disolvente orgánico polar y/o una mezcla de disolventes orgánicos polares; d) precipitación del éster dietílico de pemetrexed 2 calentando la mezcla obtenida en la etapa c) hasta una temperatura de desde 50 hasta 80 ºC y a continuación enfriándola hasta una temperatura de desde 0 hasta 10 ºC. 15
2. Un procedimiento de acuerdo con la reivindicación 1, caracterizado por que la solución acuosa básica tiene un pH mayor de 7 y menor de o igual a 8.
3. Un procedimiento de acuerdo con la reivindicación 1, caracterizado por que el disolvente orgánico polar es un alcohol C1-C4, una cetona alifática o aromática, dimetilsulfóxido o mezclas de los mismos.
4. Un procedimiento de acuerdo con la reivindicación 3, caracterizado por que dicho alcohol C1-C4 es etanol.
5. Un procedimiento de acuerdo con la reivindicación 1, caracterizado por que la precipitación se efectúa calentando la mezcla obtenida en la etapa c) hasta una temperatura de desde 60 hasta 65 ºC, y a continuación enfriándola hasta una temperatura de aproximadamente 5 ºC.
6. Un procedimiento de acuerdo con la reivindicación 1, caracterizado por que la precipitación tiene lugar a una 25 temperatura de desde 30 hasta 60 ºC.
7. Un procedimiento de acuerdo con la reivindicación 6, caracterizado por que la precipitación tiene lugar a aproximadamente 45 ºC.
8. Un procedimiento para la preparación de la sal disódica 5
que comprende un procedimiento para la preparación de éster dietílico de pemetrexed 2 de acuerdo con una cualquiera de las reivindicaciones 1 a 7.
9. Un procedimiento para la preparación de la sal disódica 5 de acuerdo con la reivindicación 8, que comprende las 5 siguientes etapas:
e) disolver el éster dietílico de pemetrexed 2 en un disolvente orgánico polar prótico y/o una mezcla de disolventes orgánicos polares próticos y
f) hidrólisis posterior.
10. Un procedimiento de acuerdo con la reivindicación 9, caracterizado por que dicho disolvente orgánico polar 10 prótico es un alcohol C1-C4.
11. Un procedimiento de acuerdo con la reivindicación 10, caracterizado por que dicho alcohol C1-C4 es etanol.
12. Un procedimiento de acuerdo con la reivindicación 9, caracterizado por que la hidrólisis es una hidrólisis básica.
13. Un procedimiento de acuerdo con la reivindicación 12, caracterizado por que dicha hidrólisis básica se obtiene con una solución acuosa que tiene un pH de desde 10 hasta 13.
14. Un procedimiento de acuerdo con la reivindicación 13, caracterizado por que dicha solución acuosa tiene un pH de desde 12 hasta 13.
15. Un procedimiento de acuerdo con la reivindicación 9, caracterizado por que dicha hidrólisis se logra poniendo en contacto 0, 46 volúmenes de una solución de etanol 0, 145 M de éster dietílico de pemetrexed 2 con 0, 76 volúmenes de una solución acuosa 0, 6 M de hidróxido de sodio a una temperatura de 10 ± 2 ºC.
Resultados del canal A PICOTRÁREAÁREA %Nom.
1234567891011Totales: 11, 51 14, 42 18, 70 20, 66 21, 47 24, 09 25, 40 25, 66 26, 14 27, 06 29, 75 112247098832091423935181187692571033194728454594266 0, 024 0, 102 0, 019 0, 046 0, 092 0, 077 0, 026 0, 01599, 494 0, 042 0, 062100, 000
Figura 1
Resultados del canal A Minutos
PICOÁREAÁREA %Nom.
134920, 035252010, 0533982814499, 752486320, 088540790, 041630190, 031Totales: 9852567 100, 000
Figura 6
Patentes similares o relacionadas:
Compuestos de heteroaril carboxamida como inhibidores de RIPK2, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I): **(Ver fórmula)** o sus sales farmacéuticamente aceptables, en la que: X es N y Y es CH; o X es CH y Y es N; […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
1,5-Dihidro-4H-pirazolo[3,4-d]pirimidin-4-onas y 1,5-dihidro-4H-pirazolo[4,3-c]piridin-4-onas como inhibidores de la PDE1, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de fórmula (I) **(Ver fórmula)** en donde Y es N o CH; R1 se selecciona del grupo que consiste en alquilo C2-C8 lineal o ramificado, cicloalquilo […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]
Derivados de 5-[2-(piridin-2-ilamino)-1,3-tiazol-5-il]-2,3-dihidro-1H-isoindol-1-ona y su uso como inhibidores dobles de fosfatidilinositol··3-cinasa delta y gamma, del 15 de Julio de 2020, de ASTRAZENECA AB: Compuesto de formula (I) **(Ver fórmula)** donde X es C(O) o SO2; Y es SO2NHR5 o SO2R6; R1 se selecciona de alquilo C1-4, […]
Antagonistas del receptor de dopamina D3 que tienen una unidad estructural biciclo, del 15 de Julio de 2020, de Indivior UK Limited: Un compuesto, o una sal farmacéuticamente aceptable del mismo, que tiene la fórmula: **(Ver fórmula)** en donde; A y B juntos tienen la fórmula: **(Ver […]