Impureza de Lapatinib y sales del mismo.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E12163219.
Solicitante: F.I.S. FABBRICA ITALIANA SINTETICI S.P.A.
Nacionalidad solicitante: Italia.
Dirección: Viale Milano 26 36075 Alte di Montecchio Maggiore (VI) ITALIA.
Inventor/es: FONTANA,FRANCESCO, LEGANZA,ALESSANDRO, OSTI,SERGIO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/517 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinazolina, perimidina.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07D239/94 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 239/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,3 o diazina-1,3 hidrogenada. › Atomos de nitrógeno.
- C07D405/04 C07D […] › C07D 405/00 Compuestos heterocíclicos que contienen a la vez uno o más heterociclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo y uno o más heterociclos que tienen átomos de nitrógeno como único heteroátomo del ciclo. › unidos directamente por un enlace entre dos miembros cíclicos.
PDF original: ES-2444190_T3.pdf
Fragmento de la descripción:
Impureza de lapatinib y sales del mismo
Campo técnico de la invención [0001] Una impureza del ingrediente activo Lapatinib, métodos para identificarla, cuantificarla y para prevenir o limitar la presencia de la misma en Lapatinib y sales del mismo representan el objeto de la presente invención.
Lapatinib es un ingrediente activo farmacéutico usado para el tratamiento de cáncer de pulmón metastásico avanzado y está actualmente disponible en el mercado con el nombre Tykerb® comercializado por GlaxoSmithKline (GSK) .
De acuerdo con las indicaciones del fabricante, Tykerb® contiene Lapatinib en forma de una sal ditosilato 15 monohidrato de fórmula (XIII-bis) :
que tiene el nombre químico de bis (4-metilbencenosulfonato) monohidrato de N-{3-cloro-4-[ (3-fluorobencil) oxi]fenil}-6-[5- ({[2- (metilsulfonil) etil]amino}metil) furan-2-il]quinazolin-4-amina, NR CAS 388082-78-8 y un punto de fusión de 250-256 ºC.
Esta sustancia puede prepararse siguiendo las enseñanzas de la técnica anterior, tal como por ejemplo, las contenidas en el documento US 7.157.466. En particular, dicha referencia, los ejemplos 10 y 11 muestran la preparación de sal ditosilato monohidrato partiendo de sal ditosilato anhidra.
Como cualquiera de los compuestos obtenidos por medio de síntesis química, el Lapatinib, o las sales del mismo, pueden contener pequeñas cantidades de compuestos extraños denominados impurezas. Estas impurezas pueden ser los materiales de partida, los intermedios sintéticos, subproductos de reacción, productos de la degradación del producto, etc. Las impurezas de Lapatinib, tal como las de cualquier otro ingrediente farmacéuticamente activo o fármaco relacionado, denominadas "impurezas farmacéuticas", pueden afectar tanto a la eficacia como a la seguridad de un fármaco que, en casos extremos, podría ser incluso perjudicial para el paciente. La pureza de un ingrediente activo como el Lapatinib producido a través de unos procesos de producción basados en reacciones químicas posteriores representa un factor crítico con respecto a la comercialización. La US Food and Drug Administration (FDA) y la Agencia Europea del Medicamento (EMA) , así como la farmacopea relacionada requieren que las impurezas se mantengan por debajo de valores límite dados.
El producto de una reacción química raramente es un solo compuesto que tenga la pureza suficiente para reunir los estándares regulatorios. En el producto aislado también pueden estar presentes subproductos debidos a reacciones secundarias de los reactivos usados en la reacción. En algunas etapas de los procesos de producción de un ingrediente activo, tales como Lapatinib, la pureza se analiza, generalmente, por medio de cromatografía líquida de alto rendimiento (HPLC) , cromatografía de gases (GC) o cromatografía de capa fina (TLC) , para definir si es adecuada para el tratamiento posterior, y por último, para su uso en el producto farmacéutico.
Generalmente, las impurezas se identifican espectroscópicamente, por lo tanto, se asocia a las mismas una posición de pico cromatográfica, tal como la de un cromatograma o un punto en un panel de TLC.
Una vez que se ha asociado una posición de pico a una impureza en particular, la impureza que puede identificarse es una muestra para la posición relativa de la misma en el cromatograma, donde la posición en el cromatograma se mide en minutos entre la inyección de la muestra en una columna y la elusión de la impureza a través del detector. La posición en el cromatograma se conoce como el tiempo de retención y la relación entre los tiempos de 50 retención se conoce como tiempo de retención relativo. Un experto en las técnicas farmacéuticas conoce que un compuesto relativamente puro puede usarse como estándar de referencia. Un estándar de referencia es similar a un marcador de referencia, excepto por el hecho de que el último puede usarse, no sólo para detectar las impurezas, sino también para cuantificar la cantidad de impurezas presentes en la muestra de un ingrediente activo.
Como es conocido para los expertos en la materia, la supervisión de las impurezas del proceso se mejora considerablemente comprendiendo las estructuras químicas de las mismas, los procedimientos sintéticos y la identificación de los parámetros que afectan a la cantidad de impurezas en el producto final, por ejemplo, por medio de DOE. Las impurezas de Lapatinib, incluyendo los intermedios que no han reaccionado por completo, las impurezas del material de partidas, los subproductos de reacción, los productos de degradación, así como otros subproductos, puede afectar a la calidad y eficacia de la forma farmacéutica que contiene Lapatinib. Por lo tanto, surge la necesidad de un método para definir el nivel de impurezas en las muestras de Lapatinib y de métodos para retirar las impurezas o limitar el contenido de las mismas o prevenir la formación de las mismas.
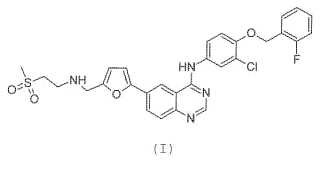
Resumen de la invención [0010] La presente invención se refiere a un compuesto de N-{3-cloro-4-[ (2-fluorobencil) oxi]fenil}-6-[5- ({[2 (metilsulfonil) etil]amino}metil) furan-2-il]quinazolin-4-amina de fórmula (I) o una sal del mismo:
a los métodos analíticos para detectar y cuantificar esta impureza en Lapatinib y sales del mismo, el método de preparación y uso del mismo. La presente invención también se refiere al método de síntesis de Lapatinib que 20 comprende menos de un 0, 05 por ciento de área o % en peso peso del compuesto de fórmula (I) y también se describe el propio Lapatinib con dicho contenido de esta impureza.
Breve descripción de las figuras (o representaciones) :
A modo de ejemplo:
La Figura 1 muestra el espectro de RMN 1H de monohidrato de Lapatinib; ditosilato obtenido de acuerdo con el método de la siguiente invención; La Figura 2 muestra el espectro de RMN 1H del compuesto de N-{3-cloro-4-[ (2-fluorobencil) oxi]fenil}-6-[5- ({[2
(metilsulfonil) etil]amino}etil) furan-2-il]quinazolin-4-amina de fórmula (I) en forma de una sal ditosilato; La Figura 3 muestra el espectro de RMN 1H del compuesto de N-{3-cloro-4-[ (2-fluorobencil) oxi]fenil}-6-[5- ({[2 (metilsulfonil) etil]amino}metil) furan-2-il]quinazolin-4-amina de fórmula (I) en forma de una base libre; La Figura 4 muestra el espectro de RMN 1H de 5-[4- ({3-cloro-4-[ (2-fluorobencil) oxi]fenil}amino) quinazolin-6-il] furan-2-carbaldehído de fórmula (II) ;
La Figura 5 muestra el espectro de RMN 1H de clorhidrato de N-{3-cloro-4-[ (2-fluorobencil) oxi]fenil}6-yodoquinazolin-4-amina de fórmula (III) ; La Figura 6 muestra el espectro de RMN 1H de 3-cloro-4-[ (2-fluorobencil) oxi]anilina de fórmula (IV) ; La Figura 7 muestra el cromatograma de HPLC de 3-cloro-4-[ (3-fluorobencil) oxi]anilina de fórmula (X) que contiene un área (HPLC) de un 0, 066 por ciento de impureza de 3-cloro-4-[ (2-fluorobencil) oxi]anilina de fórmula (IV) usada para la preparación del ditosilato monohidrato de Lapatinib de la Figura 8; La Figura 8 muestra el ditosilato de monohidrato de Lapatinib de fórmula (XIII -bis) que contiene un área (HPLC) de un 0, 024 por ciento de impureza de fórmula (I -bis) obtenida de acuerdo con el método de la invención.
Descripción detallada de la invención 45 [0012] La presente invención se refiere a un compuesto de N-{3-cloro-4-[ (2-fluorobencil) oxi]fenil}-6-[5- ({[2 (metilsulfonil) etil]amino}metil) furan-2-il] quinazolin-4-amina de fórmula (I) o una sal del mismo:
preferiblemente, en forma de una sal ditosilato o como una sal ditosilato monohidrato de fórmula (I-bis) :
posiblemente que comprende también un área (HPLC) de un 0, 01 a un 5, 0 por ciento de Lapatinib o una sal del mismo 5 o compuesto de fórmula (I) o una sal del mismo que tiene al menos una pureza por HPLC de 95, 0 (porcentaje de área) .
Se descubrió experimentalmente que el compuesto de fórmula (I) es tanto una impureza de Lapatinib como un precursor de una impureza genotóxica de Lapatinib.
De hecho, se observó sorprendentemente el siguiente mecanismo de degradación/hidrólisis:
que conduce a la formación de cantidades pequeñas, pero considerables de 3-cloro-4-[ (2-fluorobencil) oxi]anilina de fórmula (IV) :
una sustancia que, como el precursor anilina, es genotóxico. Como confirmación de la mutagenicidad, el análogo con el flúor en posición meta en lugar de posición orto se clasifica como Mutágeno de categoría 3, con frase de riesgo R68, en la base de datos ESIS de la Comisión Europea.
Por lo tanto, es esencial reducir tanto como sea posible la cantidad de compuesto de fórmula (I) , impureza de Lapatinib y precursor de impureza genotóxica de Lapatinib, en Lapatinib o sales del mismo. Para dicho propósito, el Lapatinib o las... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto de N-{3-cloro-4-[ (2-fluorobencil) oxi]fenil}-6-[5- ({[2- (metilsulfonil) etil]amino}metil) furan-2-il]quinazolin4-amina de fórmula (I) o una sal del mismo:
2. El compuesto de acuerdo con la reivindicación 1 como una sal ditosilato o como una sal ditosilato monohidrato de fórmula (I -bis) :
3. El compuesto de acuerdo con la reivindicación 1 ó 2 que comprende un área (HPLC) de un 0, 01 a un 5, 0 por ciento 10 de Lapatinib o una sal del mismo.
4. El compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 3 que tiene al menos una pureza por HPLC de 95, 0 (porcentaje de área) .
5. Un método para preparar el compuesto de fórmula (I) de acuerdo con cualquiera de las reivindicaciones 1 a 4 que comprende las siguientes etapas:
A) hacer reaccionar 3-cloro-9-[ (2-fluorobencil) oxi]anilina de fórmula (IV) :
con 4-cloro-6-yodoquinazolina de fórmula (VIII) : para producir clorhidrato de N-{3-cloro-4-[ (2-fluorobencil) oxi]fenil}-6-yodoquinazolin-4-amina de fórmula (III) :
B) hacer reaccionar el compuesto de fórmula (III) con el ácido 2-formilfuran-5-borónico de fórmula (IX) :
para producir 5-[4- ({3-cloro-4-[ (2-fluorobencil) oxi]fenil}amino) quinazolin-6-il]furan-2-carbaldehído de fórmula (II) :
C) hacer reaccionar el compuesto de fórmula (II) con clorhidrato de 2- (metilsulfonil) etanamina para producir el compuesto de fórmula (I) ; D) opcionalmente, conversión del compuesto de fórmula (I) en una sal ditosilato o una sal ditosilato monohidrato.
6. Método de acuerdo con la reivindicación 5 donde en la etapa (b) la filtración de las sales inorgánicas presentes en la mezcla de reacción se realiza a una temperatura comprendida entre 50 ºC y 60 ºC.
o en forma de base libre; compuesto 5-[4- ({3-cloro-4-
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]