Composición farmacéutica que contiene lurasidona.
Una preparación oral que contiene clorhidrato de N-[4-[4-(1,2-benzisotiazol-3-il)-1-piperazinil]-(2R,
3R)-2,3-tetrametilenbutil]-(1'R,2'S,3'R,4'S)-2,3-biciclo[2,2,1]heptanodicarboxiimida (lurasidona) de fórmula (1):
un almidón pregelatinizado, un excipiente hidrosoluble y un ligante polimérico hidrosoluble, donde el contenido enlurasidona en la preparación es del 20 al 45% (p/p) y el almidón pregelatinizado es incorporado en una cantidad del10 al 50% (p/p) en base al peso de la preparación.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2006/310571.
Solicitante: DAINIPPON SUMITOMO PHARMA CO., LTD..
Nacionalidad solicitante: Japón.
Dirección: 6-8, DOSHO-MACHI 2-CHOME CHUO-KU OSAKA-SHI OSAKA 541-8524 JAPON.
Inventor/es: FUJIHARA,K.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/496 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piperazinas no condensadas conteniendo otros heterociclos, p. ej. rifampicina, tiotixeno.
- A61K47/10 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K47/26 A61K 47/00 […] › Hidratos de carbono, p. ej. alcoholes de azúcares, amino azúcares, ácidos nucleicos, mono-, di- u oligo-sacáridos; Sus derivados, p. ej. polisorbatos, ésteres de ácidos grasos sorbitano o glicirricina.
- A61K47/38 A61K 47/00 […] › Celulosa; Sus derivados.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
- C07D417/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 417/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y azufre como únicos heteroátomos del ciclo, no previstos por el C07D 415/00. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
PDF original: ES-2408687_T3.pdf
Fragmento de la descripción:
Composición farmacéutica que contiene lurasidona
Campo técnico La presente invención se relaciona con una preparación oral con una buena desintegración que contiene, como principio activo, clorhidrato de N-[4-[4- (1, 2-benzisotiazol-3-il) -1-piperazinil]- (2R, 3R) -2, 3-tetrametilenbutil] (1’R, 2’S, 3’R, 4’S) -2, 3-biciclo[2, 2, 1]heptanodicarboxiimida (lurasidona) . Más particularmente, la presente invención se relaciona con una preparación para administración oral, en particular una tableta, que contiene lurasidona como principio activo, que tiene un perfil de disolución equivalente del principio activo incluso si se varían en ella los contenidos del principio activo.
Técnica anterior
El Documento de Patente 1 desvela que se puede administrar oralmente un compuesto tal como la lurasidona y se puede preparar una preparación oral mezclando un principio activo con un soporte, excipiente, ligante, estabilizante y similares convencional, pero no se describe ninguna preparación oral que muestre una rápida disolución y que tenga un perfil de disolución equivalente del principio activo incluso aunque se varíen los contenidos del principio activo en la misma en un amplio margen, en particular una preparación oral con mayores contenidos en el principio activo que tiene un perfil de disolución similar al de múltiples tabletas con un menor contenido en el principio activo por tableta.
Con el fin de asegurar la bioequivalencia cuando se administraban preparaciones farmacéuticas con diferentes contenidos en el principio activo de forma que representaran la misma dosis entre sí, se publicó una directriz, es decir, "Guideline for Bioequivalence Studies of Oral Solid Dosage Forms with Different Content" (Notificación Nº 64 de la Evaluation and Licensing Division, Pharmaceutical and Food Safety Bureau, promulgada el 14 de Febrero de 2000) , mediante la cual se requería que las preparaciones farmacéuticas con diferentes contenidos deberían tener un perfil de disolución equivalente en cada solución de ensayo, tal como tampones de pH 1, 2, 3, 0 a 5, 0 y 6, 8 (lo que corresponde a los valores de pH del estómago, del intestino y de la cavidad oral, respectivamente) , agua y solución salina.
El Documento de Patente 2 desvela una preparación oral que contiene lurasidona como principio activo, la cual muestra una rápida disolución y tiene un perfil de disolución equivalente incluso aunque se varíen sus contenidos en el principio activo, en particular una preparación oral con mayores contenidos en el principio activo que tiene un perfil de disolución equivalente al de múltiples tabletas con un menor contenido en el principio activo por tableta y que puede liberar de sí misma un principio activo ligeramente hidrosoluble a una concentración deseada.
El Documento de Patente 2 describe además una preparación oral, en particular una tableta, que muestra una rápida disolución del principio activo incluso aunque se varíen sus contenidos en el principio activo en el rango de varios mg a varias decenas de mg (v.g., en el rango de 5 mga 20 mg o en el rango de 5 mg a 40 mg) , y que además tiene un perfil de disolución equivalente en la misma razón de componentes. Con frecuencia se ha requerido de una preparación oral que sea una preparación con mayores contenidos en el principio activo con objeto de alcanzar efectos clínicos superiores, o una preparación que tenga un perfil de disolución equivalente al de múltiples tabletas y
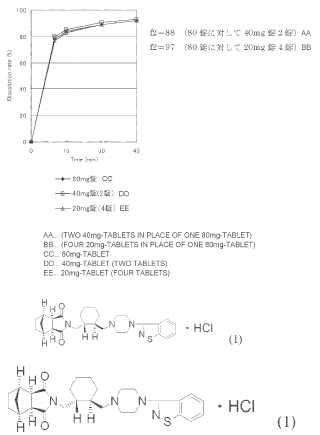
que pueda liberar el principio activo de sí misma a una concentración deseada en rangos más amplios de contenidos, con objeto de ajustar los efectos clínicos dependiendo de las condiciones de los pacientes. La técnica descrita en el Documento de Patente 2 puede aportar una preparación oral que tiene un perfil de disolución equivalente en el rango de 5 mg a 40 mg de lurasidona por tableta, como se muestra en la Figura 1. Sin embargo, como se muestra en la Figura 2, cuando se aumentó el contenido en el principio activo por tableta al doble, es decir,
80 mg por tableta, no pudo tener un perfil de disolución equivalente. Por ello, se sigue estando en un estado en el que se necesita administrar múltiples tabletas de una sola vez o utilizar una tableta de gran tamaño difícil de administrar. Por lo tanto, para un principio activo ligeramente hidrosoluble tal como la lurasidona, ha sido difícil disponer de una preparación oral con un perfil de disolución equivalente incluso en un alto contenido o en rangos más amplios de contenidos del principio activo.
En el Documento de Patente 2, un ligando polimérico hidrosoluble incluye almidón, pero no se da ninguna descripción en él acerca de un almidón pregelatinizado. Se sabe que el almidón pregelatinizado mejora notablemente la desintegración y la disolución de una composición farmacéutica, como se describe, por ejemplo, en el Documento de Patente 3, pero se utiliza con frecuencia típicamente en un contenido del 10% o menos, como 60 también se describe en el Documento No de Patente 1.
Se discute la importancia del grado de gelatinización de un ligante de pasta de almidón en la dureza y el tiempo de desintegración de las tabletas en el Documento No de Patente 2.
El Documento de Patente 4 describe una preparación oral que consiste en una mezcla de un gránulo y un segundo desintegrante, siendo obtenido dicho gránulo por granulación con pulverización de una suspensión acuosa que contiene un principio activo ligeramente hidrosoluble y un ligante polimérico hidrosoluble a una mezcla de un excipiente hidrosoluble y un primer desintegrante.
El Documento de Patente 5 se dirige a una composición que se dice es útil como agente terapéutico para la diabetes por inclusión de una sal de calcio de un derivado del ácido bencilsuccínico como principio activo. Se obtiene esta composición incluyendo (A) una sal de calcio de un derivado del ácido bencilsuccínico representado por la fórmula indicada o su hidrato como principio activo, y preferiblemente también (B) dióxido de silicio o (C) un almidón parcialmente pregelatinizado. El ingrediente B está preferiblemente contenido en una cantidad del 0, 5 al 5% en peso y el ingrediente C está preferiblemente contenido en una cantidad del 5 al 20% en peso como preparación total en la composición.
Documento de Patente 1: JP2800953
Documento de Patente 2: WO2002/024166 Documento de Patente 3: JP2000-26292 Documento de Patente 4: EP-A-1.327.440 Documento de Patente 5: JP200002629 Documento No de Patente 1: Handbook of Pharmaceutical Excipients, 2ª edición, 491, 1994, The Pharmaceutical
Press Documento No de Patente 2: T. Makino et al., Chem. Pharm. Bull. 43 (3) 514-516 (1995)
Descripción de la invención
Problemas que han de ser resueltos por la invención El fin de la presente invención es proporcionar una preparación oral que contiene lurasidona como principio activo que muestra una rápida disolución y que tiene un perfil de disolución equivalente incluso aunque sus contenidos en el principio activo varíen en un amplio margen, en particular una preparación oral con mayores contenidos en el
principio activo que tiene un perfil de disolución similar al de múltiples tabletas con un menor contenido en el principio activo por tableta y que puede liberar el principio activo de sí misma a una concentración deseada.
El fin de la presente invención es proporcionar una preparación para administración oral que contiene como principio activo clorhidrato de N-[4-[4- (1, 2-benzisotiazol-3-il) -1-piperazinil]- (2R, 3R) -2, 3-tetrametilenbutil]- (1’R, 2’S, 3’R, 4’S) -2, 335 biciclo[2, 2, 1]heptanodicarboxiimida (al que a partir de aquí se hará referencia como lurasidona) , que tiene un perfil de disolución equivalente del principio activo incluso aunque varíen sus contenidos en el principio activo.
Medios de resolución de los problemas Los presentes inventores han realizado estudios intensivos con objeto de resolver los problemas anteriores y han visto que dichos problemas pueden ser resueltos por medio de los métodos siguientes.
La presente invención incluye las siguientes realizaciones:
1. Una preparación oral que consiste en clorhidrato de N-[4-[4- (1, 2-benzisotiazol-3-il) -1-piperazinil]- (2R, 3R) -2, 3tetrametilenbutil]- (1’R, 2’S, 3’R, 4’S) -2, 3-biciclo[2, 2, 1]heptanodicarboxiimida (lurasidona) de fórmula (1) :
un almidón pregelatinizado, un excipiente hidrosoluble y un ligante polimérico hidrosoluble, donde el contenido en lurasidona en la preparación es del 20 al 45% (p/p) y se incorpora el almidón pregelatinizado en una cantidad del 10 al 50% (p/p) en base al... [Seguir leyendo]
Reivindicaciones:
1. Una preparación oral que contiene clorhidrato de N-[4-[4- (1, 2-benzisotiazol-3-il) -1-piperazinil]- (2R, 3R) -2, 3tetrametilenbutil]- (1’R, 2’S, 3’R, 4’S) -2, 3-biciclo[2, 2, 1]heptanodicarboxiimida (lurasidona) de fórmula (1) :
un almidón pregelatinizado, un excipiente hidrosoluble y un ligante polimérico hidrosoluble, donde el contenido en lurasidona en la preparación es del 20 al 45% (p/p) y el almidón pregelatinizado es incorporado en una cantidad del 10 10 al 50% (p/p) en base al peso de la preparación.
2. La preparación oral de la reivindicación 1, que puede ser obtenida mediante un procedimiento consistente en granular una mezcla de polvo que incluye lurasidona, un almidón pregelatinizado y un excipiente hidrosoluble utilizando una solución de un ligante polimérico hidrosoluble, donde el contenido en lurasidona en la preparación es del 20 al 45% (p/p) y el almidón pregelatinizado es incorporado en una cantidad del 10 al 50% (p/p) en base al peso de la preparación.
3. La preparación oral de la reivindicación 1, que puede ser obtenida mediante un procedimiento consistente en granular una mezcla de polvo que incluye un almidón pregelatinizado y un excipiente hidrosoluble utilizando una solución o dispersión de lurasidona y un ligante polimérico hidrosoluble, donde el contenido en lurasidona en la preparación es del 20 al 45% (p/p) y el almidón pregelatinizado es incorporado en una cantidad del 10 al 50% (p/p) en base al peso de la preparación.
4. La preparación oral de cualquiera de las reivindicaciones 1 a 3, donde el almidón pregelatinizado es incorporado 25 en una cantidad del 20 al 50% (p/p) en base al peso de la preparación.
5. La preparación oral de la reivindicación 4, donde el almidón pregelatinizado es incorporado en una cantidad del 20 al 40% (p/p) en base al peso de la preparación.
6. La preparación oral de la reivindicación 5, donde el almidón pregelatinizado es incorporado en una cantidad del 20 al 30% (p/p) en base al peso de la preparación.
7. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el excipiente hidrosoluble es manitol o lactosa. 35
8. La preparación oral de cualquiera de las reivindicaciones 1 a 7, donde el 50% en volumen del tamaño de partícula de la lurasidona es de 0, 1 a 8 !m.
9. La preparación oral de cualquiera de las reivindicaciones 1 a 8, donde el 90% en volumen del tamaño de partícula 40 de la lurasidona es de 27 !m o menos.
10. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el contenido en lurasidona en la preparación es del 25 al 40% (p/p) .
11. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el contenido en lurasidona por tableta es de10 a160 mg.
12. La preparación oral de la reivindicación 11, donde el contenido en lurasidona por tableta es de 20 a 120 mg.
13. La preparación oral de la reivindicación 12, donde el contenido en lurasidona por tableta es de 40 a 120 mg.
14. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el excipiente hidrosoluble es manitol o lactosa, el almidón pregelatinizado es incorporado en una cantidad del 20 al 30% (p/p) en base al peso de la preparación y el contenido en lurasidona en la preparación es del 25 al 40% (p/p) .
15. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el excipiente hidrosoluble es manitol o lactosa, el almidón pregelatinizado es incorporado en una cantidad del 20 al 30% (p/p) en base al peso de la preparación y el contenido en lurasidona por tableta es de 40 a 120 mg.
16. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el índice de pregelatinización del almidón pregelatinizado es del 50 al 95%.
17. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el almidón pregelatinizado contiene materia hidrosoluble en un 30% o menos.
18. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el excipiente hidrosoluble es manitol o lactosa, el almidón pregelatinizado es incorporado en una cantidad del 20 al 30% (p/p) en base al peso de la preparación, el contenido en lurasidona en la preparación es del 25 al 40% (p/p) y el contenido en lurasidona por tableta es de 20 a 120 mg.
19. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el contenido en el excipiente hidrosoluble por tableta es del 30 al 80% (p/p) .
20. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el ligante polimérico hidrosoluble es hidroxipropilmetilcelulosa, alcohol polivinílico, polivinilpirrolidona o hidroxipropilcelulosa.
21. La preparación oral de cualquiera de las reivindicaciones 1 a 6, donde el contenido en el ligante polimérico hidrosoluble por tableta es del 0, 5 al 10% (p/p) .
22. La preparación oral de cualquiera de las reivindicaciones 1 a 6, que además incluye un desintegrante, donde el contenido en el desintegrante por tableta es del 0, 5 al 5% (p/p) .
23. La preparación oral de cualquiera de las reivindicaciones 19 a 22, donde el almidón pregelatinizado es incorporado en una cantidad del 20 al 30% (p/p) en base al peso de la preparación y el contenido en lurasidona por tableta es de 40 a 120 mg.
24. La preparación oral de cualquiera de las reivindicaciones 1 a 6, que además incluye un desintegrante, donde el contenido en el desintegrante por tableta es del 0, 5 al 5% (p/p) , el almidón pregelatinizado es incorporado en una cantidad del 20 al 30% (p/p) en base al peso de la preparación, el contenido en lurasidona por tableta es de 40 a 120 mg, el contenido en el excipiente hidrosoluble por tableta es del 30 al 80% (p/p) , el ligante polimérico hidrosoluble es hidroxipropilmetilcelulosa, alcohol polivinílico, polivinilpirrolidona o hidroxipropilcelulosa y el contenido en el ligante polimérico hidrosoluble por tableta es del 0, 5 al 10% (p/p) .
25. La preparación oral de cualquiera de las reivindicaciones 19 a 22, donde el almidón pregelatinizado es incorporado en una cantidad del 20 al 30% (p/p) en base al peso de la preparación, el contenido en lurasidona por tableta es de 40 a 120 mg, el índice de pregelatinización del almidón pregelatinizado es del 50 al 95%, un 50% en volumen del tamaño de partícula de la lurasidona es de 0, 1 a 8 !m y el almidón pregelatinizado contiene materia hidrosoluble en un 30% o menos.
26. La preparación oral de cualquiera de las reivindicaciones 1 a 6, que además incluye un desintegrante, donde el contenido en el desintegrante por tableta es del 0, 5 al 5% (p/p) , el almidón pregelatinizado es incorporado en una cantidad del 20 al 30% (p/p) en base al peso de la preparación, el contenido en lurasidona por tableta es de 40 a 120 mg, el índice de pregelatinización del almidón pregelatinizado es del 50 al 95%, un 50% en volumen del tamaño de partícula de la lurasidona es de 0, 1 a 8 !m, el almidón pregelatinizado contiene materia hidrosoluble en un 30% o menos, el contenido en el excipiente hidrosoluble por tableta es del 30 al 80% (p/p) , el ligante polimérico hidrosoluble es hidroxipropilmetilcelulosa, alcohol polivinílico, polivinilpirrolidona o hidroxipropilcelulosa y el contenido en el ligante polimérico hidrosoluble por tableta es del 0, 5 al 10% (p/p) .
27. Un método para preparar la preparación oral de la reivindicación 2, donde el método consiste en la granulación de una mezcla de polvo que comprende lurasidona, un almidón pregelatinizado y un excipiente hidrosoluble, mediante la utilización de una solución de un ligante polimérico hidrosoluble, donde el contenido en lurasidona en la preparación es del 20 al 45% (p/p) y el almidón pregelatinizado es incorporado en una cantidad del 10 al 50% (p/p) en base al peso de la preparación.
28. Un método para preparar la preparación oral de la reivindicación 3, donde el método consiste en la granulación de una mezcla de polvo que comprende un almidón pregelatinizado y un excipiente hidrosoluble, mediante la
utilización de una solución o dispersión de lurasidona y un ligante polimérico hidrosoluble, donde el contenido en lurasidona en la preparación es del 20 al 45% (p/p) y el almidón pregelatinizado es incorporado en una cantidad del 10 al 50% (p/p) en base al peso de la preparación.
29. El método de la reivindicación 27, donde el excipiente hidrosoluble es manitol o lactosa.
30. Uso de lurasidona para la preparación de una preparación oral como se define en cualquiera de las reivindicaciones 1 a 26 para tratar la esquizofrenia.
31. La preparación oral de cualquiera de las reivindicaciones 1 a 26 para uso en el tratamiento de la esquizofrenia.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Formulación de vitamina D de liberación modificada estabilizada y método de administración de la misma, del 22 de Julio de 2020, de EirGen Pharma Ltd: Una formulacion oral de liberacion controlada de un compuesto de vitamina D que comprende uno o ambos de 25- hidroxivitamina D2 y 25-hidroxivitamina D3, la formulacion […]
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]
Composiciones y métodos para tratar el virus de la hepatitis C, del 15 de Julio de 2020, de Gilead Pharmasset LLC: Una composición farmacéutica que comprende: a) de aproximadamente el 25% a aproximadamente el 35% p/p de GS-7977 cristalino que tiene la estructura **(Ver […]
Macrogols para aplicación a la mucosa, y sus usos terapéuticos, del 15 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Composición farmacéutica en forma sólida que comprende, por unidad de dosificación, entre 5 y 400 mg de un PEG con un grado de 3000 o más, para uso en el tratamiento […]
Composición farmacéutica que comprende un agente antipsicótico atípico y método para su preparación, del 15 de Julio de 2020, de PHARMATHEN S.A.: Comprimido de liberación controlada de Paliperidona en forma de comprimido de varias capas que comprende: a) un núcleo de matriz que comprende […]
Preparación para el control del peso corporal a base de quitosano y celulosa, del 1 de Julio de 2020, de S.I.I.T. S.R.L.-SERVIZIO INTERNAZIONALE IMBALLAGGI TERMOSALDANTI: Una composición oral sólida que contiene una combinación de quitosano de hongos o levaduras, celulosa amorfa en polvo y opcionalmente excipientes.
Granulados secos de polvos de sílice mesoporosa, del 1 de Julio de 2020, de FORMAC PHARMACEUTICALS N.V: Un granulado seco que comprende desde el 50% al 100% p/p de sílice mesoporosa ordenada que tiene una organización bidimensional hexagonalmente […]