Derivados de morfolino pirimidina usados en enfermedades relacionadas con mTOR quinasa y/o PI3K.
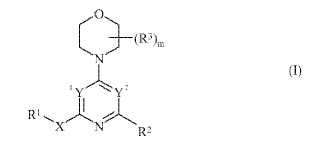
Un compuesto de fórmula (I) **Fórmula**
fórmula (I)
o una sal farmacéuticamente aceptable de los mismos;
en donde
m es 0, 1, 2, 3 o 4;
1Y e Y2 son independientemente N o CR8 siempre que uno de 1Y e Y2 sea N y el otro sea CR8;X es un grupo enlazante que se selecciona de -CR4 ≥ CR5-, -CR4 ≥ CR5CR6R7-, -CR6R7CR5 ≥ CR4-, -C≡C-, -C≡CCR6R7-
, -CR6R7C≡C-, -NR4CR6R7-, -OCR6R7-, -SCR6R7-, -S(O)CR6R7-, -S(O)2CR6R7-, -C(O)NR4CR6R7-, -NR4C(O)CR6R7-, -NR4C(O)NR5CR6R7-, -NR4S(O)2CR6R7-, -S(O)2NR4CR6R7-, -C(O)NR4-, -NR4C(O)-, -NR4C(O)NR5-, -S(O)2NR4- y -NR4S(O)2-;
R1 es un grupo que se selecciona de hidrógeno, alquiloC1-6, alqueniloC2-6, alquiniloC2-6, carbociclilo, carbociclilalquiloC1-
6, heterociclilo y heterociclilalquiloC1-6, y dicho grupo está opcionalmente sustituido por uno o más grupos sustituyentes
que se seleccionan de halo, ciano, nitro, R9, -OR9, -SR9, -SOR9, -SO2R9, -COR9, -CO2R9, -CONR9R10, -NR9R10, -NR9COR10, -NR9CO2R10, -NR9CONR10R15, -NR9COCONR10R15 y -NR9SO2R10;
R2 es
en donde A1 y A2 se seleccionan entre CH o N siempre que al menos uno de A1 o A2 sea CH;
cada R3, cuando está presente, se selecciona independientemente de halo, ciano, nitro, -R13, -OR13, -SR13, -SOR13, -SO2R13, -COR13, -CO2R13, -CONR13R14, -NR13R14, -NR13COR14, -NR13CO2R14 y -NR13SO2R14;
R4 y R5 son independientemente hidrógeno o alquiloC1-6;
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2008/050548.
Solicitante: ASTRAZENECA AB.
Nacionalidad solicitante: Suecia.
Dirección: 151 85 SÖDERTÄLJE SUECIA.
Inventor/es: PIKE,KURT,GORDON.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/505 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Pirimidinas; Pirimidinas hidrogenadas, p. ej. trimetoprima.
- A61P11/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del aparato respiratorio.
- A61P29/00 A61P […] › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- A61P35/00 A61P […] › Agentes antineoplásicos.
- A61P9/00 A61P […] › Medicamentos para el tratamiento de trastornos en el aparato cardiovascular.
- C07D239/42 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 239/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,3 o diazina-1,3 hidrogenada. › Un átomo de nitrógeno (radicales nitro C07D 239/30).
PDF original: ES-2385692_T3.pdf
Fragmento de la descripción:
Derivados de morfolino pirimidina usados en enfermedades relacionadas con mTOR quinasa y/o PI3K
La presente invención se refiere a compuestos de morfolino pirimidina, procesos para su preparación, composiciones farmacéuticas que los contienen y su uso en terapia, por ejemplo, en el tratamiento de una enfermedad proliferativa tal como cáncer, y particularmente en una enfermedad mediada por una mTOR quinasa y/o una o más enzimas PI3K.
Se sabe ahora que la desregulación de oncogenes y genes supresores de tumores contribuye con la formación de tumores malignos, por ejemplo mediante el aumento de la proliferación celular o el aumento de la supervivencia celular. También se sabe que las vías de señalización mediadas por las familias PI3K/mTOR juegan un papel fundamental en distintos procesos celulares, incluidas la proliferación y supervivencia, y la desregulación de estas vías constituye un factor causante en una amplia gama de cánceres humanos y otras enfermedades.
El objetivo mamífero del antibiótico macrólido rapamicina (sirolimus) es la enzima mTOR. Esta enzima pertenece a la familia de proteína quinasas relacionada con la fosfatidilinositol (PI) quinasa, (PIKK) , que también incluye ATM, ATR, DNA-PK y hSMG-1. La mTOR, al igual que otros integrantes de la familia PIKK, no posee actividad lípido quinasa detectable, pero en cambio presenta funciones de serina/treonina quinasa. Gran parte del conocimiento que se tiene sobre la señalización de la mTOR se basa en el uso de rapamicina. La rapamicina se une en primer lugar a la proteína de unión a la inmunofilina FK506 de 12 kDa (FKBP12) y este complejo inhibe la señalización de la mTOR (Tee and Blenis, Seminars in Cell and Developmental Biology, 2005, 16, 29-37) . La proteína mTOR consiste en un dominio quinasa catalítico, un dominio de unión a FKBP12-rapamicina (FRB) , un dominio represor putativo cerca del extremo C y hasta 20 motivos HEAT repetidos en tándem en el extremo N, así como también un dominio FRAP-ATM-TRRAP (FAT) y FAT en el extremo C (Huang and Houghton, Current Opinion in Pharmacology, 2003, 3, 371-377) .
La mTOR quinasa es un regulador clave del crecimiento celular y se ha demostrado que regula una amplia gama de funciones celulares, como la traducción, trascripción, recambio de ARNm, estabilidad proteica, reorganización citoesquelética y autofagia (Jacinto and Hall; Nature Reviews Molecular and Cell Biology, 2005, 4, 117-126) . La mTOR quinasa integra señales de factores del crecimiento (como el factor de crecimiento de la insulina o similar a la insulina) y nutrientes (tales como aminoácidos y glucosa) para regular el crecimiento celular. La mTOR quinasa es activada por factores del crecimiento a través de la vía PI3K-Akt. La función mayormente descrita de la mTOR quinasa en células de mamíferos es la regulación de la traducción a través de dos vías, a saber, la activación de S6K1 ribosómica para mejorar la traducción de los ARNm que presentan un tracto de oligopirimidina en la región 5' terminal (TOP) y la supresión de 4E-BP1 para permitir la traducción de ARNm dependiente de CAP.
Generalmente, los investigadores han explorado las funciones fisiológicas y patológicas de la mTOR mediante la inhibición con rapamicina y análogos de rapamicina relacionados en base a su especificidad para la mTOR como objetivo intracelular. Sin embargo, datos recientes sugieren que la rapamicina exhibe acciones inhibitorias variables sobre las funciones de señalización de la mTOR, lo que sugiere que la inhibición directa del dominio de la mTOR quinasa puede exhibir actividades anti-cáncer sustantivamente mayores que las alcanzadas con la rapamicina (Edinger et al., Cancer Research, 2003, 63, 8451-8460) . Por este motivo, los inhibidores potentes y selectivos de la actividad de la mTOR quinasa serían de utilidad para poder comprender más cabalmente la función de la mTOR quinasa y así obtener agentes terapéuticos útiles.
Existe ahora considerable evidencia que indica que las vías corriente arriba de mTOR, tal como la vía de la PI3K, a menudo se activan en el cáncer (Vivanco and Sawyers, Nature Reviews Cancer, 2002, 2, 489-501; Bjomsti y Houghton, Nature Reviews Cancer, 2004, 4, 335-348; Inoki et al., Nature Genetics, 2005, 37, 19-24) . Por ejemplo, los componentes de la vía de la PI3K que mutan en distintos tumores humanos incluyen mutaciones activantes de receptores de factores de crecimiento y la amplificación y/o sobreexpresión de PI3K y Akt.
Además, existe evidencia de que la proliferación celular endotelial también puede depender de la señalización de la mTOR. La proliferación celular endotelial es estimulada por la activación del factor del crecimiento celular endotelial vascular (VEGF) de la vía de señalización PI3K-Akt-mTOR (Dancey, Expert Opinion on Investigational Drugs, 2005, 14, 313-328) . Más aun, se cree que la señalización de la mTOR quinasa controla parcialmente la síntesis del VEGF a través de efectos en la expresión del factor-10 inducible por hipoxia (HIF-10) (Hudson et al., Molecular y Cellular Biology, 2002, 22, 7004-7014) . Por lo tanto, la angiogénesis tumoral puede depender de la señalización de la mTOR de dos maneras: a través de la síntesis inducida por hipoxia del VEGF por parte de células tumorales y estromales y a través de la estimulación con el VEGF de la proliferación y supervivencia endoteliales a través de la señalización PI3K-Akt-mTOR.
Estos hallazgos sugieren que los inhibidores farmacológicos de la mTOR quinasa deberían ser valiosos desde el punto de vista terapéutico para el tratamiento de distintas formas de cáncer que comprenden tumores sólidos tales como carcinomas y sarcomas y las leucemias y malignidades linfoides. En particular, los inhibidores de la mTOR quinasa deberían ser de valor terapéutico para el tratamiento de, por ejemplo, cáncer de mama, colorrectal, de pulmón (incluyendo cáncer de pulmón de célula pequeña, cáncer de pulmón de célula no pequeña y cáncer bronquioloalveolar) y de próstata y cáncer del conducto biliar, óseo, de vejiga, cabeza y cuello, riñón, hígado, tejido gastrointestinal, esófago, ovario, páncreas, piel, testículo, tiroides, útero, cuello de útero y vulva y de leucemias (incluidas LLA y LMC) , mieloma múltiple y linfomas.
Además de la tumorigénesis, existe evidencia de que la mTOR quinasa participa en distintos síndromes de hamartoma. Estudios recientes han demostrado que las proteínas supresoras de tumores, como TSC1, TSC2, PTEN y LKB1, controlan fuertemente la señalización de la mTOR quinasa. La pérdida de estas proteínas supresoras de tumores conduce a distintas afecciones de hamartoma como resultado de una elevada señalización de la mTOR (Tee and Blenis, Seminars in Cell and Developmental Biology, 2005, 16, 29-37) . Entre los síndromes con una conexión molecular establecida con la desregulación de la mTOR quinasa se encuentran el síndrome de Peutz-Jeghers (PJS) , la enfermedad de Cowden, el síndrome de Bannayan-Riley-Ruvalcaba (BRRS) , el síndrome de Proteus, la enfermedad de Lhermitte-Duclos y la esclerosis tuberculosa (Inoki et al., Nature Genetics, 2005, 37, 19-24) . En general, los pacientes con estos síndromes desarrollan tumores hamartomatosos benignos en múltiples órganos.
Estudios recientes han revelado que la mTOR quinasa participa en otras enfermedades (Easton & Houghton, Expert Opinion on Therapeutic Targets, 2004, 8, 551-564) . Se ha demostrado que la rapamicina es un potente inmunosupresor, ya que inhibe la producción de anticuerpos y la proliferación de células T y células B inducidas por antígenos (Sehgal, Transplantation Proceedings, 2003, 35, 7S-14S) y, por lo tanto, los inhibidores de la mTOR quinasa también pueden ser inmunosupresores útiles. La inhibición de la actividad quinasa de la mTOR también puede ser útil en la prevención de la reestenosis, es decir, el control de la proliferación indeseada de células normales en la vasculatura en respuesta a la introducción de stents en el tratamiento de enfermedades de la vasculatura (Morice et al., New England Journal of Medicine, 2002, 346, 1773-1780) . Más aun, el everolimus, análogo de la rapamicina, puede reducir la gravedad e incidencia de la vasculopatía de aloinjerto cardíaco (Eisen et al., New England Journal of Medicine, 2003, 349, 847-858) . La elevada actividad de la mTOR quinasa se ha asociado con la hipertrofia cardíaca, que reviste importancia clínica como uno de los principales factores de riesgo para la insuficiencia cardíaca y es consecuencia de un aumento del tamaño celular de los cardiomiocitos (Tee & Blenis, Seminars in Cell and Developmental... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto de fórmula (I)
O
(R3) m
N
1Y
fórmula (I)
o una sal farmacéuticamente aceptable de los mismos; en donde
m es 0, 1, 2, 3 o 4;
1Y e Y2 son independientemente N o CR8 siempre que uno de 1Y e Y2 sea N y el otro sea CR8;
X es un grupo enlazante que se selecciona de -CR4 = CR5-, -CR4 = CR5CR6R7-, -CR6R7CR5 = CR4-, -C C-, -C CCR6R7
, -CR6R7C C-, -NR4CR6R7-, -OCR6R7-, -SCR6R7-, -S (O) CR6R7-, -S (O) 2CR6R7-, -C (O) NR4CR6R7-, -NR4C (O) CR6R7-, -NR4C (O) NR5CR6R7-, -NR4S (O) 2CR6R7-, -S (O) 2NR4CR6R7-, -C (O) NR4-, -NR4C (O) -, -NR4C (O) NR5-, -S (O) 2NR4- y – NR4S (O) 2-;
R1 es un grupo que se selecciona de hidrógeno, alquiloC1-6, alqueniloC2-6, alquiniloC2-6, carbociclilo, carbociclilalquiloC16, heterociclilo y heterociclilalquiloC1-6, y dicho grupo está opcionalmente sustituido por uno o más grupos sustituyentes que se seleccionan de halo, ciano, nitro, R9, -OR9, -SR9, -SOR9, -SO2R9, -COR9, -CO2R9, -CONR9R10, -NR9R10, – NR9COR10, -NR9CO2R10, -NR9CONR10R15, -NR9COCONR10R15 y –NR9SO2R10;
R2 es en donde A1 y A2 se seleccionan entre CH o N siempre que al menos uno de A1 o A2 sea CH;
cada R3, cuando está presente, se selecciona independientemente de halo, ciano, nitro, -R13, -OR13, -SR13, -SOR13, -SO2R13, -COR13, -CO2R13, -CONR13R14, -NR13R14, –NR13COR14, -NR13CO2R14 y -NR13SO2R14;
R4 y R5 son independientemente hidrógeno o alquiloC1-6;
o R1 y R4 junto con el átomo o átomos al que están unidos forman un anillo heterocíclico o carbocíclico de 4 a 10 miembros en donde 1, 2 o 3 átomos de carbono del anillo opcionalmente se reemplazan con N, O o S y dicho anillo está 25 opcionalmente sustituido por uno o más grupos sustituyentes que se seleccionan de halo, ciano, nitro, hidroxi, oxo, alquiloC1-6, alcoxiC1-6, haloalquiloC1-6, haloalcoxiC1-6, hidroxialquiloC1-6, hidroxialcoxiC1-6, alcoxiC1-6alquiloC1-6, alcoxiC16alcoxiC1-6, amino, alquilC1-6amino, bis (alquilC1-6) amino, aminoalquiloC1-6, (alquilC1-6) aminoalquiloC1-6, bis (alquilC16) aminoalquiloC1-6, cianoalquiloC1-6, alquilsulfoniloC1-6, alquilC1-6sulfonilamino, alquilC1-6sulfonil (alquilC1-6) amino, sulfamoilo, alquilC1-6sulfamoilo, bis (alquilC1-6) sulfamoilo, alcanoilC1-6amino, alcanoilC1-6 (alquilC1-6) amino, carbamoilo, alquilC1-6carbamoilo y bis (alquilC1-6) carbamoilo;
R6 y R7 se seleccionan independientemente de hidrógeno, halo, ciano, nitro y alquiloC1-6;
R8 se selecciona de hidrógeno, halo, ciano y alquiloC1-6;
R9 y R10 son independientemente hidrógeno o un grupo que se selecciona de alquiloC1-6, carbociclilo, carbociclilalquiloC1-6, heterociclilo y heterociclilalquiloC1-6 y dicho grupo está opcionalmente sustituido por uno o más grupos sustituyentes que se seleccionan de halo, ciano, nitro, hidroxi, alquiloC1-6, alcoxiC1-6, haloalquiloC1-6, haloalcoxiC1-6, hidroxialquiloC1-6, hidroxialcoxiC1-6, alcoxiC1-6alquiloC1-6, alcoxiC1-6alcoxiC1-6, amino, alquilC1-6amino, bis (alquilC1-6) amino, aminoalquiloC1-6, (alquilC1-6) aminoalquiloC1-6, bis (alquilC1-6) aminoalquiloC1-6, cianoalquiloC1-6, alquilsulfoniloC1-6, alquilC1-6sulfonilamino, alquilC1-6sulfonil (alquilC1-6) amino, sulfamoilo, alquilC1-6sulfamoilo, bis (alquilC16) sulfamoilo, alcanoilC1-6amino, alcanoilC1-6 (alquilC1-6) amino, carbamoilo, alquilC1-6carbamoilo y bis (alquilC16) carbamoilo;
R13
, R14 , R15 y R19 son independientemente hidrógeno o un grupo que se selecciona de alquiloC1-6, carbociclilo, carbociclilalquiloC1-6, heterociclilo y heterociclilalquiloC1-6 y dicho grupo está opcionalmente sustituido por uno o más grupos sustituyentes que se seleccionan de halo, ciano, nitro, hidroxi, alquiloC1-6, alcoxiC1-6, haloalquiloC1-6, haloalcoxiC1-6, hidroxialquiloC1-6, hidroxialcoxiC1-6, alcoxiC1-6alquiloC1-6, alcoxiC1-6alcoxiC1-6, amino, alquilC1-6amino, bis (alquilC1-6) amino, aminoalquiloC1-6, (alquilC1-6) aminoalquiloC1-6, bis (alquilC1-6) aminoalquiloC1-6, cianoalquiloC1-6, alquilsulfoniloC1-6, alquilC1-6sulfonilamino, alquilC1-6sulfonil (alquilC1-6) amino, sulfamoilo, alquilC1-6sulfamoilo, bis (alquilC16) sulfamoilo, alcanoilC1-6amino, alcanoilC1-6 (alquilC1-6) amino, carbamoilo, alquilC1-6carbamoilo y bis (alquilC16) carbamoilo;
o R18 y R19 junto con el átomo de nitrógeno al que están unidos forman un anillo heterocíclico de 3 a 10 miembros en donde 1 o 2 átomos de carbono del anillo opcionalmente se reemplazan con N, O o S y dicho anillo está opcionalmente sustituido por uno o más grupos sustituyentes que se seleccionan de halo, ciano, nitro, hidroxi, alquiloC1-6, alcoxiC1-6, haloalquiloC1-6, haloalcoxiC1-6, hidroxialquiloC1-6, hidroxialcoxiC1-6, alcoxiC1-6alquiloC1-6, alcoxiC1-6alcoxiC1-6, amino, alquilC1-6amino, bis (alquilC1-6) amino, aminoalquiloC1-6, (alquilC1-6) aminoalquiloC1-6, bis (alquilC1-6) aminoalquiloC1-6, cianoalquiloC1-6, alquilsulfoniloC1-6, alquilC1-6sulfonilamino, alquilC1-6sulfonil (alquilC1-6) amino, sulfamoilo, alquilC16sulfamoilo, bis (alquilC1-6) sulfamoilo, alcanoilC1-6amino, alcanoilC1-6 (alquilC1-6) amino, carbamoilo, alquilC1-6carbamoilo y bis (alquilC1-6) carbamoilo.
2. Un compuesto de fórmula (1) , o una sal farmacéuticamente aceptable del mismo, de acuerdo con la reivindicación 1 en donde 1Y es CH e Y2 es N.
3. Un compuesto de fórmula (I) , o una sal farmacéuticamente aceptable del mismo, de acuerdo con la reivindicación 1 o 2 en donde
o bien -X-R1 es -C (CH3) 2OH, o X es -S (O) 2CH2-, -S (O) 2CH (CH3) - o -S (O) 2C (CH3) 2-; y R1 es un grupo seleccionado de metilo, etilo, propilo, butilo, isobutilo, terc-butilo, ciclopropilo, ciclopentilo ciclohexilo, fenilo, bencilo, fenetilo, piridinilo, pirazoliloetilo, furanilometilo, tienilometilo, tiazolilometilo, tiadiazolilometilo y piraziniloetilo, y dicho grupo está opcionalmente sustituido por 1 o 2 grupos sustituyentes seleccionados de amino, halo, ciano, metilo, metoxi, trifluorometilo, trifluorometoxi, -NHCOCH3, -CONH2 y -CONHCH3.
4. Un compuesto de fórmula (I) , o una sal farmacéuticamente aceptable del mismo, de acuerdo con la reivindicación 3 en donde o bien -X-R1 es C (CH3) 2OH, o X es -S (O) 2CH2-, -S (O) 2CH (CH3) - o -S (O) 2C (CH3) 2-; y R1 es un grupo seleccionado de metilo, -CH2CH2OH y fenilo.
5. Un compuesto de fórmula (I) , o una sal farmacéuticamente aceptable de los mismos, de acuerdo con cualquiera de las reivindicaciones 1 a 4 en donde A1 y A2 son CH.
6. Un compuesto de fórmula (I) , o una sal farmacéuticamente aceptable del mismo, de acuerdo con cualquiera de las reivindicaciones 1 a 5 en donde R19 es hidrógeno o un grupo seleccionado de metilo, etilo, propilo, i-propilo, butilo, ibutilo, t-butilo, pentilo, ciclopropilo, ciclobutilo, ciclopentilo, ciclohexilo, fenilo, tienilo, imidazoilmetilo, isoxazolilo, pirazolilo, piridinilo y pirimidinilo, y dicho grupo está opcionalmente sustituido por uno o más grupos sustituyentes seleccionados de halo, ciano, nitro, hidroxi, alquiloC1-6, alcoxiC1-6, haloalquiloC1-6, haloalcoxiC1-6, hidroxialquiloC1-6, hidroxialcoxiC1-6, alcoxiC1-6alquiloC1-6, alcoxiC1-6alcoxiC1-6, amino, alquilC1-6amino, bis (alquilC1-6) amino, aminoalquiloC16, (alquilC1-6) aminoalquiloC1-6, bis (alquilC1-6) aminoalquiloC1-6, cianoalquiloC1-6, alquilsulfoniloC1-6, alquilC1-6sulfonilamino, alquilC1-6sulfonil (alquilC1-6) amino, sulfamoilo, alquilC1-6sulfamoilo, bis (alquilC1-6) sulfamoilo, alcanoilC1-6amino, alcanoilC16 (alquilC1-6) amino, carbamoilo, alquilC1-6carbamoilo y bis (alquilC1-6) carbamoilo.
7. Un compuesto de fórmula (I) , o una sal farmacéuticamente aceptable del mismo, de acuerdo con la reivindicación 6 en donde R 19 es un grupo seleccionado de metilo, etilo, ciclopropilo, -CH2CH2NMe2, -CH2CH2OH, 4-fluorofenilo, 4metoxifenilo y fenilo.
8. Un compuesto de fórmula (I) , o una sal farmacéuticamente aceptable del mismo, de acuerdo con la reivindicación 1 seleccionado de cualquiera de 3-etil-1-[4-[4-[ (3S) -3-metilmorfolin-4-il]-6- (metilsulfonilmetil) pirimidin-2-il]fenil]tiourea, 3-Ciclopropil-1-[4-[4-[ (3S) -3-metilmorfolin-4-il]-6- (metilsulfonilmetil) pirimidin-2-il]fenil]tiourea, 3- (4-fluorofenil) -1-[4-[4-[ (3S) -3-metilmorfolin-4-il]-6- (metilsulfonilmetil) pirimidin-2-il]fenil]tiourea, 1-[4-[4-[ (3S) -3-metilmorfolin-4-il]-6- (metilsulfonilmetil) pirimidin-2-il]fenil]-3-fenil-tiourea, 3- (4-metoxifenil) -1-[4-[4-[ (3S) -3-metilmorfolin-4-il]-6- (metilsulfonilmetil) pirimidin-2-il]fenil]tiourea, 3-ciclopropil-1-[4-[4-[ (3S) -3-metilmorfolin-4-il]-6- (2-metilsulfonilpropan-2-il) pirimidin-2-il]fenil]tiourea, 3-metil-1-[4-[4-[ (3S) -3-metilmorfolin-4-il]-6- (2-metilsulfonilpropan-2-il) pirimidin-2-il]fenil]tiourea, 3-etil-1-[4-[4-[ (3S) -3-metilmorfolin-4-il]-6- (2-metilsulfonilpropan-2-il) pirimidin-2-il]fenil]tiourea, 3- (2-hidroxietil) -1-[4-[4-[ (3 S) -3-metilmorfolin-4-il]-6- (2-metilsulfonilpropan-2-il) pirimidin-2-il]fenil]tiourea, 3- (2-dimetilaminoetil) -1-[4-[4-[ (3S) -3-metilmorfolin-4-il]-6- (2-metilsulfonilpropan-2-il) pirimidin-2-il]fenil]tiourea, 1-[4-[4-[2- (Bencenosulfonil) propan-2-il]-6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]-3-metiltiourea, 1-[4-[4-[2- (bencenosulfonil) propan-2-il]-6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]-3-ciclopropiltiourea, 1-[4-[4-[2- (bencenosulfonil) propan-2-il]-6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]-3-etiltiourea, 1-[4-[4-[2- (bencenosulfonil) propan-2-il]-6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]-3- (2-hidroxietil) tiourea, 3- (2-hidroxietil) -1-[4-[4-[2- (3-hidroxipropilsulfonil) propan-2-il]-6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]tiourea, 1-[4-[4-[2- (3-hidroxipropilsulfonil) propan-2-il]-6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]-3-metiltiourea, 3-ciclopropil-1-[4-[4-[2- (3-hidroxipropilsulfonil) propan-2-il]-6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]tiourea, 3-etil-1-[4-[4-[2- (3-hidroxipropilsulfonil) propan-2-il]-6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]tiourea, 3- (2-hidroxietil) -1-[4-[4- (2-hidroxipropan-2-il) -6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]tiourea, 1-[4-[4- (2-hidroxipropan-2-il) -6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]-3-metiltiourea,
3. ciclopropil-1-[4-[4- (2-hidroxipropan-2-il) -6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]tiourea y 3-etil-1-[4-[4- (2-hidroxipropan-2-il) -6-[ (3S) -3-metilmorfolin-4-il]pirimidin-2-il]fenil]tiourea, o una sal farmacéuticamente aceptable de los mismos.
9. Un compuesto de fórmula (I) , o una sal farmacéuticamente aceptable del mismo, de acuerdo con la reivindicación 8 donde el compuesto es 3- (2-hidroxietil) -1-[4-[4- (2-hidroxipropan-2-il) -6-
Patentes similares o relacionadas:
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Conectores autoinmolativos no lineales y conjugados de los mismos, del 22 de Julio de 2020, de Byondis B.V: Compuesto conector-farmaco con la formula (I) **(Ver fórmula)** o sal, hidrato o solvato farmaceuticamente aceptables del mismo, donde […]