Derivados (3-aril-piperazina-1-ilo) de 6,7-dialcoxiquinazolina, 6,7-dialcoxiftalazina y 6,7-dialcoxiisoquinolina.
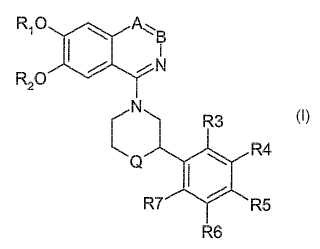
Un compuesto que tiene la estructura I
en la que
• Q es NH
• A y B se seleccionan independientemente de CH y N con la condición de que A y B no son ambos N al mismo tiempo
• R1 y R2 son independientemente alquilo C1-C4
• R3,
R4, R5, R6 y R7 se seleccionan independientemente de:
o H, alquilo (C1-C6), alcoxi (C1-C6), halógeno, halo-alquilo (C1-C6), hidroxialquilo (C1-C6), alcoxi (C1C6) -alquilo (C1-C6), hidroxicicloalquilo (C3-C6), cicloalcoxi (C3-C8), alcoxi (C1-C6) -cicloalquilo (C3-C8), heterocicloalquilo, hidroxiheterocicloalquilo, y alcoxi (C1-C6) -heterocicloalquilo, en los que cada resto cicloalquilo (C3-C8) o heterocicloalquilo puede estar independientemente sustituido con uno a tres alquilo (C1-C6);
o un grupo –NR8R9, en el que R8 y R9 se seleccionan independientemente de hidrógeno, alquilo C1-C6, halo-alquilo (C1-C6), cicloalquilo (C3-C8), heterocicloalquilo;
o un heterociclo alifático de 6-7 miembros:
en el que n es 1 o 2 y Z es oxígeno o NR10, en el que R10 es hidrógeno o alquilo (C1-C6), o
o una cetona, sulfona, éster, amida, éster sulfónico o sulfonamida, seleccionado de
donde Y es hidrógeno o alquilo (C1-C6) y X se selecciona de:
• un grupo alquilo (C1-C6) no sustituido o sustituido con uno o más halógenos, º -O-alquilo (C1-C6) no sustituido o sustituido con uno o más halógenos,
• un grupo –NR11R12, donde R11 y R12 se seleccionan independientemente de hidrógeno, alquilo C1-C6, halo-alquilo (C1-C6), cicloalquilo (C3-C8), heterocicloalquilo, o
• un heterociclo alifático de 6-7 miembros:
en el que n es 1 o 2; y W es oxígeno o NR13, donde R13 es hidrógeno o alquilo (C1-C6), o
• R4, R5 y R6 son independientemente nitro, o
• dos sustituyentes adyacentes seleccionados de R3, R4, R5, R6 y R7 pueden formar junto con los átomos de carbono a los que están unidos un anillo saturado o insaturado de 5-7 miembros, que contiene carbono y opcionalmente uno o dos heteroátomos seleccionados de N, O o S, y opcionalmente sustituido con un grupo alcoxi (C1-C6) . Los tres sustituyentes restantes seleccionados de R3, R4, R5, R6 y R7, que no forman parte del anillo, se seleccionan independientemente como se ha indicado antes,
o una de sus sales farmacéuticamente aceptables.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2007/000351.
Solicitante: H. LUNDBECK A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: OTTILIAVEJ 9 2500 VALBY-COPENHAGEN DINAMARCA.
Inventor/es: KEHLER, JAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/541 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Tiazinas no condensadas conteniendo otros heterociclos.
- A61P25/28 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › de los problemas neurodegenerativos del sistema nervioso central, p. ej. noótropos, activadores del conocimiento, medicamentos para el tratamiento del Alzheimer o de otras formas de demencia.
- C07D403/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 403/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, no previstos por el grupo C07D 401/00. › unidos directamente por un enlace entre dos miembros cíclicos.
- C07D407/14 C07D […] › C07D 407/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de oxígeno como únicos heteroátomos del ciclo, no previstos por el C07D 405/00. › que contienen tres o más heterociclos.
- C07D413/04 C07D […] › C07D 413/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y oxígeno como únicos heteroátomos del ciclo. › unidos directamente por un enlace entre dos miembros cíclicos.
- C07D417/04 C07D […] › C07D 417/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y azufre como únicos heteroátomos del ciclo, no previstos por el C07D 415/00. › unidos directamente por un enlace entre dos miembros cíclicos.
PDF original: ES-2392553_T3.pdf
Fragmento de la descripción:
Derivados (3-aril-piperazina-1-ilo) de 6, 7-dialcoxiquinazolina, 6, 7-dialcoxiftalazina y 6, 7-dialcoxiisoquinolina
Campo de la invención
La presente invención proporciona compuestos que son inhibidores de la enzima PDE10A, y como tales son útiles para tratar los trastornos neurodegenerativos y psiquiátricos asociados. La presente invención proporciona también composiciones farmacéuticas y métodos para tratar dichos trastornos utilizando los compuestos de la invención.
Antecedentes de la invención
Los nucleótidos cíclicos, monofosfato de adenosina cíclica (cAMP) y monofosfato de guanosina cíclica (cGMP) funcionan como mensajeros secundarios intracelulares que regulan un vasto ordenamiento de procesos en las neuronas. Los cAMP y cGMP intracelulares se generan por las adenil-ciclasas y guanil-ciclasas, y se degradan por las fosfodiesterasas (PDE) de los nucleótidos cíclicos. Los niveles intracelulares de cAMP y cGMP se controlan por señalización intracelular, y la estimulación/represión de las adenil-ciclasas y guanil-ciclasas en respuesta a la activación de GPCR es un modo bien caracterizado de controlar las concentraciones de nucleótidos cíclicos (Antoni,
F. A. Front. Neuroendocrinal. 2000, 21 (2) , 103-132) . En las neuronas, esto incluye la activación de las cinasas dependientes de cAMP y cGMP y la subsiguiente fosforilación de las proteínas implicadas en la regulación aguda de la transmisión sináptica así como en la diferenciación y supervivencia neuronal.
Hay 21 genes de fosfodiesterasas que se pueden dividir en 11 familias de genes. Hay diez familias de adenililciclasas, dos de guanilil-ciclasas, y once de fosfodiesterasas. Las PDE son una clase de enzimas intracelulares que regulan los niveles de cAMP y cGMP mediante la hidrólisis del nucleótido cíclico en sus respectivos monofosfatos de nucleótido. Algunas PDE degradan los cAMP, algunas los cGMP y algunas ambos. La mayor parte de las PDEs tienen una expresión relativamente dispersada y desempeñan papeles en muchos tejidos, mientras que algunas están más espacialmente restringidas.
La fosfodiesterasa 10A (PDE10A) es una fosfodiesterasa de especificidad dual que puede convertir tanto al cAMP en AMP como al cGMP en GMP (Loughney, K. et al. Gene 1999, 234, 109-117; Fujishige, K. et al. Eur. J. Biochem. 1999, 266, 1118-1127 y Soderling, S. et al. Proc. Natl. Acad. Sci. 1999, 96, 7071-7076) . La PDE10A se expresa principalmente en las neuronas en el cuerpo estriado, núcleo accumbens y en el tubérculo olfatorio (Kotera, J. et al. Biochem. Biophys. Res. Comm. 1999, 261, 551-557 y Seeger, T.F. et al. Brain Research, 2003, 985, 113-126) .
La PDE10A de ratón es el primer miembro de la familia PDE10 de fosfodiesterasas (Fujishige, K. et al. J. Biol. Chem. 1999, 274, 18438-18445 y Loughney, K. et al. Gene 1999, 234, 109-117) y se han identificado variantes de corte y empalme en N-terminal tanto de genes de la rata como de genes humanos (Kotera, J. et al. Biochem. Biophys. Res. Comm. 1999, 261, 551-557 y Fujishige, K. et al. Eur. J. Biochem. 1999, 266, 1118-1127) . Hay un alto grado de homología entre especies. La PDE10A se localiza únicamente en los mamíferos en relación con otras familias PDE. El mRNA de la PDE10 está altamente expresado en los testículos y en el cerebro (Fujishige, K. et al. Eur J Biochem. 1999, 266, 1118-1127; Soderling, S. et al. Proc. Natl. Acad. Sci. 1999, 96, 7071-7076 y Loughney, K. et al. Gene 1999, 234, 109-117) . Estos estudios indican que dentro del cerebro, la expresión de PDE10 es más alta en el cuerpo estriado (núcleo caudado y putamen) , núcleo accumbens y tubérculo olfatorio. Más recientemente, se ha hecho un análisis del modelo de expresión en el cerebro de roedor del mRNA de PDE10A (Seeger, T.F. et al. Abst. Soc. Neurosci. 2000, 26, 345.10) y proteína PDE10A (Menniti, F.S. et al. William Harvey Research Conference ‘Phosphodiesterase in Health and Disease', Porto, Portugal, Dec. 5-7, 2001) .
La PDE10A se expresa a niveles altos por las neuronas espinosas mediales (MSN) del núcleo caudado, núcleo accumbens y las correspondientes neuronas del tubérculo olfatorio. Esto constituye el núcleo del sistema de ganglios basales. Las MSN desempeñan un papel en un bucle ganglio-tálamo-cortical cortical-basal, que integra el aporte cortical/talámico convergente, y que vuelve a enviar esta información integrada a la corteza. Además, las MSN expresan dos clases funcionales de neuronas: la clase D1 que expresa los receptores D1 de dopamina y la clase D2 que expresa los receptores D2 de dopamina. La clase D1 de neuronas es parte de la ruta de salida estriatal 'directa', que funciona ampliamente para facilitar las respuestas de comportamiento. La clase D2 de neuronas es parte de la ruta de salida estriatal 'indirecta', que funciona para suprimir las respuestas de comportamiento que compiten con las que son facilitadas por la ruta 'directa'. Estas rutas competidoras actúan como el freno y el acelerador de un coche. A simple vista, la limitación de movimiento en la enfermedad de Parkinson resulta de la sobreactividad de la ruta 'indirecta', mientras que el exceso de movimiento en trastornos tales como la enfermedad de Huntington representa una sobreactividad de la ruta directa. La regulación por la PDE10A de la señalización de cAMP y/o cGMP en el compartimento dendrítico de estas neuronas puede estar implicada en la filtración del aporte córtico/talámico en las MSN. Además, la PDE10A puede estar implicada en la regulación de la liberación de GABA en la substantia nigra y en el globus pallidus (Seeger, T.F. et al. Brain Research, 2003, 985, 113-126) .
El antagonismo del receptor D2 de dopamina está bien establecido en el tratamiento de la esquizofrenia. Desde la década de 1950, el antagonismo del receptor D2 de dopamina ha sido el pilar del tratamiento de las psicosis y todos los fármacos antipsicóticos eficaces antagonizan a los receptores D2. Los efectos de D2 es probable que estén mediados principalmente por las neuronas del cuerpo estriado, núcleo accumbens y tubérculo olfatorio, ya que estas
áreas reciben las proyecciones dopaminérgicas más densas y tienen la expresión más fuerte de los receptores D2 (Konradi, C. and Heckers, S. Society of Biological Psychiatr y , 2001, 50, 729-742) . El agonismo del receptor D2 de dopamina lleva a una disminución de los niveles de cAMP en las células cuando es expresado por la inhibición de la adenilato-ciclasa, y este es un componente de señalización de D2 (Stoof, J.C. and Kebabian J.W. Nature 1981, 294, 366-368 y Neve, K. A. et al. Journal of Receptors and Signal Transduction 2004, 24 (3) , 165-205) . Inversamente, el antagonismo del receptor D2 aumenta de un modo efectivo los niveles de cAMP, y este efecto podría ser imitado por la inhibición de las fosfodiesterasas que degradan el cAMP.
La mayor parte de los 21 genes de fosfodiesterasas están ampliamente expresados; por lo que es probable que la inhibición tenga efectos secundarios. Puesto que la PDE10A, en este contexto, tiene el perfil de expresión deseado con alta y relativamente específica expresión en las neuronas del cuerpo estriado, núcleo accumbens y tubérculo olfatorio, la inhibición de la PDE10A es probable que tenga efectos similares al antagonismo del receptor D2 y por tanto que tenga efectos antipsicóticos.
Aunque se espera que la inhibición de la PDE10A imite al antagonismo del receptor D2 en parte, se puede esperar que tenga un perfil diferente. El receptor D2 tiene componentes de señalización además del cAMP (Neve, K. A. et al. Journal of Receptors and Signal Transduction 2004, 24 (3) , 165-205) , por lo que la interferencia con cAMP por la inhibición de PDE10A puede modular negativamente más bien que antagonizar directamente la señalización de dopamina por los receptores D2. Esto puede reducir el riesgo de los efectos secundarios extrapiramidales que se observan con un fuerte antagonismo de D2. A la inversa, la inhibición de la PDE10A puede tener algunos efectos no observados con el antagonismo del receptor D2. La PDE10A se expresa también en los receptores D1 que se expresan en las neuronas estriatales (Seeger, T.F. et al. Brain Research, 2003, 985, 113-126) . Puesto que el agonismo del receptor D1 lleva a la estimulación de la adenilato-ciclasa y produce un aumento de los niveles de cAMP, la inhibición de la PDE10A es probable que también tenga efectos que imiten el agonismo del receptor D1. Finalmente, la inhibición de la PDE10A no sólo aumentará el cAMP en las células, sino que se podría esperar también que aumente los... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto que tiene la estructura I
en la que 5 • Q es NH
• A y B se seleccionan independientemente de CH y N con la condición de que A y B no son ambos N al mismo tiempo
• R1 y R2 son independientemente alquilo C1-C4
• R3, R4, R5, R6 y R7 se seleccionan independientemente de:
o H, alquilo (C1-C6) , alcoxi (C1-C6) , halógeno, halo-alquilo (C1-C6) , hidroxialquilo (C1-C6) , alcoxi (C1C6) -alquilo (C1-C6) , hidroxicicloalquilo (C3-C6) , cicloalcoxi (C3-C8) , alcoxi (C1-C6) -cicloalquilo (C3-C8) , heterocicloalquilo, hidroxiheterocicloalquilo, y alcoxi (C1-C6) -heterocicloalquilo, en los que cada resto cicloalquilo (C3-C8) o heterocicloalquilo puede estar independientemente sustituido con uno a tres alquilo (C1-C6) ;
o un grupo –NR8R9, en el que R8 y R9 se seleccionan independientemente de hidrógeno, alquilo C1-C6, halo-alquilo (C1-C6) , cicloalquilo (C3-C8) , heterocicloalquilo;
o un heterociclo alifático de 6-7 miembros:
en el que n es 1 o 2 y Z es oxígeno o NR10, en el que R10 es hidrógeno o alquilo (C1-C6) , o
o una cetona, sulfona, éster, amida, éster sulfónico o sulfonamida, seleccionado de
donde Y es hidrógeno o alquilo (C1-C6) y X se selecciona de:
• un grupo alquilo (C1-C6) no sustituido o sustituido con uno o más halógenos, º -O-alquilo (C1-C6) no sustituido o sustituido con uno o más halógenos,
• un grupo –NR11R12, donde R11 y R12 se seleccionan independientemente de hidrógeno, alquilo C1-C6, halo-alquilo (C1-C6) , cicloalquilo (C3-C8) , heterocicloalquilo, o
• un heterociclo alifático de 6-7 miembros:
en el que n es 1 o 2; y W es oxígeno o NR13, donde R13 es hidrógeno o alquilo (C1-C6) , o
• R4, R5 y R6 son independientemente nitro, o
• dos sustituyentes adyacentes seleccionados de R3, R4, R5, R6 y R7 pueden formar junto con los átomos de carbono a los que están unidos un anillo saturado o insaturado de 5-7 miembros, que contiene carbono y opcionalmente uno o dos heteroátomos seleccionados de N, O o S, y opcionalmente sustituido con un grupo alcoxi (C1-C6) . Los tres sustituyentes restantes seleccionados de R3, R4, R5, R6 y R7, que no forman parte del anillo, se seleccionan independientemente como se ha indicado antes,
o una de sus sales farmacéuticamente aceptables.
2. El compuesto de la reivindicación 1, en el que A = N y B = CH, o en el que A = CH y B = CH, o en el que A = CH y B = N, y en el que Q, R1, R2, R3, R4, R5, R6 y R7 son como se definen en la reivindicación 1.
3. El compuesto según una cualquiera de las reivindicaciones precedentes, en el que R1 y R2 son independientemente alquilo C1-C2.
4. El compuesto según una cualquiera de las reivindicaciones precedentes, en el que R3 se selecciona de H, alcoxi (C1-C6) o halógeno.
5. El compuesto según una cualquiera de las reivindicaciones precedentes, en el que R4 se selecciona de H, alcoxi (C1-C6) , halógeno o nitro.
6. El compuesto según una cualquiera de las reivindicaciones precedentes, en el que R5 se selecciona de
• hidrógeno, alquilo (C1-C6) , alcoxi (C1-C6) , halógeno, halo-alquilo (C1-C6) , nitro, o
• un grupo -NR8R9, en el que R8 y R9 se seleccionan independientemente de hidrógeno, alquilo C1-C6, haloalquilo (C1-C6) , cicloalquilo (C3-C8) , heterocicloalquilo, o
• un heterociclo alifático de 6-7 miembros:
,
en el que n es 1 o 2 y Z es oxígeno o NR10, donde R10 es hidrógeno o alquilo (C1-C6) .
7. El compuesto según una cualquiera de las reivindicaciones precedentes, en el que R6 se selecciona de H, alcoxi (C1-C6) , halógeno o nitro.
8. El compuesto según una cualquiera de las reivindicaciones precedentes, en el que R7 se selecciona de H, alcoxi (C1-C6) o halógeno.
9. El compuesto según una cualquiera de las reivindicaciones precedentes, en el que dos sustituyentes adyacentes seleccionados de R3, R4, R5, R6 y R7, junto con los átomos de carbono a los que están unidos, forman un anillo saturado o insaturado de 5-7 miembros, que contiene uno o dos heteroátomos seleccionados de N, O o S.
10. El compuesto de la reivindicación 1, en el que el compuesto se selecciona de 6, 7-dimetoxi-4- (3- (3-metoxifenil) piperazin-1-il) -quinazolina; 6, 7-dimetoxi-4- ( (R) -3- (3-metoxifenil) -piperazin-1-il) -quinazolina; 6, 7-dimetoxi-4- ( (S) -3- (3metoxifenil) -piperazin-1-il) -quinazolina; 6, 7-dimetoxi-4- ( (R) -3-fenil-piperazin-1-il) -quinazolina; 6, 7-dimetoxi-4- ( (S) -3fenil-piperazin-1-il) -quinazolina; 4-[3- (3, 4, 5-trimetoxifenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (2-metoxifenil) piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (4-dimetilaminofenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (3, 4metilendioxifenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (2, 5-diclorofenil) -piperazin-1-il]-6, 7-dimetoxiquinazolina; 4-[3- (4-metilfenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (4-fluorofenil) -piperazin-1-il]-6, 7-dimetoxiquinazolina; 4-[3- (4-etilfenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (4-metoxifenil) -piperazin-1-il]-6, 7-dimetoxiquinazolina; 4-[3- (4-clorofenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (3-clorofenil) -piperazin-1-il]-6, 7-dimetoxiquinazolina; 4-[3- (3-nitrofenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (4-nitrofenil) -piperazin-1-il]-6, 7-dimetoxi
quinazolina; 6, 7-dimetoxi-4- (3-naftalen-2-il-piperazin-1-il) -quinazolina; 6, 7-dimetoxi-4- (3-naftalen-1-il-piperazin-1-il) quinazolina; 4-[3- (3, 5-dimetoxifenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (2, 5-dimetoxifenil) -piperazin-1-il]6, 7-dimetoxi-quinazolina; 4-[3- (4-trifluoro-metilfenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (2, 4-diclorofenil) piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (3-bromofenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 4-[3- (4bromofenil) -piperazin-1-il]-6, 7-dimetoxi-quinazolina; 6, 7-dimetoxi-4- (3- (6-memoxi-naftalen-2-il) -piperazin-1-il) quinazolina; 6, 7-dimetoxi-4-[3- (4-morfolin-4-il-fenil) -piperazin-1-il]-quinazolina; 4-[3- (2, 4'-dicloro-5-fluorofenil) piperazin-1-il]-6, 7-dimetoxi-quinazolina; o una de sus sales farmacéuticamente aceptables.
11. Un procedimiento para la preparación de los compuestos de la fórmula I según la reivindicación 1, que comprende hacer reaccionar un compuesto de la fórmula II:
en la que L es un grupo saliente seleccionado de Cl, Br, I, OSO2CF3, y A, B, R1 y R2 son como se definen en la reivindicación 1; con un compuesto de la fórmula III:
bien como la base o libre o bien como una sal de adición de la misma; donde Q, R3, R4, R5, R6 y R7 son como se definen en la reivindicación 1; en un disolvente neto, o en un disolvente inerte o mezcla de disolventes, a una temperatura entre 0 y aproximadamente 200 ºC, opcionalmente en presencia de una base, opcionalmente en presencia de un catalizador de paladio, seguido por el tratamiento y aislamiento del producto de la fórmula I, como su base libre o como una sal de adición de ácido de la misma.
12. El procedimiento de la reivindicación 11, en el que el catalizador de paladio se forma in situ mezclando una fuente de paladio (II) tal como Pd (OAc) 2 o Pd2 (dba) 3 con un ligando de bifosfina tal como BINAP (2, 2'bis (difenilfosfino) -1, 1’-binaftilo) , en el disolvente de reacción.
13. Una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de un compuesto de la reivindicación 1 y un vehículo o diluyente farmacéuticamente aceptable.
14. Un compuesto de una cualquiera de las reivindicaciones 1-11, o una de sus sales de adición de ácido farmacéuticamente aceptables, para uso en el tratamiento de un trastorno neurodegenerativo o psiquiátrico, en el que el trastorno neurodegenerativo se selecciona del grupo que consiste en la enfermedad de Alzheimer, demencia por multi-infartos, demencia alcohólica o demencia relacionada con otros fármacos, demencia asociada con tumores intracraneales o trauma cerebral, demencia asociada con la enfermedad de Huntington o la enfermedad de Parkinson, o demencia relacionada con el SIDA; delirio; trastorno amnésico; trastorno de estrés post-traumático; retraso mental; un trastorno de aprendizaje, por ejemplo trastorno de lectura, trastorno para las matemáticas, o un trastorno de expresión escrita; trastorno de déficit de atención/hiperactividad; y deterioro cognitivo relacionado con la edad, y el trastorno psiquiátrico se selecciona del grupo que consiste en esquizofrenia, por ejemplo del tipo paranoide, desorganizada, catatónica, indiferenciada, o residual; trastorno esquizofreniforme; trastorno esquizoafectivo, por ejemplo de tipo delirante o de tipo depresivo; trastorno delirante; trastorno psicótico inducido por sustancias, por ejemplo psicosis inducida por alcohol, anfetaminas, cannabis, cocaína, alucinógenos, inhalantes, opioides, o fenciclidina; trastorno de la personalidad de tipo paranoide; y trastorno de la personalidad de tipo esquizoide;.
15. Un compuesto de una cualquiera de las reivindicaciones 1-11, o una de sus sales de adición de ácido farmacéuticamente aceptables, para uso como un medicamento.
Patentes similares o relacionadas:
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Tratamientos de combinación que comprenden imidazopirazinonas para el tratamiento de trastornos psiquiátricos y/o cognitivos, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de Fórmula (I) **(Ver fórmula)** en donde n es 0 o 1; q es 0 o 1; R1 se selecciona del grupo que consiste en bencilo, indanilo, indolina y heteroarilos […]
Composición farmacéutica basada en nanoestructura de grafeno para prevenir o tratar enfermedades neurodegenerativas, del 22 de Julio de 2020, de Seoul National University R & DB Foundation: Una composición farmacéutica para su uso en la prevención o el tratamiento de enfermedades neurodegenerativas, que comprende puntos cuánticos de grafeno como […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Triple combinación de antagonistas del receptor 5-HT6 puros, inhibidores de la acetilcolinesterasa y antagonista del receptor NMDA, del 15 de Julio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un antagonista del receptor 5-HT6 puro, un inhibidor de la acetilcolinesterasa y un antagonista del receptor NMDA, en el que el antagonista […]
Antagonistas del receptor p2x7 derivados de N-[2-(4-fenoxipiperidin-1-il)-2-(1,3-tiazol-5-il)etil]benzamida y N-[2-(4-benciloxipiperidin-1-il)-2-(1,3-tiazol-5-il)etil]benzamida sustituidas, del 15 de Julio de 2020, de AXXAM S.P.A: Un compuesto de la siguiente fórmula (I) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** incluyendo cualquier forma estereoquímicamente […]
Composición que comprende cinamaldehído y cinc, del 8 de Julio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Composición que comprende cinamaldehído y cinc para la utilización en la mejora de uno o más de rendimiento cognitivo, cognición, humor o memoria en un […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]