COMPOSICIÓN PARA AMPLIFICAR ÁCIDOS NUCLEICOS.
Una composición líquida concentrada y tamponada para amplificar ácidos nucleicos,
que comprende al menos un dNTP, al menos una enzima requerida para la amplificación, al menos un cebador oligonucleotidico, al menos una sonda nucleotídica fluorescente y polivinilpirrolidona (PVP)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2005/003503.
Solicitante: BIORAD PASTEUR.
Nacionalidad solicitante: Francia.
Dirección: 3, BOULEVARD RAYMOND POINCARÉ 92430 MARNES-LA-COQUETTE FRANCIA.
Inventor/es: SAVOYE,Chantal , SARFATI,Patrice.
Fecha de Publicación: .
Fecha Solicitud PCT: 22 de Noviembre de 2005.
Clasificación Internacional de Patentes:
- C12Q1/68D
Clasificación PCT:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
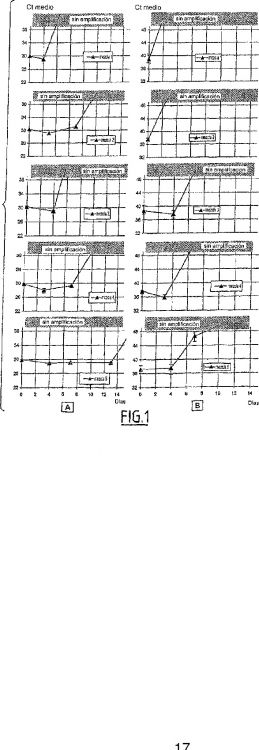
Fragmento de la descripción:
La invención se refiere a una composición estable de reactivos para amplificar ácidos nucleicos.
La amplificación de ácidos nucleicos se usa habitualmente para detectar pequeñas cantidades de genes específicos en el campo diagnóstico, o en el campo de la médicina en particular.
Existen varias técnicas de amplificación: PCR (polymerase chain reaction, reacción en cadena de la 5 polimerasa), RT-PCR (transcripción inversa seguida por PCR), SDA (strand displacement amplification, amplificación por desplazamiento de hebra), NASBA (nucleic acid sequence-based amplification, amplificación basada en la secuencia de ácidos nucleicos), etc. Cada una de ellas requiere el uso de una mezcla de varios reactivos: uno o más cebadores oligonucleotídicos, dNTPs (trifosfatos de desoxinucleótidos), una o más enzimas (polimerasa, transcriptasa inversa, etc.), un tampón salino y, ventajosamente, una o más sondas fluorescentes. 10
La mezcla de estos reactivos implica un pipeteado meticuloso de cada uno de ellos, con objeto de conseguir los niveles de rendimiento de sensibilidad y especificidad, y para asegurar la reproducibilidad de los resultados de la amplificación. Además, la preparación de la mezcla de los reactivos de amplificación debe estar separada físicamente de la adición del ácido nucleico que se va a amplificar, de modo que se evite la contaminación de las disoluciones madre de los reactivos de amplificación con el ácido nucleico que se va a amplificar. 15
Estos reactivos se conservan generalmente a -20°C, y las sondas y los cebadores están muy habitualmente liofilizados de manera que se asegure un almacenamiento duradero a largo plazo.
Entonces pueden usarse agentes crioprotectores, por ejemplo, azúcares o polioles, de modo que se mantenga la integridad de los oligonucleótidos durante la liofilización (patente EP833667). Similarmente, se usa glicerol para proteger las enzimas (patente EP455744). 20
La patente EP455744 proporciona, además, un concentrado de reacción para la secuenciación de ácidos nucleicos, el cual comprende una polimerasa termoestable, dNTPs, un ddNTP, un agente reductor, glicerol, y opcionalmente, un cebador, evitando así la mezcla de estos reactivos en el momento de su utilización.
Además, la compañía ARTUS vende los kits de amplificación que contienen todos los reactivos requeridos para la amplificación. Sin embargo, estos kits deben conservarse imperativamente a -20°C. Adicionalmente, el 25 proveedor indica que la conservación a 4°C no puede exceder las 5 horas.
No existe ninguna composición estable durante varios meses a 4°C, para amplificar ácidos nucleicos (denominada habitualmente una "mezcla"), que contenga todos los reactivos requeridos para la reacción de amplificación, y en particular, una o más sondas nucleotídicas fluorescentes.
El uso de las sondas nucleotídicas fluorescentes es particularmente ventajoso para detectar y controlar las 30 reacciones de amplificación (tales como, en particular, una PCR o una RT-PCR en tiempo real). Esto es debido a que las pruebas de amplificación que usan sondas fluorescentes eliminan cualquier etapa manual de post-amplificación para la detección, lo que hace posible obtener un rápido resultado y evitar el riesgo de contaminaciones con aerosoles ("arrastre").
Ahora el problema que surge es el de la estabilidad de las sondas fluorescentes usadas, que se degradan 35 rápidamente, sumándose a la inestabilidad de las enzimas y de los dNTPs usados para la amplificación.
Los autores de la presente invención se han esforzado por resolver estos problemas deseando al mismo tiempo evitar los inconvenientes de la mezcla extemporánea de los reactivos.
Los autores de la invención han demostrado pues que la presencia de polivinilpirrolidona (PVP), y opcionalmente de un poliol, hace posible estabilizar tanto las enzimas como las sondas fluorescentes en una 40 composición líquida, o incluso también los dNTPs.
Un objeto de la invención es por tanto una composición líquida concentrada y tamponada para amplificar ácidos nucleicos que comprende al menos un dNTP, al menos una enzima requerida para la amplificación, al menos un cebador nucleotidídico y al menos una sonda nucleotídica fluorescente, en presencia de polivinilpirrolidona (PVP) y opcionalmente de un poliol. En particular, cuando la composición líquida tamponada para amplificar ácidos 45 nucleicos comprende tanto un poliol como PVP, el poliol es seleccionado preferiblemente del grupo formado por glicerol, sorbitol, pentaeritritol, inositol, dulcitol, manitol, propilenglicol o etilenglicol.
Dicha composición, también denominada comúnmente como "mezcla", ofrece la ventaja de ser estable en el tiempo independientemente de las condiciones de almacenamiento. Incluso después de la conservación durante varios meses a temperatura ambiente, las enzimas, las sondas fluorescentes o incluso también los dNTPs 50
permanecen estables. El nivel de sensibilidad y especificidad requerido para la amplificación y la detección del ácido nucleico está asegurada.
La composición no requiere el uso de ninguna manipulación adicional distinta a la adición de un diluyente, y por esta razón, puede considerarse como una mezcla de reacción lista para su uso.
Esta composición es útil independientemente del tipo de amplificación de ácido nucleico contemplada. 5
El término “amplificación” pretende significar el incremento en la concentración de una secuencia de ácido nucleico específica desde un ácido nucleico purificado o desde una mezcla de secuencias de ácidos nucleicos. Esta etapa de amplificación puede llevarse a cabo mediante cualquier procedimiento convencional de amplificación enzimática de ADN o ARN, tal como, en particular, una PCR descrita por Saiki y col. (1988) y en las patentes EP200362 y 201184, las técnicas de TAS (transcription-based amplification system, sistema de amplificación basada 10 en la transcripción) propuestas por Kwoh y col. (1989), la técnica de 3SR (self-sustained sequence replication, replicación de secuencia automantenida) descrita por Fahy y col. (1991), la técnica NASBA (nucleic acid sequence-based amplification, amplificación basada en la secuencia de ácidos nucleicos) descrita en la patente EP329822, la técnica de amplificación mediada por transcripción (transcription mediated amplification, TMA) descrita en la patente US5.399.491, la técnica de amplificación por desplazamiento de hebra SDA (strand displacement amplification) 15 descrita por Walker y col. (1992), la técnica de reacción en cadena de la ligasa (ligase chain reaction LCR, gap-LCR) descrita en la patente EP0320308, la técnica de amplificación en círculo rodante (rolling circle amplification, RCA) descrita en Nat. Genet. (1998) Jul; 19 (3) 225-232, o incluso la técnica de amplificación lineal enlazada (LLA, linked linear amplification) descrita en la patente US6.027.923.
Preferiblemente, la amplificación es una PCR en tiempo real o una RT-PCR en tiempo real. 20
Una composición preferida es una composición según se definió anteriormente para amplificar ácidos nucleicos mediante PCR, que comprende dATP, dCTP, dGTP y uno o más de dTTP o dUTP, y también al menos una enzima requerida para la PCR, al menos dos cebadores oligonucleotídicos, y al menos una sonda nucleotídica fluorescente, en presencia de PVP y opcionalmente de un poliol.
Otra composición preferida es una composición según se definió anteriormente para amplificar ácidos 25 nucleicos mediante RT-PCR, que comprende dATP, dCTP, dGTP, y uno de dTTP o dUTP, y también al menos una enzima requerida para la RT-PCR, al menos dos cebadores oligonucleotídicos, y al menos una sonda nucleotídica fluorescente, en presencia de PVP y opcionalmente de un poliol.
Tampón:
La expresión “composición tamponada” pretende significar que el pH de la composición está controlado por 30 la presencia de un tampón. Puede ser una disolución salina tamponada estándar, por ejemplo, que contenga una sal de tris-(hidroximetil)aminometano (TRIS®), preferiblemente el clorhidrato o el acetato, en agua, de manera que se alcance una concentración de TRIS® de 5 mM a 500 mM, preferiblemente de 7 mM a 400 mM.
A esta disolución de tampón puede añadirse una sal de magnesio y/o de manganeso (preferiblemente cloruro o sulfato) de tal modo que se proporcione...
Reivindicaciones:
1. Una composición líquida concentrada y tamponada para amplificar ácidos nucleicos, que comprende al menos un dNTP, al menos una enzima requerida para la amplificación, al menos un cebador oligonucleotidico, al menos una sonda nucleotídica fluorescente y polivinilpirrolidona (PVP).
2. Una composición según la reivindicación 1, que comprende adicionalmente al menos un poliol. 5
3. Una composición según la reivindicación 2, en la que el poliol se selecciona de entre glicerol, sorbitol, inositol y pentaeritritol.
4. Una composición según una cualquiera de las reivindicaciones 1 a 3, que comprende adicionalmente una sal de magnesio o una sal de manganeso.
5. Una composición según cualquiera de las reivindicaciones 1 a 4, para amplificar ácidos nucleicos mediante 10 PCR, que comprende dATP, dCTP, dGTP, y uno de entre dTTP o dUTP, y también al menos una enzima requerida para la PCR, al menos dos cebadores oligonucleotídicos y al menos una sonda nucleotídica fluorescente.
6. Una composición según cualquiera de las reivindicaciones 1 a 4, para amplificar ácidos nucleicos mediante RT-PCR, que comprende dATP, dCTP, dGTP, y uno de entre dTTP o dUTP, y también al menos una enzima requerida para la RT-PCR, al menos dos cebadores oligonucleotídicos y al menos una sonda nucleotídica 15 fluorescente.
7. Una composición según la reivindicación 3, que comprende al menos 5 M de glicerol.
8. Una composición según la reivindicación 3, que comprende al menos 1 M de sorbitol.
9. Una composición según la reivindicación 3, que comprende al menos 500 mM de inositol.
10. Una composición según la reivindicación 3, que comprende al menos 250 mM de pentaeritritol. 20
11. Una composición según cualquiera de las reivindicaciones 1 a 10, en la que la PVP es PVP-10.
12. Una composición según la reivindicación 11, que comprende al menos 30 mM de PVP-10.
13. Un procedimiento para preparar una mezcla de reacción completa para amplificar ácidos nucleicos, que comprende:
(i) diluir una composición concentrada según cualquiera de las reivindicaciones 1 a 12, en una 25 disolución salina tamponada adecuada para amplificar ácidos nucleicos;
(ii) poner en contacto una muestra de ácidos nucleicos que se va a amplificar con el volumen deseado de la composición diluida en la etapa (i).
14. Un procedimiento para preparar una mezcla de reacción completa para amplificar ácidos nucleicos, que comprende: 30
(i) mezclar una muestra de ácidos nucleicos que se va a amplificar en una disolución salina tamponada adecuada para amplificar ácidos nucleicos;
(ii) añadir la mezcla obtenida en la etapa (i) a un volumen deseado de la composición concentrada según cualquiera de las reivindicaciones 1 a 12.
15. Un procedimiento para amplificar ácidos nucleicos, que comprende las etapas (i) y (ii) según se define en la 35 reivindicación 13 ó 14, y (iii) el comienzo de la reacción para amplificar los ácidos nucleicos presentes en la muestra, cuya amplificación es detectable mediante el marcaje fluorescente portado por la sonda.
16. Un procedimiento de amplificación según la reivindicación 15, que es una RT-PCR en tiempo real.
17. Un procedimiento de amplificación según la reivindicación 15, que es una PCR en tiempo real.
18. Un kit para amplificar y/o detectar ácidos nucleicos, que comprende al menos un recipiente que contiene la 40 composición concentrada según se define en cualquiera de las reivindicaciones 1 a 12.
19. Un kit para amplificar y/o detectar ácidos nucleicos según la reivindicación 18, que comprende un primer recipiente que contiene la composición concentrada según se define en cualquiera de las reivindicaciones 1 a 12, y
que comprende adicionalmente un segundo recipiente que contiene una disolución salina tamponada adecuada para amplificar ácidos nucleicos.
20. Un kit según la reivindicación 19, en el que la disolución salina tamponada contiene al menos uno de los ingredientes elegidos de entre TRIS a una concentración de al menos 8 mM, una sal potásica o una sal sódica a una concentración de al menos 8 mM, una sal de amonio a una concentración de al menos 5 mM, y una sal de magnesio 5 o una sal de manganeso a una concentración de al menos 0,8 mM, usándose los ingredientes individualmente o como una mezcla.
21. El uso de polivinilpirrolidona (PVP), y opcionalmente de un poliol, para estabilizar tanto las enzimas como las sondas nucleotídicas fluorescentes en una composición líquida.
22. El uso según la reivindicación 21, en el que la PVP, y opcionalmente el poliol, también estabiliza(n) los 10 dNTPs.
23. El uso según la reivindicación 21 ó 22, en el que la composición líquida es una composición concentrada y tamponada para amplificar ácidos nucleicos, que comprende al menos un dNTP, al menos una enzima requerida para la amplificación, al menos un cebador oligonucleotidídico, y al menos una sonda nucleotídica fluorescente.
24. El uso según cualquiera de las reivindicaciones 21 a 23, en el que el poliol se elige de entre glicerol, 15 sorbitol, inositol y pentaeritritol.
25. El uso según cualquiera de las reivindicaciones 21 a 23, en el que la PVP es PVP-10.
Patentes similares o relacionadas:
PROCEDIMIENTO DE SÍNTESIS DE ÁCIDO NUCLEICO, del 7 de Diciembre de 2011, de EIKEN KAGAKU KABUSHIKI KAISHA: Un procedimiento para sintetizar ácido nucleico que está provisto en sus extremos 3' y 5' con una región que consta de una región nucleotídica […]
METODO PARA LA REPLICACIÓN, AMPLIFICACIÓN, O SECUENCIACIÓN DE UN ADN MOLDE, del 24 de Noviembre de 2011, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Método para la replicación, amplificación o secuenciación de un ADN molde.La presente invención se encuadra dentro del campo de la biotecnología. Específicamente, […]
 PROCEDIMIENTO PARA LA AMPLIFICACIÓN DE ÁCIDOS NUCLEICOS, del 20 de Mayo de 2011, de BRANDEIS UNIVERSITY: Procedimiento homogéneo de detección y amplificación mediante LATE-PCR no simétrica que reduce la dispersión entre ensayos repetidos que comprende: (i) realizar una reacción […]
PROCEDIMIENTO PARA LA AMPLIFICACIÓN DE ÁCIDOS NUCLEICOS, del 20 de Mayo de 2011, de BRANDEIS UNIVERSITY: Procedimiento homogéneo de detección y amplificación mediante LATE-PCR no simétrica que reduce la dispersión entre ensayos repetidos que comprende: (i) realizar una reacción […]
 ENSAYOS DE ÁCIDOS NUCLEICOS, del 17 de Enero de 2011, de BIOMERIEUX VITEK, INC.: LA PRESENTE INVENCION TRATA DE LA DETECCION DE SECUENCIAS DE ACIDOS NUCLEICOS ESPECIFICAS, UTILIZANDO O NO UN PROCEDIMIENTO DE AMPLIFICACION DE SECUENCIAS […]
ENSAYOS DE ÁCIDOS NUCLEICOS, del 17 de Enero de 2011, de BIOMERIEUX VITEK, INC.: LA PRESENTE INVENCION TRATA DE LA DETECCION DE SECUENCIAS DE ACIDOS NUCLEICOS ESPECIFICAS, UTILIZANDO O NO UN PROCEDIMIENTO DE AMPLIFICACION DE SECUENCIAS […]
 MOLDES MODIFICADOS MEDIANTE INGENIERIA GENETICA Y SU USO EN AMPLIFICACION DE CEBADOR UNICO, del 13 de Abril de 2010, de ALEXION PHARMACEUTICALS, INC.: Método para amplificar ácido nucleico, que comprende:
a) hibridar un cebador a un molde, presentando el cebador una primera porción que se hibrida al molde […]
MOLDES MODIFICADOS MEDIANTE INGENIERIA GENETICA Y SU USO EN AMPLIFICACION DE CEBADOR UNICO, del 13 de Abril de 2010, de ALEXION PHARMACEUTICALS, INC.: Método para amplificar ácido nucleico, que comprende:
a) hibridar un cebador a un molde, presentando el cebador una primera porción que se hibrida al molde […]
 PROCEDIMIENTO PARA LA AMPLIFICACION DE INFORMACION GENETICA POR MEDIO DE CEBADORES QUE SE UNEN EN VARIOS SITIOS EN EL GENOMA, del 26 de Febrero de 2010, de OLYMPUS LIFE SCIENCE RESEARCH EUROPA GMBH: Procedimiento para la determinación de la frecuencia relativa de unos conjuntos parciales delimitables de un material genético, siendo amplificado el material […]
PROCEDIMIENTO PARA LA AMPLIFICACION DE INFORMACION GENETICA POR MEDIO DE CEBADORES QUE SE UNEN EN VARIOS SITIOS EN EL GENOMA, del 26 de Febrero de 2010, de OLYMPUS LIFE SCIENCE RESEARCH EUROPA GMBH: Procedimiento para la determinación de la frecuencia relativa de unos conjuntos parciales delimitables de un material genético, siendo amplificado el material […]
SONDAS DE DOBLE HEBRA PARA LA DETECCION DE ACIDOS NUCLEICOS, MEDIANTE FLUORESCENCIA, del 5 de Noviembre de 2009, de BIO-RAD PASTEUR: Una sonda de doble hebra, pretendida para la detección de un ácido nucleico diana, de hebra individual, o de hebra doble, mediante fluorescencia, el cual […]
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]