ANTICUERPOS DIRIGIDOS A GPNMB Y SUS APLICACIONES.
Un anticuerpo humano aislado que se une específicamente a la proteína transmembrana posible GPNMB definida por SEQ ID NO:
289, en el que el anticuerpo comprende una CDR1 de cadena pesada definida por SEQ ID NO: 22, una CDR2 de cadena pesada definida por SEQ ID NO: 24, una CDR3 de cadena pesada definida por SEQ ID NO: 26, una CDR1 de cadena ligera definida por SEQ ID NO: 31, una CDR2 de cadena ligera definida por SEQ ID NO: 33 y una CDR3 de cadena ligera definida por SEQ ID NO: 35
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/043482.
Solicitante: Celldex Therapeutics, Inc.
Amgen Fremont Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 119 Fourth Avenue Needham, MA 02494 ESTADOS UNIDOS DE AMERICA.
Inventor/es: LIANG, MEINA, MEZES, PETER, RASTELLI,LUCA, JIA,XIAO-CHI, FOORD,ORIT, KLAKAMP,SCOTT, POLLACK,VINCENT,A, HERRMANN,JOHN, ARA,GULSHAN, KARKARIA,CYRUS, LICHENSTEN,HENRI, TORGOV,MICHAEL, XIAO,FENG, JEFFERS,MICHAEL,E, LAROCHELLE,WILLIAM,J, CHAPOVAL,ANDREI, DAVAGNINO,JUAN, TSE,KAM,FAI.
Fecha de Publicación: .
Fecha Solicitud PCT: 30 de Noviembre de 2005.
Fecha Concesión Europea: 11 de Agosto de 2010.
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K47/48
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07K16/30 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de células tumorales.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N1/21 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N15/13 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Inmunoglobulinas.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
- G01N33/577 G01N 33/00 […] › en los que interviene anticuerpos monoclonados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359426_T3.pdf

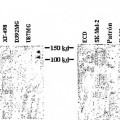
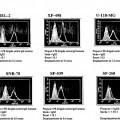
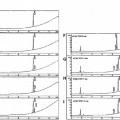
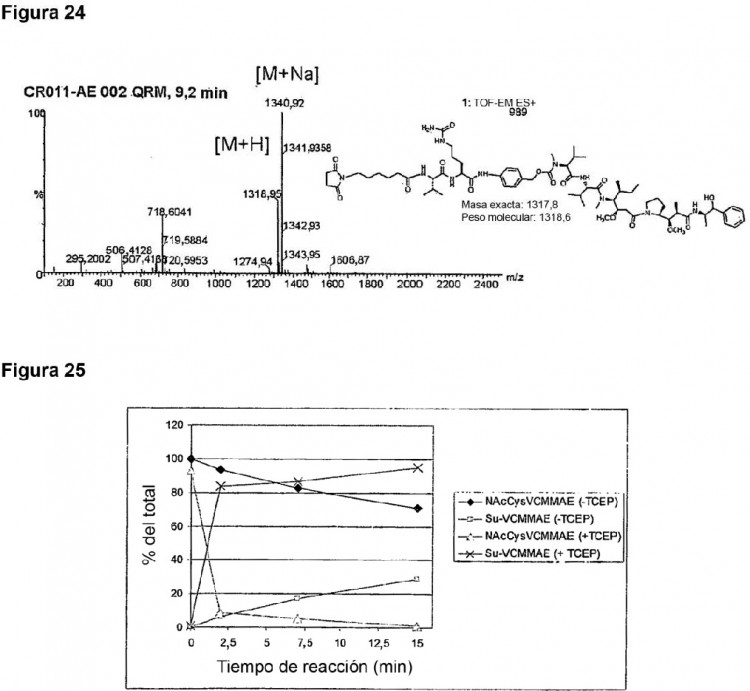
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a anticuerpos con especificidad por GPNMB y a usos de dichos anticuerpos. En particular, la presente invención proporciona anticuerpos monoclonales completamente humanos que se unen específicamente a GPNMB y usos de los mismos. Se proporcionan secuencias de nucleótidos que codifican, y secuencias de aminoácidos que comprenden, moléculas de inmunoglobulina de cadena pesada y ligera, particularmente secuencias correspondientes a secuencias de cadenas pesadas y ligeras contiguas que se extienden por las regiones marco y/o regiones determinantes de la complementariedad (CDR). La presente invención también proporciona inmunoconjugados que comprenden anticuerpos dirigidos contra GPNMB y procedimientos de uso de dichos inmunoconjugados. La presente invención proporciona además anticuerpos biespecíficos que comprenden un componente de anticuerpo dirigido contra GPNMB y un componente dirigido contra CD3, y procedimientos de uso de tales anticuerpos biespecíficos.
ANTECEDENTES DE LA INVENCIÓN
GPNMB
Se identificó una glicoproteína transmembrana posible llamada “nmb” (nº de registro X76534 EMBL), denominada en lo sucesivo en este documento GPNMB, y se describió por Weterman y col., (Int J Cancer 60:73-81, 1995) como diferencialmente expresada en líneas celulares de cáncer de melanoma humano de baja metástasis y xenoinjertos en comparación con una línea celular de melanoma más agresiva. GPNMB comparte el 33% de identidad con el precursor de la proteína específica de melanocitos pMe117 (Kwon y col., 1991, PNAS 88:9228-9232). GPNMB tiene el 71% de homología con una proteína transmembrana asociada a células dendríticas, DC-HIL (Shikano y col., 2001 Biol. Chem. 276:8125-8134). GPNMB también es conocida como la proteína neurocinina 1 inducible del factor de crecimiento hematopoyético HGFIN (Bandari y col., Reg. Peptides 111:169-178) y la osteoactivina de genes relacionados con los huesos (Owen y col. Crit Rev Eukaryot Gene Expr 2003, 13(2-4):205-220),
Se ha descrito un antisuero dirigido contra GPNMB de conejo y dos hibridomas murinos específicos para la proteína GPNMB (Kuan Chien-Tsun y col. (2003) Proc Am Assoc Cancer Res Annual Meeting 44:1116-1117).
También se informó que nmb podría reducir el potencial metastásico de una línea celular de melanoma negativa para nmb altamente metastásica (Weterman, 1995). GPNMB se consideró una candidata a marcador de tumores de glioblastoma tras la extracción e identificación de la expresión mediante el análisis de bases de datos públicas (Loging y col., 2000, Genome Research 10:1393-1402). Este gen se encontró sobreexpresado en tumores de pulmón (publicación de patente de EE.UU. nº US20030064947), además de cánceres de mama, rectal y de colon (publicación de patente de EE.UU. nº US2003100720). Los datos de NCBI SAGE también muestran la sobreexpresión de este gen en carcinoma de estómago y pancreático. Se ha mostrado que el ortólogo de ratón está muy regulado por exceso en una línea NSC de neurocitoblastos derivada del modelo de genes inactivados TSC2 para el síndrome de complejo de esclerosis tuberosa (publicación internacional nº WO 2003/080856).
Anticuerpos
Los anticuerpos, también conocidos como inmunoglobulinas, son normalmente proteínas glicosiladas tetraméricas compuestas por dos cadenas ligeras (L) (aproximadamente 25 kDa) y dos cadenas pesadas (H) (aproximadamente 50-70 kDa). La porción del extremo amino de cada cadena incluye un dominio variable de aproximadamente 100 a 110 o más aminoácidos principalmente responsables del reconocimiento de antígenos. La porción del extremo carboxi de la cadena L y H tiene uno y tres o cuatro dominios constantes, respectivamente, que son principalmente responsables de la función efectora. Hay dos tipos de cadenas L humanas clasificadas como kappa y lambda. Las cadenas H se clasifican como mu, delta, gamma, alfa o épsilon basándose en la secuencia de aminoácidos del dominio constante que define el isotipo del anticuerpo como IgM, IgD, IgG, IgA e IgE, respectivamente. Los isotipos pueden dividirse adicionalmente en subclases, por ejemplo, IgG1, IgG2, IgG3, IgG4.
Las inmunoglobulinas pueden producirse naturalmente in vivo por linfocitos B. Cada clon de células B produce un anticuerpo con un receptor de antígeno que tiene una estructura de unión a antígeno posible única. El repertorio de receptores de antígenos, aproximadamente 107 posibilidades, existe in vivo antes de la estimulación de antígenos. Esta diversidad se produce por recombinación somática, es decir, la unión de diferentes segmentos de genes de anticuerpos. La cadena H, la cadena L kappa y la cadena L lambda de la inmunoglobulina están codificadas por tres loci genéticos separados y cada locus tiene múltiples copias de al menos 3 tipos de segmentos de genes que codifican regiones variables (V), constantes (C) y de unión (J), los genes de la cadena pesada también incluyen una región de diversidad (D). La selección de regiones V, C y J específicas (y D para la cadena pesada) de entre los diversos segmentos de genes disponibles (45 V de cadena pesada; 35 V kappa; 23 D de cadena pesada; 6 J de cadena pesada; 5 J kappa) genera aproximadamente 1011 posibles especificidades de secuencias de la línea germinal presentadas en células B. La unión de las de regiones V, C y J puede producir la pérdida o adición de restos en las uniones. La región V de las cadenas L y H de anticuerpos humanos está constituida por regiones marco (FR) relativamente conservadas que forman un andamiaje para tres regiones hipervariables también conocidas como regiones determinantes de la complementariedad (CDR). Desde el extremo amino de tanto la cadena pesada como la ligera, el dominio V está compuesto por regiones FR y CDR en el siguiente orden: FR1-CDR1-FR2-CDR2-FR3. La unión del dominio V con un dominio D (sólo la cadena pesada) y J añade CDR3-FR4. Las CDR son generalmente responsables de la unión a antígeno.
**(Ver fórmula)**
La especificidad de los anticuerpos monoclonales ha hecho que sean agentes atractivos para elegir como diana cáncer in vivo con la esperanza de erradicar la enfermedad, a la vez que se ahorra tejido normal. La solución que inicialmente utilizó anticuerpos monoclonales de ratón ha encontrado limitaciones a la posible eficacia tales como inmunogenicidad; funciones efectoras ineficaces y semivida corta in vivo. Las tecnologías se desarrollaron para: anticuerpos quiméricos que buscan utilizar los dominios variables de unión a antígeno de anticuerpos monoclonales de ratón combinados con las regiones constantes de anticuerpos humanos (Boulianne y col. 1984 Nature 313:643-646; Morrison y col., 1984 PNAS USA 81:6851-6855); anticuerpos humanizados que injertaron regiones determinantes de la complementariedad (CDR) de unión a antígeno de anticuerpos de ratón en inmunoglobulina humana (Jones y col., 1986 Nature 321: 522-525; Riechmann y col., 1988 Nature 332:323-327; Verhoeyen y col., 1988 Science 239:1534-1536; Vaughan y col., 1998 Nature Biotechnol. 16:535-539); y bibliotecas de expresión en fago de fragmentos scFv o Fab monocatenarios de anticuerpos (de Haard y col., 1999 J Biol. Chem. 274: 18218-18230; Knappik y col., 2000 J. Mol. Biol. 296:57-86; Sheets y col., 1998 PNAS USA 95:6157-6162; Vaughan y col., 1994 Nature Biotechnol 14: 309-314, 1996; Griffiths y col. EMBO J. 13:3245-3260). Adicionalmente se han desarrollado animales transgénicos que tienen genes de inmunoglobulina humana y genes endógenos no funcionales para la inmunización y la producción de anticuerpos monoclonales completamente humanos (Fishwild y col., 1996 Nature Biotechnol 14:845-851; Mendez y col., 1997 Nature Genet. 15:146-156; Nicholson y col., 1999 J. Immunol 163, 6898-6906).
Anticuerpos monocatenarios: Los anticuerpos Fv monocatenarios (scFv) se describieron por primera vez a finales de los años 80 (Bird y col., Science 242:423-426 (1988); Huston y col., Proc. Natl. Acad. Sci. USA 85:5879-5883 (1988)). Se usa un enlazante de polipéptidos, que normalmente oscila en longitud de 5 a 27 restos de aminoácidos, para unir el extremo C del dominio variable de cadena ligera (VL) al extremo N del dominio variable de cadena pesada (VH). Alternativamente, el enlazante une el extremo C de VH al extremo N de VL. Ambas formas (VL-VH y VH-VL) se han usado satisfactoriamente en la bibliografía. El enlazante más común usado en la bibliografía es el enlazante de 15 aminoácidos (Gly4Ser)3, sin embargo hay varios otros enlazantes que se han utilizado que incluyen un enlazante de 25 aminoácidos llamado 205C (Pantoliano... [Seguir leyendo]
Reivindicaciones:
R E I V I N D I C AC I O N E S
1. Un anticuerpo humano aislado que se une específicamente a la proteína transmembrana posible GPNMB definida por SEQ ID NO: 289, en el que el anticuerpo comprende una CDR1 de cadena pesada definida por SEQ ID NO: 22, una CDR2 de cadena pesada definida por SEQ ID NO: 24, una CDR3 de cadena pesada definida por SEQ ID NO: 26, una CDR1 de cadena ligera definida por SEQ ID NO: 31, una CDR2 de cadena ligera definida por SEQ ID NO: 33 y una CDR3 de cadena ligera definida por SEQ ID NO: 35.
2. El anticuerpo de la reivindicación 1, en el que la región variable de la cadena pesada se define por SEQ ID NO:
20.
3. El anticuerpo de la reivindicación 1 o la reivindicación 2, en el que la región variable de la cadena ligera se define por SEQ ID NO: 29.
4. El anticuerpo de cualquier reivindicación previa en que el anticuerpo es un anticuerpo monoclonal.
5. El anticuerpo de cualquier reivindicación previa en que el anticuerpo se une específicamente a GPNMB con una constante de afinidad superior a 107 M-1.
6. El anticuerpo de cualquier reivindicación previa que comprende la región de la línea germinal VH4-3 1.
7. El anticuerpo de la reivindicación 7 que comprende además la región de la línea germinal L2.
8. El anticuerpo de cualquiera de las reivindicaciones 1 a 5 que comprende una región derivada de la región de la línea germinal VH4-31.
9. El anticuerpo de la reivindicación 8 que comprende además una región derivada de la región de la línea germinal L2.
10. El anticuerpo de cualquiera de las reivindicaciones 1-9, en el que dicho anticuerpo es un anticuerpo IgG1.
11. Un inmunoconjugado que comprende el anticuerpo de cualquiera de las reivindicaciones 1 a 4 y un agente citotóxico.
12. El inmunoconjugado de la reivindicación 11, en el que el agente citotóxico es auristatina E o dolastatina 10 o un derivado de las mismas.
13. Una composición farmacéutica que comprende el inmunoconjugado de la reivindicación 11.
14. Una composición farmacéutica que comprende el anticuerpo de la reivindicación 10, y un inmunomodulador.
15. Un ácido nucleico aislado que codifica el anticuerpo de cualquiera de las reivindicaciones 1 a 4.
16. Un vector de expresión que comprende el ácido nucleico de la reivindicación 15.
17. Una célula huésped que comprende el vector de la reivindicación 16.
18. La célula huésped de la reivindicación 17, en la que la célula huésped es una bacteria E. coli, una célula de ovario de hámster chino, una célula HeLa o una célula NSO.
19. El ácido nucleico de la reivindicación 15, en el que el ácido nucleico comprende una secuencia de nucleótidos de SEQ ID NO: 19.
20. Un anticuerpo Fv monocatenario que comprende un dominio VL de un anticuerpo monoclonal humano dirigido contra GPNMB de la reivindicación 1 o reivindicación 3 ligado a un dominio VH de dicho anticuerpo dirigido contra GPNMB.
21. El anticuerpo Fv monocatenario de la reivindicación 20 que comprende además un dominio VH de un anticuerpo dirigido contra CD3 ligado a un dominio VL de dicho anticuerpo dirigido contra CD3.
22. Un inmunoconjugado que comprende un anticuerpo Fv monocatenario de la reivindicación 20 y un agente citotóxico.
23. El anticuerpo Fv monocatenario de la reivindicación 20 ó 21 que comprende además un péptido señal o una marca Flag.
24. El anticuerpo Fv monocatenario de la reivindicación 20 que comprende la secuencia de aminoácidos de SEQ ID NO: 355.
25. El anticuerpo Fv monocatenario de la reivindicación 21 que comprende la secuencia de aminoácidos de SEQ ID NO: 357 o SEQ ID NO: 359.
26. El anticuerpo de la reivindicación 10, el inmunoconjugado de las reivindicaciones 11, 12 ó 22 o el anticuerpo Fv monocatenario de la reivindicación 20 para uso como medicamento.
27. El anticuerpo de la reivindicación 10, el inmunoconjugado de las reivindicaciones 11, 12 ó 22 o el anticuerpo Fv monocatenario de la reivindicación 20 para el tratamiento de melanoma o una neoplasia del sistema SNC.
28. El anticuerpo, inmunoconjugado o anticuerpo Fv monocatenario de la reivindicación 27, en el que dicha neoplasia del sistema SNC es astrocitoma, glioblastoma, meduloblastoma o meningitis neoplásica.
**(Ver fórmula)**
5 29. El anticuerpo, inmunoconjugado o anticuerpo Fv monocatenario de la reivindicación 26, en el que el medicamento es para el tratamiento de un paciente humano.
30. El inmunoconjugado de la reivindicación 26, en el que el medicamento se usa como una dosis unitaria entre 0,1 mg/kg y 10 mg/ kg, con 2 a 4 administraciones.
31. El inmunoconjugado de la reivindicación 30, en el que la dosis unitaria está entre 0,1 mg/kg y 2 mg/kg. 10 32. El inmunoconjugado de la reivindicación 31, en el que la dosis unitaria es aproximadamente 1 mg/kg.
Patentes similares o relacionadas:
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]