ACTIVADOR DEL RECEPTOR DE NF-KAPPA B, EL RECEPTOR ES MIEMBRO DE LA SUPERFAMILIA DEL RECEPTOR TNF.
RECEPTORES AISLADOS, ADNS QUE CODIFICAN ESTOS RECEPTORES Y COMPOSICIONES FARMACEUTICAS PREPARADAS A PARTIR DE ESTOS RECEPTORES.
SE PUEDEN UTILIZAR ESTOS RECEPTORES AISLADOS PARA REGULAR UNA REACCION INMUNE. ESTOS RECEPTORES SIRVEN TAMBIEN PARA BUSCAR SUS INHIBIDORES MEDIANTE CRIBADO
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US1997/023866.
Solicitante: IMMUNEX CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE AMGEN CENTER DRIVE THOUSAND OAKS, CA CALIFORNIA 91320-1799 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ANDERSON, DIRK, M., GALIBERT,LAURENT,J, MARASKOVSKY,EUGENE.
Fecha de Publicación: .
Fecha Solicitud PCT: 22 de Diciembre de 1997.
Clasificación PCT:
- C07K14/715 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › para citoquinas; para linfoquinas; para interferones.
- C07K16/28 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/11 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N15/12 C12N 15/00 […] › Genes que codifican proteínas animales.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
Clasificación antigua:
- C07K14/715 C07K 14/00 […] › para citoquinas; para linfoquinas; para interferones.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/11 C12N 15/00 […] › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N15/12 C12N 15/00 […] › Genes que codifican proteínas animales.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Mónaco, Irlanda, Finlandia.
PDF original: ES-2359297_T3.pdf
Fragmento de la descripción:
CAMPO TÉCNICO DE LA INVENCIÓN
La presente invención se refiere, en general, al campo de los receptores de citocinas y, más específicamente, a pares de receptor de citocinas/ligando que tienen actividad inmunorreguladora.
ANTECEDENTES DE LA INVENCIÓN
El funcionamiento eficaz del sistema inmune requiere un buen equilibrio entre la proliferación y diferenciación celular y la muerte celular, para asegurar que el sistema inmune es capaz de reaccionar con antígenos extraños pero no con autoantígenos. Son esenciales para el procedimiento de regulación de la respuesta inmune e inflamatoria diversos miembros de la superfamilia del Receptor del Factor de Necrosis Tumoral (TNF)/Receptor del Factor de Crecimiento Nervioso (Smith et al., Science 248: 1019; 1990). Esta familia de receptores incluye dos receptores de TNF diferentes (Tipo I y Tipo II; Smith et al., mencionado anteriormente; y Schall et al., Cell 61: 361, 1990), receptor del factor de crecimiento nervioso (Johnson et al., Cell 47:545, 1986), antígeno CD40 de células B (Stamenkovic et al., EMBO J. 8: 1403, 1989), CD27 (Camerini et al., J. Immunol. 147: 3165, 1991), CD30 (Durkop et al., Cell 68: 421, 1992), antígeno OX40 de células T (Mallett et al., EMBO J. 9: 1063, 1990), antígeno Fas humano (Itoh et al., Cell 66: 233, 1991), receptor 4-1BB murino (Kwon et al., Proc. Natl. Acad. Sci. USA 86: 1963, 1989) y un receptor denominado Receptor de Inducción de Apoptosis (AIR; documento USSN 08/720.864, presentado el 4 de octubre de 1996).
CD40 es un receptor presente en los linfocitos B, células epiteliales y algunas líneas celulares de carcinoma, que interacciona con un ligando que se encuentra en células T activadas, CD40L (documento USSN 08/249.189, presentado el 24 de mayo de 1994). La interacción de este par de ligando/receptor es esencial para la respuesta inmune tanto celular como humoral. La transducción de señales a través de CD40 está mediada por la asociación del dominio citoplásmico de esta molécula con miembros de los factores asociados al receptor de TNF (TRAFs; Baker y Reddy, Oncogene 12: 1, 1996). Recientemente se ha descubierto que ratones que son defectuosos en la expresión de TRAF3 debido a una alteración dirigida en el gen que codifica TRAF3, parecen normales en el nacimiento, pero desarrollan hipoglucemia progresiva y reducción de glóbulos blancos periféricos, y mueren aproximadamente a los diez días de edad (Xu et al., Immunity 5: 407, 1996). Las respuestas inmunes de ratones quiméricos reconstituidos con células de hígado fetal TRAF3-/- se parecen a las de los ratones deficientes en CD40, aunque las células B TRAF3-/- parecen ser funcionalmente normales.
El papel crítico de TRAF3 en la transducción de señales puede estar en su interacción con uno de los otros miembros de la superfamilia de receptores de TNF, por ejemplo, CD30 o CD27, que están presentes en células T. Como alternativa, puede haber otros miembros, aunque aún no identificados, de esta familia de receptores que interaccionan con TRAF3 y juegan un papel importante en el desarrollo postnatal así como en el desarrollo de un sistema inmune competente. La identificación de miembros adicionales de la superfamilia de receptores de TNF proporcionaría un medio adicional para regular la respuesta inmune e inflamatoria, y además podría proporcionar una perspectiva adicional del desarrollo postnatal en mamíferos.
DESCRIPCIÓN RESUMIDA DE LA INVENCION
La presente invención proporciona un nuevo receptor, denominado RANK (activador del receptor de NF-B, por sus siglas en inglés), que es un miembro de la superfamilia del receptor de TNF. RANK es una proteína transmembrana de Tipo I que tiene 616 restos aminoacídicos, que interacciona con TRAF3. La inducción de RANK por sobre-expresión, co-expresión de RANK y ligando de RANK unido a la membrana (RANKL), y por la adición de RANKL soluble o anticuerpos agonistas a RANK, tiene como resultado la regulación positiva del factor de transcripción NF-B, un factor de transcripción ubicuo que se utiliza mucho en células del sistema inmune.
Pueden prepararse formas solubles del receptor y usarse para interferir con la transducción de señales a través de RANK unido a la membrana, y por lo tanto la regulación positiva de NF-B; por consiguiente, también se proporcionan composiciones farmacéuticas que comprenden formas solubles del nuevo receptor. La inhibición de NF-B por antagonistas de RANK puede ser útil para mejorar los efectos negativos de una respuesta inflamatoria que resulta de la inducción de RANK, por ejemplo en el tratamiento del choque tóxico o septicemia, reacciones de injerto contra hospedador o reacciones inflamatorias agudas. Las formas solubles del receptor también serán útiles in vitro para seleccionar agonistas o antagonistas de la actividad de RANK.
El dominio citoplásmico de RANK será útil para desarrollar ensayos para inhibidores de la transducción de señales, por ejemplo, para seleccionar moléculas que inhiban la interacción de RANK con TRAF2 o TRAF3. También se describen formas delecionadas y proteínas de fusión que comprenden el nuevo receptor.
La presente invención también identifica una contraestructura, o ligando, para RANK, denominada RANKL. RANKL es una proteína transmembrana de Tipo 2 con un dominio intracelular de menos de aproximadamente 50 aminoácidos, un domino transmembrana y un domino extracelular de aproximadamente 240 a 250 aminoácidos. De forma similar a otros miembros de la familia del TNF a la que pertenece, RANKL tiene una región “espaciadora” entre el dominio transmembrana y el domino de unión al receptor que no es necesaria para la unión al receptor. Por consiguiente, las formas solubles de RANKL pueden comprender el domino extracelular entero o fragmentos del mismo que incluyen la región de unión al receptor.
Estos y otros aspectos de la presente invención se harán evidentes tras la referencia a la siguiente descripción detallada de la invención.
BREVE DESCRIPCIÓN DE LOS DIBUJOS
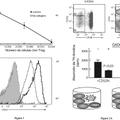
La Figura 1 demuestra la influencia de RANK.Fc y hRANKL sobre el crecimiento de células T activadas. Se cultivaron células T de sangre periférica humana como se describe en el Ejemplo 12; la recuperación de las células T viables se determinó por recuentos por triplicado con azul tripan.
La Figura 2 ilustra la capacidad de RANKL de inducir la formación de agrupamientos de DC humanas. Se generaron células dendríticas (DC) funcionalmente maduras in vitro a partir de progenitores de médula ósea (BM) CD34+ y se cultivaron como se describe en el Ejemplo 13. Se cultivaron DC CD1a+ en un cóctel de citocinas solo (Figura 2A), en cóctel más CD40L (Figura 2B), RANKL (Figura 2C) o RANKL inactivado con calor (H) (Figura 2D), y después se fotografiaron usando un microscopio de inversión.
La Figura 3 demuestra que RANKL potencia la capacidad alo-estimuladora de DC. Se incubaron células T alogénicas con números variables de DC irradiadas cultivadas como se describe en el Ejemplo 13. Los cultivos se sometieron a pulsos con [3H]-timidina y las células se recogieron en láminas de fibra de vidrio para el recuento. Los valores representan la media desviación típica (SD) de cultivos por triplicado.
La Figura 4 presenta un alineamiento de RANK humano con otros miembros de la familia del TNFR en la región de seudo-repeticiones ricas en cisteína extracelulares conservadas estructuralmente. Se indican los enlaces disulfuro previstos (DS1-DS3). RANK y CD40 contienen sustituciones de aminoácidos idénticas (C^H, C^G) que eliminan DS2 en la segunda seudo-repetición.
La Figura 5 representa un alineamiento de RANKL humano con otros miembros de la familia del TNF.
DESCRIPCIÓN DETALLADA DE LA INVENCIÓN
Se identificó un nuevo inserto de ADNc parcial con una fase de lectura abierta prevista que tenía alguna similitud con CD40 en una base de datos que contenía información de secuencia de ADNc generados a partir de células dendríticas (DC) derivadas de médula ósea humana. El inserto se usó para hibridar con manchas de transferencia de colonias generadas a partir de una biblioteca de ADNc de DC que contenía ADNc de longitud completa. Se realizaron varias hibridaciones de colonias y se aislaron dos clones (SEC ID Nº: 1 y 3). La SEC ID Nº: 5 muestra la secuencia de nucleótidos y de aminoácidos de una proteína de longitud completa prevista basándose en el alineamiento de las secuencias solapantes de las SEC ID Nº: 1 y 3.
RANK es un... [Seguir leyendo]
Reivindicaciones:
1. ADN aislado seleccionado del grupo que consiste en:
(a) un ADN que codifica una proteína que tiene una secuencia de aminoácidos como la expuesta en SEC ID Nº: 6, donde la proteína tiene un extremo amino seleccionado del grupo que consiste en un aminoácido entre el aminoácido 1 y el aminoácido 33, inclusive, de SEC ID Nº: 6, y un extremo carboxi seleccionado del grupo que consiste en un aminoácido entre el aminoácido 196 y el aminoácido 616, inclusive;
(b) moléculas de ADN capaces de hibridar con el ADN de (a) en condiciones rigurosas, que incluyen 63ºC, 6X SSC, durante toda la noche; lavado en 3X SSC a 55ºC, y que codifican un receptor activador biológicamente activo de NF-B; y
(c) moléculas de ADN que codifican fragmentos de proteínas codificadas por el ADN de (a) o (b), donde los fragmentos son biológicamente activos y la actividad biológica se selecciona del grupo que consiste en: unión a TRAF 1, 2, 3, 5 ó 6, unión específica a un receptor soluble activador del ligando de NF-B o a un receptor activador de un ligando de NF-B expresado en células o inmovilizado en una superficie, y unión a un receptor activador de anticuerpos específicos para NF-B.
2. ADN aislado de la reivindicación 1, que codifica un receptor activador del polipéptido NF-B que es al menos un 80% idéntico en la secuencia de aminoácidos a un polipéptido de SEC ID Nº: 6 y que tiene una actividad mostrada por dicho polipéptido.
3. ADN aislado de la reivindicación 1 ó 2, en el que la actividad biológica se selecciona del grupo que consiste en: unión a TRAF 1, 2, 3, 5 ó 6, unión específica a un receptor soluble activador de un ligando de NF-B o a un receptor activador de un ligando de NF-B expresado en células o inmovilizado en una superficie, y unión a un receptor activador de anticuerpos específicos para NF-B.
4. ADN aislado de la reivindicación 1 o la reivindicación 2, que codifica un receptor soluble activador de un polipéptido NF-B.
5. ADN aislado de la reivindicación 4, que comprende además un ADN que codifica un polipéptido seleccionado del grupo que consiste en un dominio Fc de inmunoglobulina, una muteína de Fc de inmunoglobulina, un marcador FLAG, un péptido que comprende al menos aproximadamente 6 residuos de His, una cremallera de leucinas y combinaciones de los mismos.
6. Vector de expresión recombinante que comprende una secuencia de ADN de acuerdo con cualquiera de las reivindicaciones 1 a 5.
7. Célula hospedadora transformada o transfectada con un vector de expresión de acuerdo con la reivindicación
6.
8. Procedimiento para preparar un receptor activador de la proteína NF-B, que comprende cultivar una célula hospedadora de acuerdo con la reivindicación 7 en condiciones que promueven la expresión y recuperación del receptor activo activador de NF-B.
9. Fragmento de ADN aislado seleccionado del grupo que consiste en oligonucleótidos de al menos aproximadamente 17 nucleótidos de longitud, oligonucleótidos de al menos aproximadamente 25 nucleótidos de longitud y oligonucleótidos de al menos aproximadamente 30 nucleótidos de longitud, donde el fragmento es un fragmento de los residuos nucleotídicos 39-1886 de SEC ID Nº: 5.
10. Receptor activador del polipéptido NF-B aislado seleccionado del grupo que consiste en:
(a) un polipéptido que comprende una secuencia de aminoácidos de los aminoácidos 33 a 196 de SEC ID Nº: 6;
(b) un polipéptido que comprende una secuencia de aminoácidos de los aminoácidos 1 a 213 de SEC ID Nº: 6;
(c) un polipéptido que comprende una secuencia de aminoácidos de los aminoácidos 234 a 616 de SEC ID Nº: 6;
(d) un receptor activador de polipéptido NF-B codificado por un ADN capaz de hibridar con un ADN que codifica la proteína de (a) a (c) en condiciones rigurosas (63ºC, 6X SSC, durante toda la noche; lavado en 3X SSC a 55ºC) y que es biológicamente activo;
(e) fragmentos de los polipéptidos de (a) a (d) que son biológicamente activos y la actividad biológica se selecciona del grupo que consiste en: inducción de la actividad de NF-B, unión a TRAF 1, 2, 3, 5 ó 6, unión específica a un receptor soluble activador de un ligando de NF-B o a un receptor activador de un ligando de NF-B expresado en
células o inmovilizado como una superficie y unión a un receptor activador de anticuerpos específicos de NF-B.
11. Receptor activador del polipéptido NF-B aislado de la reivindicación 10, en el que la actividad biológica se selecciona del grupo que consiste en: inducción de la actividad de NF-B, unión a TRAF 1, 2, 3, 5 ó 6, unión específica a un receptor soluble activador de un ligando de NF-B o a un receptor activador de un ligando de NF-B expresado en células o inmovilizado como una superficie y unión a un receptor activador de anticuerpos específicos de NF-B.
12. Proteína de acuerdo con la reivindicación 10 u 11, que tiene una secuencia de aminoácidos con una identidad de al menos aproximadamente un 70%, una identidad de al menos aproximadamente un 80% o una identidad de al menos aproximadamente un 90% con SEC ID Nº: 6.
13. Proteína de acuerdo con cualquiera de las reivindicaciones 10 a 12, que es un receptor soluble activador de NF-B.
14. Receptor soluble activador de la proteína NF-B de acuerdo con la reivindicación 13, que comprende además un péptido seleccionado del grupo que consiste en un dominio Fc de inmunoglobulina, una muteína de Fc de inmunoglobulina, un marcador FLAG, un péptido que comprende al menos aproximadamente 6 residuos de His, una cremallera de leucinas y combinaciones de los mismos.
15. Receptor soluble activador de la proteína NF-B de acuerdo con la reivindicación 14, que comprende la parte Fc de la IgG1 humana que consiste en los aminoácidos 3 a 232 de SEC ID Nº: 8.
16. Anticuerpo inmunorreactivo con un receptor activador del polipéptido NF-B de acuerdo con cualquiera de las reivindicaciones 10 a 13.
17. Anticuerpo de acuerdo con la reivindicación 16, que es un anticuerpo monoclonal.
18. Anticuerpo de acuerdo con la reivindicación 16 o la reivindicación 17, donde dicho anticuerpo se une a un polipéptido que consiste en la secuencia de aminoácidos de SEC ID Nº: 6.
19. Composición que comprende un receptor purificado activador de NF-B codificado por un ADN de cualquiera de las reivindicaciones 1 a 5 y un portador, excipiente o diluyente fisiológicamente aceptable.
20. Composición que comprende un anticuerpo antagonista de acuerdo con la reivindicación 16, reivindicación 17
o reivindicación 18 y un portador, excipiente o diluyente fisiológicamente aceptable.
21. Receptor activador del polipéptido NF-B según se define en cualquiera de las reivindicaciones 10-15, o codificado por un ADN según se define en cualquiera de las reivindicaciones 1-5 o una composición según se define en la reivindicación 18 o la reivindicación 19, para su uso en medicina.
22. Receptor soluble activador del polipéptido NF-B según se define en cualquiera de las reivindicaciones 10-15,
o codificado por un ADN según se define en cualquiera de las reivindicaciones 1-5, para su uso en la inhibición de la activación de NF-B.
23. Receptor soluble activador del polipéptido NF-B según se define en cualquiera de las reivindicaciones 10-15,
o codificado por un ADN según se define en cualquiera de las reivindicaciones 1-5, para su uso en el tratamiento de una afección en la que la señalización a través de un receptor activador de NF-B ha dado lugar a consecuencias negativas, tales como choque tóxico o séptico o un rechazo de un injerto contra hospedador.
24. Receptor soluble activador del polipéptido NF-B según se define en cualquiera de las reivindicaciones 10-15,
o codificado por un ADN según se define en cualquiera de las reivindicaciones 1-5, para su uso en el tratamiento de una enfermedad caracterizada por células neoplásicas que expresan un receptor activador de NF-B.
25. Receptor soluble activador del polipéptido NF-B según se define en cualquiera de las reivindicaciones 10-15,
o codificado por un ADN según se define en cualquiera de las reivindicaciones 1-5, para su uso en la regulación de una respuesta inmune o inflamatoria.
26. Uso de un receptor soluble activador de NF-B de acuerdo con cualquiera de las reivindicaciones 13-15, o codificado por un ADN según se define en cualquiera de las reivindicaciones 1-5, o de un receptor activador de anticuerpos monoclonales antagonistas de NF-B en la preparación de un medicamento para inhibir la activación de NFB.
27. Uso de un receptor soluble activador de NF-B de acuerdo con cualquiera de las reivindicaciones 13-15, o codificado por un ADN según se define en cualquiera de las reivindicaciones 1-5, o de un receptor activador de anticuerpos monoclonales antagonistas de NF-B en la preparación de un medicamento para el tratamiento de una afección en la que la señalización a través del receptor activador de NF-B ha dado lugar a consecuencias negativas, tales como choque tóxico o séptico o rechazo de injerto contra hospedador.
28. Uso de un receptor soluble activador de NF-B de acuerdo con cualquiera de las reivindicaciones 13-15, o codificado por un ADN según se define en cualquiera de las reivindicaciones 1-5, o de un receptor activador de anticuerpos monoclonales antagonistas de NF-B en la preparación de un medicamento para el tratamiento de una enfermedad caracterizada por células neoplásicas que expresan el receptor activador de NF-B.
29. Uso de un receptor soluble activador de NF-B de acuerdo con cualquiera de las reivindicaciones 13-15, o codificado por un ADN de acuerdo con cualquiera de las reivindicaciones 1-5, o de un receptor activador de anticuerpos monoclonales antagonistas de NF-B en la preparación de un medicamento para interferir en el papel de NF-B en la transformación celular.
30. Uso de un receptor soluble activador de una composición polipeptídica de NF-B, donde el receptor activador de NF-B está codificado por un ADN según se define en cualquiera de las reivindicaciones 1-5, o de un receptor activador de anticuerpos monoclonales antagonistas de NF-B, en la preparación de un medicamento para regular una respuesta inmune o inflamatoria.
31. Uso de un receptor soluble activador del polipéptido NF-B de acuerdo con cualquiera de las reivindicaciones 13 a 15, para cribar un inhibidor de un receptor activador de actividad de NF-B inducida por NF-B.
32. Uso de una forma soluble de un receptor activador del polipéptido NF-B, codificado por un ADN de acuerdo con cualquiera de las reivindicaciones 1 a 5, derivado del dominio extracelular, en un ensayo de cribado para detectar moléculas capaces de unirse a un receptor activador de NF-B.
33. Uso de un receptor activador del polipéptido NF-B, codificado por un ADN de acuerdo con cualquiera de las reivindicaciones 1 a 5, derivado del dominio citoplásmico, en un ensayo para detectar la inhibición de la interacción del receptor activador de NF-B y otras proteínas intracelulares implicadas en la transducción de señales.
34. Uso de acuerdo con la reivindicación 33, en el que el ensayo sirve para detectar la inhibición de la asociación del receptor activador de NF-B y TRAF 1, 2, 3, 5 ó 6.
35. Uso de un receptor activador de la secuencia polipeptídica de NF-B, codificado por un ADN de acuerdo con cualquiera de las reivindicaciones 1 a 5, en el diseño basado en la estructura de un receptor activador de un inhibidor de NF-B.
36. Uso de un receptor activador del polipéptido NF-B, codificado por un ADN de acuerdo con cualquiera de las reivindicaciones 1 a 5, para averiguar la capacidad de moléculas de antagonizar o agonizar el receptor activador de NFB.
37. Uso de un receptor activador del polipéptido NF-B, codificado por un ADN de acuerdo con cualquiera de las reivindicaciones 1 a 5, en el desarrollo de anticuerpos agonistas o antagonistas del receptor activador de NF-B.
38. Uso de un receptor activador del polipéptido NF-B, codificado por un ADN de acuerdo con cualquiera de las reivindicaciones 1 a 5, en un cribado de antagonistas del receptor activador de la actividad de NF-B.
39. Kit para detectar un receptor soluble activador del polipéptido NF-B o para detectar un receptor soluble activador de un ligando de NF-B o para el seguimiento de un receptor activador de la actividad mediada por NF-B en muestras de pacientes, comprendiendo dicho kit un receptor soluble activador de NF-B de acuerdo con cualquiera de las reivindicaciones 13-15, donde dicha detección o seguimiento emplea un ensayo seleccionado del grupo que consiste en ELISA, ensayo de transferencia puntual, ensayo de unión en fase sólida (tales como los que usan un biosensor), un ensayo de formato rápido y un bioensayo.
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
 Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Péptido de miticina y su uso en regeneración celular, del 28 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Péptido de miticina y su uso en regeneración celular. La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente […]
Moléculas de unión de alta avidez que reconocen MAGE-A1, del 8 de Abril de 2020, de Max Delbrück Centrum für Molekulare Medizin (MDC) Berlin-Buch: Una construcción de reconocimiento de antígenos que es un receptor de células T (TCR), que comprende (i) una región variable de la cadena alfa […]
Moléculas de unión a ligando y usos de las mismas, del 25 de Diciembre de 2019, de Vegenics Pty Limited: Una molécula de unión a ligando que comprende un polipéptido de unión a ligando fusionado a un fragmento de dominio constante de inmunoglobulina, comprendiendo […]
Tratamiento de las enfermedades relacionadas con la apolipoproteína a1 por inhibición del transcrito antisentido natural a la apolipoproteína a1, del 17 de Octubre de 2019, de CuRNA, Inc: Un oligonucleótido que se dirige a un transcrito antisentido natural de apolipoproteína A1 para su uso como un compuesto terapéutico, donde el oligonucleótido […]