PROTEINA TWEAK SOLUBLE COMO MARCADOR TEMPRANO DE ENFERMEDAD CARDIOVASCULAR.
Proteína TWEAK soluble como marcador temprano de enfermedad cardiovascular.
Se refiere al uso del TWEAK soluble (sTWEAK) como biomarcador temprano de una enfermedad cardiovascular y/o para pronosticar la evolución de un trastorno o evento cardiovascular y/o para evaluar la eficacia de un tratamiento reductor de trastorno o evento cardiovascular, así como a un método para la cuantificación del sTWEAK y a un kit capaz de llevar a cabo dicho método
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200702199.
Solicitante: UNIVERSIDAD AUTONOMA DE MADRID.
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: BLANCO COLIO,LUIS MIGUEL, EGIDO DE LOS RIOS,JESUS.
Fecha de Solicitud: 3 de Agosto de 2007.
Fecha de Publicación: .
Fecha de Concesión: 23 de Febrero de 2010.
Clasificación Internacional de Patentes:
- G01N33/68D
Clasificación PCT:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Fragmento de la descripción:
Proteína TWEAK soluble como marcador temprano de enfermedad cardiovascular.
La presente invención pertenece al campo de la biomedicina y se refiere al uso del TWEAK soluble (sTWEAK) como biomarcador temprano de una enfermedad cardiovascular y/o para pronosticar la evolución de un trastorno o evento cardiovascular y/o para evaluar la eficacia de un tratamiento reductor de trastorno o evento cardiovascular, así como a un método para la cuantificación del sTWEAK y a un kit capaz de llevar a cabo dicho método.
Antecedentes de la invención
Las enfermedades cardiovasculares tienen una gran relevancia en los países occidentales ya que además de ser la causa principal de mortalidad, originan un alto grado de discapacidad y una gran repercusión socioeconómica, por lo que su prevención es un área de gran importancia para la salud pública. El término enfermedad cardiovascular designa enfermedades cardíacas y de los vasos sanguíneos incluyendo arteriosclerosis, enfermedades coronarias, enfermedad vascular periférica, e hipertensión arterial, entre otros.
Algunos trastornos cardiovasculares como infarto de miocardio o isquemia están asociados con la arteriosclerosis. En el proceso de aterogénesis, el acúmulo de lípidos en la pared vascular, secundario a la disfunción endotelial, actúa como un estímulo desencadenante de una reacción que llevará a la formación de una cápsula fibrosa que envolverá a un núcleo lipídico central. Las placas pueden complicarse con la formación de un trombo que, si ocluye total ó parcialmente el vaso, dará lugar a un síndrome coronario agudo: angina inestable, infarto agudo de miocardio ó muerte súbita.
Es importante destacar que aunque se han hecho grandes avances en el conocimiento de los mecanismos involucrados en este proceso, no se está utilizado en la actualidad ningún marcador sanguíneo en el diagnóstico de esta enfermedad o capaz de predecir futuros eventos cardiovasculares.
La superfamilia del factor de necrosis tumoral (TNFSF), que consta de 19 miembros, comprende proteínas transmembrana de tipo I y II las cuales están implicadas en la regulación de diferentes respuestas celulares. Esta familia de proteínas esta compuesta de ligandos y receptores los cuales, mediante interacción directa entre el ligando y el receptor/es, dan lugar a múltiples respuestas biológicas. A la vez que regula funciones normales, como la respuesta inmunitaria, la hematopoiesis y la morfogénesis, también se han implicado estos ligandos en una amplia variedad de patologías, incluyendo la tumorogénesis, rechazo de transplantes, shock séptico, replicación viral y reabsorción ósea. Determinados ligandos del TNFSF ejercen sus efectos mediante la activación del factor de trascripción nuclear NF-kB. Los miembros de la familia NF-kB, las cuales presentan las proteínas p50, p52, p65 (Rel A), c-Rel y Rel B, pueden formar horno- y heterodímeros. Los dímeros NF-kB de las células en reposo se encuentran en el citoplasma en estado inactivo unidos a la proteína inhibidora conocida como IkappaB (IkB). Diversas cascadas de señales intracelulares median en la estimulación de la ruta de activación de NF-kB. Estas señales activan el complejo IkB quinasa (IKK) por fosforilación de sus sub-unidades IKKa y/o IKKß. El complejo activo IKK produce entonces la fosforilación de las proteínas IkB en residuos de serina, dando como resultado su ubiquitinación y posterior degradación por el proteasoma. Esto da como resultado la activación de NF-kB, que se trasloca al núcleo y se une a regiones específicas de los promotores de los genes que se encuentran bajo su control, iniciando así la transcripción. Además de NF-kB, los ligandos TNFSF también activan la quinasa c-Jun N-terminal e inducen la proliferación y apoptosis en numerosos tipos de células.
El inductor débil de apoptosis parecido al TNF (Tumor Necrosis Factor-like Inducer of Apoptosis; TWEAK) o TNFSF12 es un miembro del TNFSF que actúa sobre células sensibles uniéndose a un pequeño receptor en la superficie de las células conocido como receptor 14 inducible por el factor de crecimiento fibroblasto (Fn14) o receptor TWEAK (TWEAKR). TWEAK se expresa principalmente como una proteína transmembrana de 249 aminoácidos (aa) tipo II. Sin embargo, al igual que la mayoría del resto de miembros de TNFSF, TWEAK se procesa proteolíticamente para dar lugar a su forma soluble de 156 aa, la cual es biológicamente activa. Se ha demostrado que TWEAK soluble recombinante induce numerosas respuestas biológicas, como crecimiento y proliferación de células, angiogénesis, y estimulación de apoptosis bajo algunas condiciones experimentales. Recientemente, se ha observado mediante la generación de ratones knockout para TWEAK que, en contraste con TNF-a, TWEAK atenúa la transición de inmunidad innata a adaptativa. Además, TWEAK también parece estar implicado en respuestas pro-inflamatorias. Se ha demostrado que TWEAK activa el camino de señalización NF-kB e induce la expresión de varias citoquinas pro-inflamatorias reguladas por NF-kB y moléculas de adhesión celular en algunos tipos de células. Aunque el TWEAK y el receptor Fn14 se encuentran presentes en diferentes de tejidos, incluyendo músculos cardíacos y esqueléticos, las funciones fisiológicas del TWEAK siguen siendo, en su mayor parte, desconocidas.
La identificación temprana de pacientes con riesgo de desarrollar un trastorno o evento cardiovascular sería de gran importancia ya que disminuiría la mortalidad y morbilidad asociada a esta enfermedad y permitiría un tratamiento más precoz y apropiado. La existencia en los servicios hospitalarios de tests específicos para el estudio de riesgo de trastorno o evento cardiovascular, podría ser de gran ayuda para la prevención y posible profilaxis de dicha enfermedad.
La presente invención proporciona un método in vitro de diagnóstico temprano y/o pronóstico para identificar un perfil de riesgo de enfermedad cardiovascular de manera rápida, sencilla y eficaz. Esta invención es útil para identificar individuos con riesgo de sufrir un trastorno cardiovascular y útil para evaluar la eficacia de los tratamientos con fármacos que reducen el riesgo de trastorno cardiovascular.
Descripción de la invención
La presente invención se enfrenta al problema de proporcionar marcadores tempranos de enfermedades cardiovasculares, tales como, pero sin limitarnos a la enfermedad cardiovascular periférica.
Hasta el momento, a la forma soluble de la proteína TWEAK se la había identificado como un biomarcador de enfermedad cardiovascular, más concretamente como un biomarcador de aterosclerosis carotidea subclínica. Dicho uso como biomarcador de la proteína TWEAK se debe a que ésta es regulada a la baja (downregulated) durante la respuesta proinflamatoria. De hecho, esto concuerda con datos ya publicados donde se recoge la existencia de menores concentraciones de la proteína en los casos de lesiones ateroscleróticas. Es decir, la forma soluble de la proteína TWEAK se encuentra en menor cantidad en el plasma en sujetos con aterosclerosis carotídea que en sujetos sanos (12) (Blanco-Colio et al. ATVB 2007;27:916-922). Estando, por tanto, la concentración plasmática de TWEAK soluble asociada negativamente con el espesor de la capa íntima-media de la carotida en sujetos asintomáticos. Esta lesión se considera hoy en día como un marcador radiológico subrogado (secundario) de enfermedad cardio- vascular.
De los anteriores resultados cabe esperar que los sujetos con mayor severidad presenten una mayor disminución en los niveles circulantes de sTWEAK y lo contrario ocurra con los individuos que presenten una menor severidad de la enfermedad.
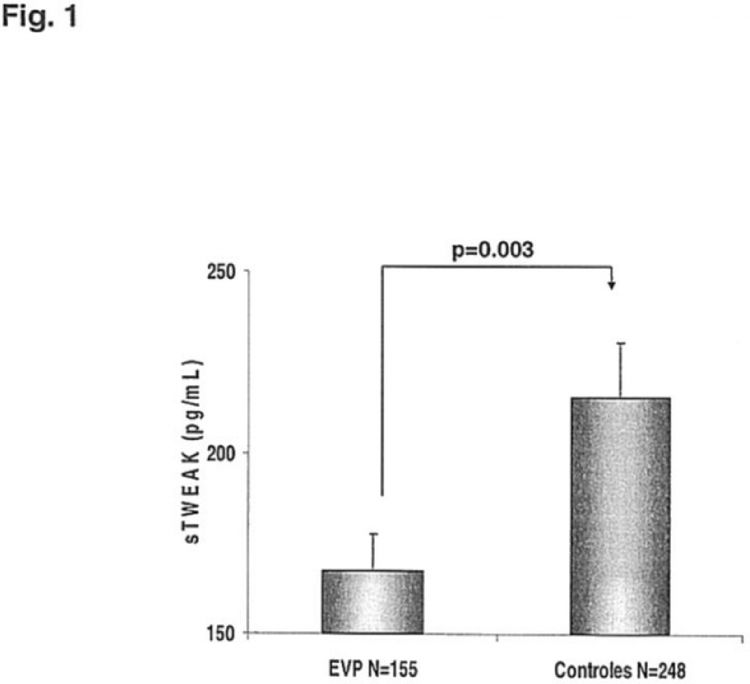
Para llevar a cabo la presente invención, se ha analizado la concentración plasmática de sTWEAK en sujetos con enfermedad vascular periférica (EVP) sintomática (N=155) y se ha comparado con la de sujetos controles (N=248) sin EVP o sin historia de enfermedad cardiovascular. En este trabajo se ha observado que la concentración plasmática de sTWEAK se encuentra disminuida en sujetos con EVP en relación a la que presentan sujetos sanos pareados por edad. Estos resultados indican que sTWEAK puede ser considerado como un nuevo marcador potencial también de EVP. Demostrando la utilidad de esta proteína como biomarcador potencial en múltiples enfermedades cardiovasculares tales como, pero sin limitarnos a,la enfermedad vascular periférica o la arteriosclerosis.
Adicionalmente los inventores de la presente invención analizaron si la concentración plasmática de sTWEAK se relaciona con la severidad de EVP que...
Reivindicaciones:
1. Uso in vitro de la proteína TWEAK soluble como biomarcador para el diagnóstico o pronóstico temprano de enfermedad cardiovascular.
2. Uso de acuerdo con la reivindicación 1, donde la enfermedad cardiovascular es arteriosclerosis.
3. Uso de acuerdo con la reivindicación 1, donde la enfermedad cardiovascular es la enfermedad vascular periférica.
4. Uso de acuerdo con la reivindicación 3, donde sTWEAK se utiliza para diferenciar los estadios I-III de la enfermedad vascular periférica.
5. Kit de diagnóstico in vitro para identificar un perfil diagnóstico o pronóstico temprano de enfermedad cardiovascular caracterizado porque contiene los reactivos necesarios para llevar a cabo la detección de la proteína TWEAK en una muestra biológica.
6. Kit adecuado para la detección de sTWEAK in vitro en una muestra biológica de acuerdo con la reivindicación anterior, caracterizado porque comprende:
a) anticuerpos específicos frente a sTWEAK
b) Medios de detección del complejo del punto a).
7. Uso in vitro de la proteína sTWEAK para evaluar la eficacia de un tratamiento con agentes farmacológicos que disminuyen el riesgo de trastorno o evento cardiovascular.
8. Uso según la reivindicación 7, caracterizado porque el agente farmacológico se selecciona del grupo que comprende: anti-hipertensivo, anti-inflamatorio, antitrombótico, antiplaquetario, fibrinolítico, agentes reductores de lípidos, inhibidores directos de la trombina, inhibidores de la glicoproteína IIb/IIIa, bloqueantes de los canales de calcio, bloqueantes de los receptores alfa o beta adrenérgicos y inhibidores de la cicloxigenasa-2 o sistemas inhibidores de la angiotensina.
9. Uso según la reivindicación 7, caracterizado porque el trastorno o evento cardiovascular está asociado a la enfermedad aterosclerótica, y/o hipertensión y/o hiperlipidemia y/o enfermedad coronaria y/o enfermedad vascular periférica.
10. Uso del Kit de diagnóstico según cualquiera de las reivindicaciones 5-6 para evaluar la eficacia de un tratamiento para reducir el riesgo de trastorno cardiovascular.
Patentes similares o relacionadas:
SISTEMAS Y PROCEDIMIENTO PARA IDENTIFICAR RIESGO DE TRASPLANTE DE ÓRGANOS, del 17 de Enero de 2012, de RENOVAR, INC: Procedimiento de detección de marcadores de rechazo, que comprende la detección de la presencia de un ligando CXCR3, en donde dicho ligando CXCR3 […]
EXPRESIÓN DIFERENCIAL DE LA CITOCINA EN CÁNCER HUMANO, del 29 de Diciembre de 2011, de APOGENIX GMBH: Un método in vitro para diagnosticar un tipo de cáncer, que comprende las etapas: (a) proporcionar una muestra procedente de un tumor epitelial que comprende células tumorales, […]
PROTEÍNAS DE UNIÓN TRIMÉRICAS PARA CITOCINAS TRIMÉRICAS, del 8 de Noviembre de 2011, de ANAPHORE, INC: Un polipéptido trimérico que comprende tres monómeros, comprendiendo cada uno de dichos monómeros un miembro de unión específico que puede unirse […]
DETECCIÓN Y PREDICCIÓN DE PREECLAMPSIA, del 31 de Agosto de 2011, de PERKINELMER LAS, INC.: Método de predicción de preeclampsia (PE) que comprende determinar en una muestra materna obtenida de una paciente que se encuentra entre las 10 y 38 semanas de gestación, […]
PROCEDIMIENTOS PARA EL TRATAMIENTO DE ENFERMEDADES AUTOINMUNITARIAS EN UN SUJETO Y EN ENSAYOS DE DIAGNÓSTICO IN VITRO, del 16 de Agosto de 2011, de BAYLOR RESEARCH INSTITUTE: Uso de (a) al menos un antagonista de interferón que reduce la actividad de un interferón de tipo I, y (b) al menos un antagonista del ligando Flt3 (Flt3L) que reduce […]
PROCEDIMIENTO DE EVALUACIÓN DE LA EFICACIA ADCC MEDIADA POR EL CD16 DE ANTICUERPOS MONOCLONALES O POLICLONALES, del 8 de Julio de 2011, de LFB BIOTECHNOLOGIES: Procedimiento in vitro para evaluar la eficacia ADCC mediada por el CD16 de un anticuerpo monoclonal o policlonal, que comprende la puesta en […]
MARCADORES PARA ATEROSCLEROSIS, del 15 de Junio de 2011, de IMMUNOCLIN LTD: Método para el diagnóstico, prognosis o identificación de una predisposición hacia aterosclerosis y la susceptibilidad al desarrollo de placas ateroscleróticas […]
 ANTICUERPOS INJERTADOS CON CDR HUMANOS Y FRAGMENTOS DE ANTÍCUERPO DE LOS MISMOS, del 5 de Abril de 2011, de KYOWA HAKKO KIRIN CO., LTD.: Anticuerpo humano injertado con CDR que reacciona específicamente con una región extracelular del receptor 4 humano de la quimiocina CC (CCR4) pero no reacciona con una plaqueta […]
ANTICUERPOS INJERTADOS CON CDR HUMANOS Y FRAGMENTOS DE ANTÍCUERPO DE LOS MISMOS, del 5 de Abril de 2011, de KYOWA HAKKO KIRIN CO., LTD.: Anticuerpo humano injertado con CDR que reacciona específicamente con una región extracelular del receptor 4 humano de la quimiocina CC (CCR4) pero no reacciona con una plaqueta […]