PROCESO DE PREPARACION DE UN ANTAGONISTA DE LEUCOTRIENOS Y DE UN INTERMEDIO DEL MISMO.
Proceso de preparación de un antagonista de leucotrienos y de un intermedio del mismo.
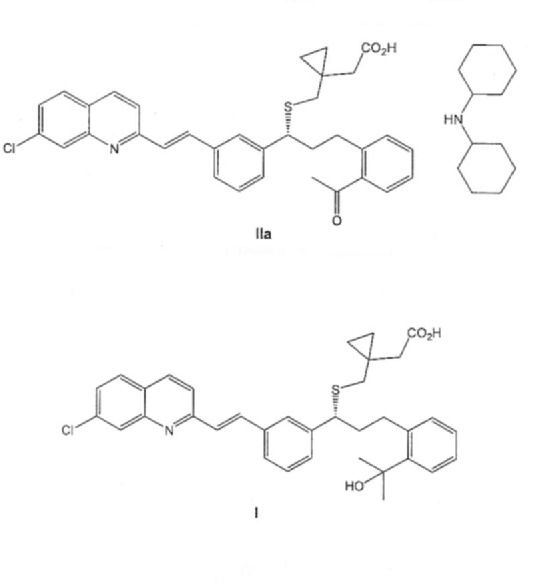
Sal de diciclohexilamina de fórmula IIa o un solvato farmacéuticamente aceptable de la misma, incluyendo un hidrato y su procedimiento de obtención. Procedimiento de preparación de Montelukast de fórmula I o una sal farmacéuticamente aceptable del mismo, o un solvato farmacéuticamente aceptable del mismo, incluyendo un hidrato, que comprende la transformación de una sal de fórmula IIa en su forma de ácido libre, seguida de reacción con un compuesto de fórmula III CH{sub,3}MgX, donde X representa halógeno, en el seno de un disolvente adecuado, opcionalmente en presencia de un ácido de Lewis
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200702220.
Solicitante: MOEHS IBERICA, S.L..
Nacionalidad solicitante: España.
Provincia: BARCELONA.
Inventor/es: CAMPS RAMIREZ DE CARTAGENA,HELENA, SANCHEZ CASALS,CARLES.
Fecha de Solicitud: 31 de Julio de 2007.
Fecha de Publicación: .
Fecha de Concesión: 1 de Febrero de 2010.
Clasificación Internacional de Patentes:
- C07D215/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 215/00 Compuestos heterocíclicos que contienen quinoleína o quinoleína hidrogenada en el sistema cíclico. › Atomos de halógeno o radicales nitro.
Clasificación PCT:
- C07D215/18 C07D 215/00 […] › Atomos de halógeno o radicales nitro.
Fragmento de la descripción:
Proceso de preparación de un antagonista de leucotrienos y de un intermedio del mismo.
La presente invención se refiere a un procedimiento para la preparación de Montelukast, así como a nuevos intermedios útiles para dicho procedimiento.
Estado de la técnica anterior
Montelukast es la Denominación Común Internacional (DCI) del ácido (R)-(E)-1-(((1-(3-(2-(7-cloro-2-quinolinil)etenil)fenil)-3-(2-(1-hidroxi-1-metiletil)fenil)propil)tio)metil)ciclopropanacético, número CAS 158966-92-8.
La sal monosódica de Montelukast (CAS No 151767-02-1) de fórmula Ia
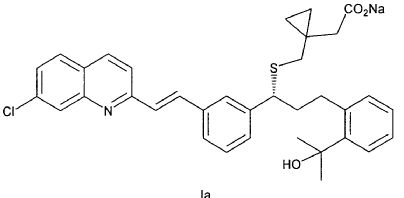
pertenece a un grupo de fármacos denominados antagonistas de leucotrienos. Se trata de un compuesto activo por vía oral que se une con una gran afinidad y selectividad al receptor CysLT1. Este fármaco se utiliza actualmente en el tratamiento de asma, inflamación, angina, espasmo cerebral, nefritis glomerular, hepatitis, endotoxemia, uveitis y rechazo de transplantes.
La preparación de la sal sódica de Montelukast aparece por primera vez en el ejemplo 161 de la solicitud europea EP 480717. Posteriormente se describió un procedimiento alternativo para la preparación de un intermedio de Montelukast en la solicitud EP 500360. Sin embargo, estos procedimientos no son particularmente adecuados para su uso a escala industrial, debido al uso de disolventes como diclorometano, reactivos como hidracina, y temperaturas por debajo de -40ºC. Además, dichos procedimientos requieren purificaciones cromatográficas tediosas de algunos intermedios y/o de los productos finales y los rendimientos del producto son bajos.
Entre las estrategias de preparación de Montelukast se han descrito también procedimientos que comprenden la formación de sales de amina de Montelukast, las cuales se transforman posteriormente en la sal sódica. Algunos de estos procedimientos, como los que se describen a continuación, comprenden la purificación de la sal de diciclohexilamina de Montelukast:
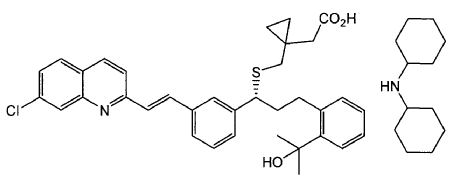
Así, por ejemplo, en la solicitud europea EP 737186 se describe un procedimiento de preparación de Montelukast sódico en forma cristalina a partir de la sal de diciclohexilamina. Este procedimiento es difícilmente aplicable a escala industrial ya que emplea una base altamente inflamable (n- butil litio) y temperaturas de reacción por debajo de -10ºC. Además, en la preparación de Montelukast se forma una impureza, producto de deshidratación del grupo terc-butanol, difícil de eliminar. Por otro lado, la purificación vía sal de diciclohexilamina es un proceso muy largo que comprende el sembrado de la solución de Montelukast y diciclohexilamina en tolueno o acetato de etilo, y posterior adición de heptano o hexano respectivamente.
En el documento WO 06/008751 se describe otro procedimiento de obtención de la sal sódica de Montelukast que comprende la transformación de Montelukast en la sal de diciclohexilamina del mismo. Sin embargo, este procedimiento también requiere el sembrado de la solución y se requiere un período de tiempo muy largo (más de un día) para que cristalice la sal de diciclohexilamina.
Por otro lado, la purificación mediante sales de diciclohexilamina se ha aplicado también a intermedios que posteriormente se transforman en Montelukast.
Así, los documentos WO 06/008751 y WO 07/004237 describen la preparación de Montelukast mediante la formación de una sal de dicilohexilamina del intermedio éster metílico de fórmula:

Sin embargo, estos procedimientos presentan los mismos inconvenientes que los descritos para la formación de sales de dicilohexilamina sobre Montelukat ácido.
Así pues, debido a la dificultad de purificar Montelukast y sus intermedios, resulta interesante disponer de procedimientos alternativos para la preparación de Montelukast, en particular si son de fácil industrialización.
Explicación de la invención
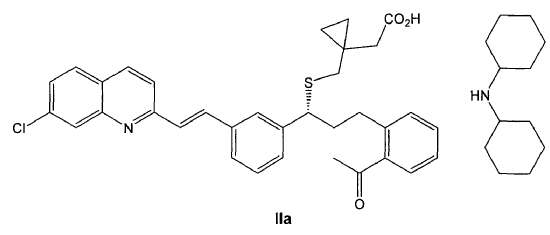
Los inventores han encontrado que la preparación de una sal de diciclohexilamina de fórmula IIa

permite la obtención de Montelukast, así como sus sales y solvatos, incluyendo hidratos, mediante un procedimiento fácilmente escalable, que supera los inconvenientes del estado de la técnica.
La sal de diciclohexilamina de fórmula IIa, como se puede ver en los ejemplos, es mucho más insoluble en disolventes polares que las sales conocidas de diciclohexilamina de Montelukast y del intermedio éster metílico. Debido a esa diferencia de solubilidad, esta sal presenta la ventaja de que cristaliza fácilmente en dichos disolventes polares, acortándose muy considerablemente los tiempos de formación de la sal. Asimismo, no es necesario sembrar la solución para iniciarse la cristalización, lo que, a la práctica, facilita la operatoria a escala industrial ya que se evita llevar a cabo operaciones que pueden resultar peligrosas debido a la inflamabilidad de este tipo de disolventes. Adicionalmente, el producto se obtiene con rendimiento alto y pureza elevada.
Otra ventaja de la utilización de la sal de fórmula IIa es que puede obtenerse mediante el uso de disolventes polares, sin necesidad de mezclas con disolventes apolares, lo que facilita el aislamiento del producto. Asimismo, el uso de un único disolvente para la cristalización facilita la recuperación y reutilización del mismo en un proceso industrial.
Además, si se desea purificar la sal de fórmula IIa ésta puede llevarse a cabo en el mismo disolvente en el que se ha realizado la cristalización.
Por tanto, un primer aspecto de la invención se refiere a un compuesto de fórmula IIa,
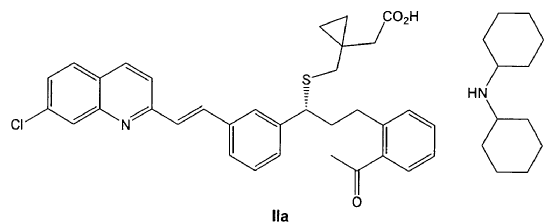
o un solvato farmacéuticamente aceptable del mismo, incluyendo un hidrato.
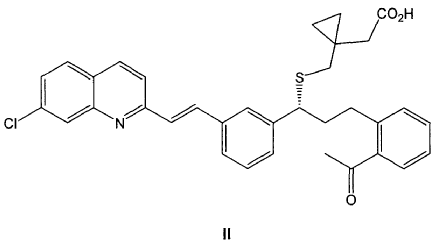
Otro aspecto de la invención se refiere a un procedimiento de preparación de un compuesto de fórmula IIa tal como se ha definido anteriormente, que comprende la reacción de un compuesto de fórmula II
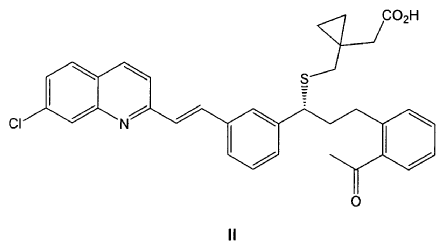
con diclohexilamina en presencia de un disolvente polar.
Otro aspecto de la invención se refiere a un procedimiento de preparación de un compuesto de fórmula I,
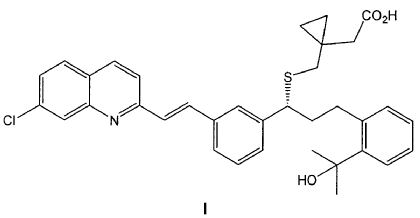
o una sal farmacéuticamente aceptable del mismo, o un solvato farmacéuticamente aceptable del mismo, incluyendo un hidrato; que comprende la transformación de un compuesto de fórmula IIa
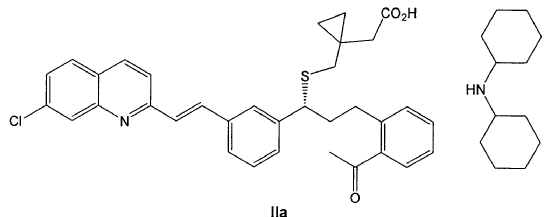
en un compuesto de fórmula II por tratamiento acuoso en medio ácido;

seguido de reacción con un compuesto de fórmula III CH3MgX, donde X representa halógeno, opcionalmente en presencia de un ácido de Lewis, en el seno de un disolvente adecuado; y posterior tratamiento acuoso en medio ácido para dar el compuesto de fórmula I; y, opcionalmente, el compuesto de fórmula I se convierte en una sal farmacéuticamente aceptable del mismo por tratamiento con la correspondiente base, o una sal del compuesto de fórmula I se convierte en otra sal del compuesto de fórmula I por intercambio de iones, o el compuesto de fórmula I se convierte en un solvato farmacéuticamente aceptable del mismo, incluyendo un hidrato, por cristalización/precipitación en el seno de un disolvente adecuado.
Montelukast (compuesto de fórmula I) y sus intermedios se pueden preparar mediante los procedimientos descritos a continuación. Las condiciones más adecuadas para llevar a cabo el procedimiento pueden variar dependiendo de diversos parámetros considerados por el experto en la materia, tal como, concentración...
Reivindicaciones:
1. Compuesto de fórmula IIa,
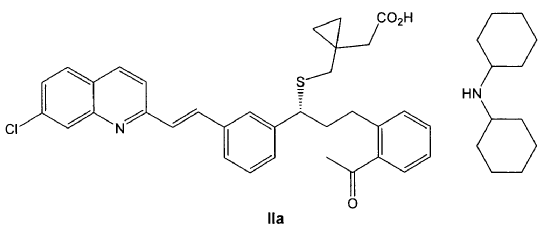
o un solvato farmacéuticamente aceptable del mismo, incluyendo un hidrato.
2. Forma cristalina de la sal de diciclohexilamina del ácido (R)-(E)-1-(((1-(3-(2-(7-cloro-2-quinolinil)etenil)fenil)-3-(2-acetilfenil)propil)tio)metil)ciclopropan-acético según la reivindicación 1, caracterizada porque su difractograma de Rayos X es sustancialmente igual al que se muestra en la Figura 1.
3. Procedimiento de preparación de un compuesto de fórmula IIa tal como se ha definido en cualquiera de las reivindicaciones 1-2, que comprende la reacción de un compuesto de fórmula II
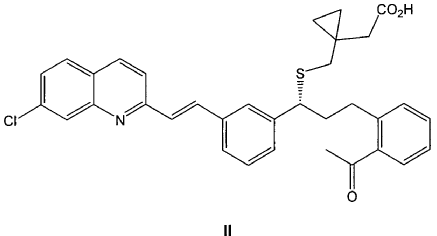
con diclohexilamina en presencia de un disolvente polar.
4. Procedimiento de preparación según la reivindicación 3, donde el disolvente polar se selecciona entre el grupo formado por una cetona de fórmula RCOR1, un éster de fórmula RCO2R1 donde R y R1 pueden ser iguales o diferentes y representan (C1-C4)alquilo, y un hidrocarburo aromático que es un benceno mono o disustituído, donde el sustituyente se selecciona entre halógeno o metilo.
5. Procedimiento de preparación según la reivindicación 4, donde el disolvente polar es acetona.
6. Procedimiento de preparación según cualquiera de las reivindicaciones 3-5 donde previamente se hace reaccionar un compuesto de fórmula IV
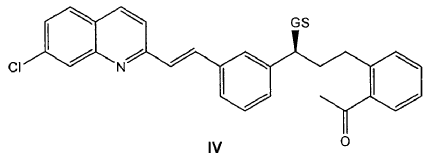
donde GS representa un grupo saliente seleccionado del grupo que consiste en metanosulfoniloxilo y p-tolueno- sulfoniloxilo; con un compuesto de fórmula V
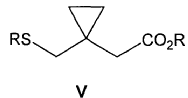
donde R representa un metal alcalino, en el seno de un disolvente adecuado, seguido de tratamiento acuoso en medio ácido, para obtener el compuesto de fórmula II.
7. Procedimiento de preparación según la reivindicación 6 donde GS representa metanosulfoniloxilo.
8. Procedimiento de preparación según cualquiera de las reivindicaciones 6-7 donde R representa Na.
9. Procedimiento de preparación de un compuesto de fórmula I,
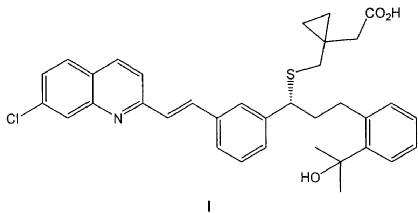
o una sal farmacéuticamente aceptable del mismo, o un solvato farmacéuticamente aceptable del mismo, incluyendo un hidrato; que comprende la transformación de un compuesto de fórmula IIa
en un compuesto de fórmula II por tratamiento acuoso en medio ácido;
seguido de reacción con un compuesto de fórmula III CH3MgX, donde X representa halógeno, en el seno de un disolvente adecuado, opcionalmente en presencia de un ácido de Lewis; y posterior tratamiento acuoso en medio ácido para dar el compuesto de fórmula I;
y, opcionalmente, el compuesto de fórmula I se convierte en una sal farmacéuticamente aceptable del mismo por tratamiento con la correspondiente base, o una sal del compuesto de fórmula I se convierte en otra sal del compuesto de fórmula I por intercambio de iones,
o el compuesto de fórmula I se convierte en un solvato farmacéuticamente aceptable del mismo, incluyendo un hidrato, por cristalización/precipitación en el seno de un disolvente adecuado.
10. Procedimiento de preparación según la reivindicación 9, donde X representa Cl en presencia de un ácido de Lewis.
11. Procedimiento de preparación según la reivindicación 10, donde el ácido de Lewis es CeCl3.
12. Procedimiento de preparación según cualquiera de las reivindicaciones 9-11 donde previamente se hace reaccionar un compuesto de fórmula II
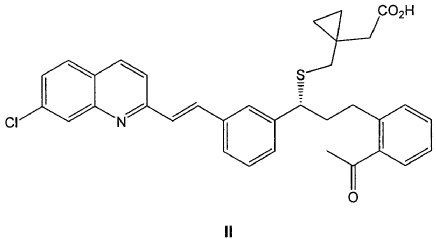
con diclohexilamina en presencia de un disolvente polar para obtener un compuesto de fórmula IIa.
13. Procedimiento de preparación según la reivindicación 12, donde previamente se hace reaccionar un compuesto de fórmula IV

donde GS representa un grupo saliente seleccionado del grupo que consiste en metanosulfoniloxilo y p-tolueno- sulfoniloxilo; con un compuesto de fórmula V
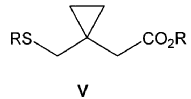
donde R representa un metal alcalino, en el seno de un disolvente adecuado, seguido de tratamiento acuoso en medio ácido, para obtener el compuesto de fórmula II.
Patentes similares o relacionadas:
Antagonistas del cisteinil leucotrieno, del 25 de Marzo de 2020, de Sun Pharma Advanced Research Company Ltd: Un compuesto de la fórmula (Ia), o la sal farmacéuticamente aceptable de este, **(Ver fórmula)** en donde, R1 y R2 se seleccionan de hidrógeno y halógeno; […]
Compuestos de quinolina fusionados como inhibidores de PI3K/mTor, del 5 de Febrero de 2020, de Advenchen Pharmaceuticals LLC: Un compuesto de fórmula I **(Ver fórmula)** en la que Q1 y Q2 se seleccionan independientemente de un arilo, un heterociclilo de 5-6 miembros o un bicicloheterociclilo […]
Un procedimiento para la preparación de montelukast sódico, del 24 de Abril de 2019, de Laurus Labs Limited: Un procedimiento para la preparación de montelukast sódico de la fórmula I,**Fórmula** que comprende las etapas de: a) hacer reaccionar […]
Formulación de cápsula que comprende Montelukast y Levocetirizina, del 24 de Abril de 2019, de HANMI PHARM. CO., LTD.: Una formulación de cápsula para prevenir o tratar rinitis alérgica y asma, que comprende dos capas por separado de: una capa de Montelukast que comprende montelukast […]
Compuestos útiles como inmunomoduladores, del 3 de Abril de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de formula (I):**Fórmula** o una sal farmaceuticamente aceptable del mismo, en el que: m es 0, 1 o 2; R1 se selecciona […]
Inhibidores de cinasa a base de quinolina, del 26 de Febrero de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de formula (I) **(Ver fórmula)** o una sal farmaceuticamente aceptable del mismo, en donde: R1 se selecciona entre imidazopiridazina, isoquinolinilo, […]
Compuesto heterocíclico que contiene nitrógeno y germicida agrícola/hortícola, del 28 de Noviembre de 2018, de NIPPON SODA CO., LTD.: Un compuesto heterocíclico que contiene nitrógeno representado por la Fórmula (II): **Fórmula** en la que, en la Fórmula (II), R representa un grupo representado por […]
Derivados de 2-quinolinil-ácido acético como compuestos antivirales del VIH, del 4 de Abril de 2018, de GILEAD SCIENCES, INC.: Un Compuesto de fórmula Ih: donde: R1 es R1a o R1b; R4 es R4a o R4b; R5 es R5a o R5b; R6 es R6a o R6b; R7 es R7a o R7b; R1a se selecciona de: a) […]