OBTENCION Y PROPIEDADES ANTIHIPERTENSIVAS DE PEPTIDOS DERIVADOS DE PROTEINAS DE CLARA DE HUEVO.
Obtención y propiedades antihipertensivas de péptidos derivados de proteínas de clara de huevo.
La invención consiste en la producción de la unidades peptídicas mínimas que presentan bio-actividad como agentes antihipertensivos a partir de clara de huevo sometida a un tratamiento enzimático. Dichos péptidos muestran actividad inhibidora de la enzima convertidora de angiotensina (actividad IECA) in vitro y/o actividad antihipertensiva en ratas y/o actividad antioxidante. Estos ovoproductos: los hidrolizados completos, las fracciones de los mismos de bajo peso molecular, o sus péptidos constituyentes, podrían utilizarse como sustancias terapéuticas con actividad IECA y/o con actividad antihipertensiva y/o con actividad antioxidante, ya sea como productos alimentarios funcionales, aditivos o ingredientes alimentarios, o productos farmacéuticos, para el tratamiento y/o prevención de la hipertensión arterial en todas sus formas en un ser humano o en un animal y para el tratamiento y/ola prevención de cualquier desorden asociado con la hipertensión arterial en un ser humano o en un animal
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200501246.
Solicitante: CONSEJO SUPERIOR INVESTIG. CIENTIFICAS.
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: MIGUEL CASTRO,MARTA, RAMOS GONZALEZ,MERCEDES, ALEIXANDRE DE ARTIANO,AMAYA, LOPEZ-ALONSO FANDIO,ROSINA.
Fecha de Solicitud: 23 de Mayo de 2005.
Fecha de Publicación: .
Fecha de Concesión: 21 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- C07K5/08A1F
Clasificación PCT:
- A23J3/04 NECESIDADES CORRIENTES DE LA VIDA. › A23 ALIMENTOS O PRODUCTOS ALIMENTICIOS; SU TRATAMIENTO, NO CUBIERTO POR OTRAS CLASES. › A23J COMPOSICIONES A BASE DE PROTEINAS PARA LA ALIMENTACION; TRATAMIENTO DE PROTEINAS PARA LA ALIMENTACION; COMPOSICIONES A BASE DE FOSFATIDOS PARA LA ALIMENTACION. › A23J 3/00 Tratamiento de proteínas para la alimentación. › Proteínas animales.
- A23L1/305
- A61K38/06 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Tripéptidos.
- A61K38/57 A61K 38/00 […] › que provienen de animales; que provienen de humanos.
- A61P9/12 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › Antihipertensivos.
- C07K14/77 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Ovoalbúmina.
- C07K14/81 C07K 14/00 […] › Inhibidores de proteasa.
- C07K5/087 C07K […] › C07K 5/00 Péptidos con hasta cuatro aminoácidos en una secuencia totalmente determinada; Sus derivados. › la cadena lateral del primer aminoácido contiene carbociclos, p. ej. Phe, Tyr.
- C12P21/06 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › preparados por hidrólisis de un enlace peptídico, p. ej. hidrolizados.
Fragmento de la descripción:
Obtención y propiedades antihipertensivas de péptidos derivados de proteínas de clara de huevo.
Sector de la técnica
La invención consiste en la producción de péptidos con actividad antihipertensiva, derivados de proteínas de clara de huevo, que pueden aplicarse en la industria alimentaria y farmacéutica.
Estado de la técnica
Dentro de la secuencia de las proteínas alimentarias se encuentran determinadas regiones que, una vez liberadas mediante hidrólisis, pueden exhibir actividades biológicas. Dichos fragmentos, denominados péptidos bioactivos, pueden generarse in vivo, durante la hidrólisis de las proteínas por acción de las enzimas gastrointestinales, o in vitro, mediante la acción de enzimas específicas o durante los procesos de elaboración de determinados alimentos. Por su diversidad y multifuncionalidad, los péptidos bioactivos pueden emplearse como ingredientes en alimentos funcionales para producir distintos efectos beneficiosos para la salud, ya que ejercen diferentes actividades biológicas, tales como antihipertensiva, antitrombótica, opiácea, antioxidante, inmunomodulante etc. [Gobbetti, M., Stepaniak, L., de Angelis, M., Corsetti, A., di Cagno, R. Latent bioactive peptides in milk proteins: proteolytic activation and significance in dairy processing. Crit. Rev. Food Sci. Nutr. 2002, 42:223-239].
La presión arterial se define como la fuerza ejercida por la sangre contra la pared arterial y, la hipertensión arterial se puede definir como una elevación crónica de la presión arterial sistólica (PAS) y/o de la presión arterial diastólica (PAD) por encima de los valores normales. Se trata de uno de los principales factores de riesgo de enfermedades cardiovasculares y la primera causa de mortalidad en los países desarrollados. De hecho, numerosos estudios han demostrado la estrecha relación entre la hipertensión arterial no tratada y la aparición de hipertrofia ventricular, insuficiencia renal progresiva, accidentes cerebrovasculares, retinopatías, enfermedades vasculares periféricas etc. El sistema renina-angiotensina juega un papel crucial en el control de la presión arterial y en el balance de electrolitos, y participa en las funciones renal, neuronal y endocrina. Existen fármacos con actividad antihipertensiva, como el Captopril, que actúan inhibiendo la enzima convertidora de angiotensina (ECA). La ECA cataliza la formación de angiotensina II, un octapéptido con una potente actividad vasoconstrictora y, además, inactiva la bradiquinina, que produce vasodilatación.
Se han descubierto distintos péptidos con actividad inhibidora de la ECA (IECA), derivados de hidrolizados enzimáticos de proteínas de suero lácteo, caseínas, músculo de pescado, huevo, o de origen vegetal [Yamamoto, N. Antihypertensive peptides derived from food proteins. Biopolymers, 1997, 43: 129-134; Fujita, H., Yamagami, T., Ohshima, K. Effects of an ACE-inhibitory agent, katsuobushi oligopeptide, in the spontaneously hypertensive rat and in borderline and middly hypertensive subjects. Nutr. Res. 2001, 21: 1149-1158; Vermeirssen, V., Van Camp., J., Decroos, K., Van Wijmelbeke, L., Verstraete W. The impact of fermentation and in vitro digestion on the formation of antiotensin-I-converting enzyme inhibitory activity from pea and whey protein. J. Dairy Sci. 2003, 86: 429-438]. En la mayor parte de los casos se ha probado que éstos péptidos actúan inhibiendo la ECA in vitro. En ocasiones se ha demostrado su actividad antihipertensiva, normalmente en ratas espontáneamente hipertensas (SHR), que constituyen un buen modelo animal para la evaluación de compuestos con actividad antihipertensiva, siendo los estudios en humanos mucho más escasos. Sin embargo, con frecuencia los péptidos con actividad IECA in vitro no muestran actividad antihipertensiva en ratas SHR [Fujita, H, Yokoyama, K., Yoshikawa, M. Classification and antihypertensive activity of angiotensin I-converting enzyme inhibitory peptides derived from food proteins. J. Food Sci. 2000, 65: 564-569]. Esto pone de manifiesto que la determinación de la actividad IECA in vitro, si bien es un buen punto de partida para estos estudios, no puede convertirse en el único criterio de selección, ya que no considera las transformaciones fisiológicas de los péptidos en el organismo que determinan su biodisponibilidad (digestión y paso a través de la barrera gastrointestinal para llegar a la sangre en forma activa).
Por otra parte, la inhibición de la ECA no es el único mecanismo que puede justificar la acción antihipertensiva de los péptidos derivados de proteínas alimentarias. La hipertensión esencial se asocia con una lipoperoxidación exagerada, y con un desequilibrio en el status antioxidante que conlleva a un exceso de formación de especies reactivas de oxígeno [Touyz, R. M., Pu, Q., He, G., Chen, X., Yao, G., Neves, M. F., Viel, E. Effects of a low dietary magnesium intake on development of hypertension in stroke-prone spontaneously hypertensive rats: role of reactive oxygen species. J. Hypertens. 2002, 20:2221-2232]. Algunos de estos péptidos tienen efecto antioxidante. Algunos también podrían ejercer una acción vasodilatadora directa. Así, se han descrito dos péptidos con actividad vasodilatadora, que provienen de la misma región de la ovoalbúmina hidrolizada con diferentes enzimas. Fujita y col. [Fujita, H., Usui, H., Kurahashi, K., Yoshikawa, M. Isolation and characterization of ovokinin, a bradykinin B1 agonist peptide derived from ovoalbumin. Peptides, 1995, 16: 785-790; Fujita, H., Sasaki, R., Yoshikawa, M. Potentiation of the antihypertensive activity of orally administered ovokinin, a vasorelaxing peptide derived from ovalbumin, by emulsification in egg phosphatidyl-choline. Biosci. Biotechnol. Biochem. 1995, 59: 2344-2345] encontraron que la ovokinina, un octapéptido aislado de un hidrolizado de ovoalbúmina con pepsina (FRADHPFL SEQ ID Nº 5) [Yoshikawa, M., Hasegawa, M., Fujita, H. 1993. New peptide and its production. JP5331190], mostraba actividad relajante en arterias mesentéricas caninas y actividad antihipertensiva cuando se administraba por vía oral a ratas SHR a dosis de 100 mg/kg. Matoba y col. [Matoba, N., Usui, H., Fujita, H., Yoshikawa, M. A novel anti-hypertensive peptide derived from ovalbumin induces nitric oxide-mediated vasorelaxation in an isolated SHR mesenteric artery. FEBS Lett. 1999, 452:181-184] purificaron a partir de un hidrolizado de ovoalbúmina con quimotripsina, un hexapéptido correspondiente al fragmento 2-7 de la ovokinina (RADHP SEQ ID Nº 4; ovokinina (2-7)) [Yoshikawa, M., Hasegawa, M., Yamamoto, T., Fujita, H. 1998. New peptide from egg white used for production of therapeutic for treatment of, e.g. angina pectoris. JP10036394] que ejercía una potente acción antihipertensiva en ratas SHR a dosis de 10 mg/kg.
Posteriormente, se sintetizaron análogos de la ovokinina (2-7) para aumentar su actividad antihipertensiva. Entre ellos, RPFHPF y RPLKPW, mostraron, respectivamente 10 y 100 veces más actividad que la ovokinina (2-7) tras su administración oral a SHR (dosis mínimas efectivas de 1 y 0.1 mg/kg), lo que se atribuyó a una mayor resistencia a las proteasas del tracto digestivo [Matoba, N., Yamada, Y., Usui, H., Nakagiri, R., Yoshikawa, M. Designing potent derivatives of ovokinin (2-7), an anti-hypertensive peptide derived from ovalbumin, Biosci. Biotechnol. Biochem. 2001, 65: 736-739; Yamada, Y., Matoba, N., Usui, H., Onishi, K. Design of a highly potent anti-hypertensive peptide based on ovokinin (2-7), Biosci. Biotechnol. Biochem. 2002, 66: 1213-1217]. De acuerdo con estos autores, la ovokinina (2-7), y sus derivados RPFHPF o RPLKPW disminuirían la presión arterial a través de su interacción con receptores del tracto gastrointestinal o debido a efectos en el sistema nervioso central.
En nuestro laboratorio hemos demostrado que la proteolisis de clara de huevo con pepsina da lugar a un hidrolizado con potente actividad IECA y neutralizadora de radicales libres in vitro, y con actividad antihipertensiva en ratas SHR, que podría dar lugar a preparados multifuncionales útiles para la prevención y el tratamiento de la hipertensión y otros desórdenes asociados [Miguel, M., López-Fandiño, R., Recio. I., Ramos, M., López-Fandiño, R., Aleixandre, A. 2003. Péptidos bioactivos derivados de proteínas de clara de huevo mediante hidrólisis enzimática. Solicitud Española de patente 200301829]. Se identificaron varias secuencias peptídicas activas, derivadas de la ovoalbúmina, mediante espectrometria de masas en tandem, síntesis química de los péptidos y confirmación de las propiedades IECA y antioxidantes de los fragmentos sintéticos [Miguel, M., Recio. I., Gómez-Ruiz,...
Reivindicaciones:
1. Producto bioactivo, seleccionado de entre el péptido SEQ. ID. Nº. 1 o el péptido SEQ. ID. Nº. 2, o cualquier derivado o sal farmacéuticamente aceptable, que tiene actividad antihipertensiva.
2. Composición farmacéutica que comprende el producto bioactivo según la reivindicación 1.
3. Aditivo, ingrediente o suplemento alimenticio funcional que comprende el producto bioactivo según la reivindicación 1.
4. Uso de un aditivo, ingrediente o suplemento alimenticio funcional según la reivindicación 3, en la elaboración de un producto alimenticio funcional para el tratamiento de la hipertensión.
5. Producto alimenticio funcional que comprende el producto bioactivo según la reivindicación 1.
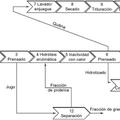
6. Procedimiento para producir el producto bioactivo según la reivindicación 1, que comprende:
7. Procedimiento según la reivindicación 6, donde el material de partida se selecciona de la lista que comprende ovoproductos destinados a la alimentación humana, ovoproductos destinados a la alimentación animal, huevo entero, clara de huevo u ovoalbúmina pura.
8. Procedimiento según cualquiera de las reivindicaciones 6 ó 7, donde en el apartado (b), el material de partida se disuelve o dispersa en una solución tampón con un pH de entre 2.0 y 3.0, y la hidrólisis del apartado (c) se lleva a cabo por medio de pepsina.
9. Procedimiento según la reivindicación 8, donde se mantiene la reacción de hidrólisis del apartado (c) durante un tiempo aproximado de 3 horas.
10. Procedimiento según la reivindicación 9 que además comprende:
11. Procedimiento para producir el producto bioactivo según la reivindicación 1, que comprende la síntesis química o enzimática de SEQ. ID. Nº. 1 o SEQ. ID. Nº. 2, o; el empleo de métodos recombinantes que contengan la secuencia SEQ. ID. Nº. 1 o SEQ. ID. Nº. 2.
12. Uso de la composición farmacéutica según la reivindicación 2 para la elaboración de un medicamento para el tratamiento de la hipertensión.
Patentes similares o relacionadas:
POLIPÉPTIDOS DERIVADOS DE PROTEÍNA PRECURSORA AMILOIDE (APP) Y SUS USOS, del 31 de Marzo de 2011, de THE OPEN UNIVERSITY: Una composición farmacéutica que comprende: (a) un compuesto con la fórmula: X1 es un grupo acilo representado por la fórmula: X2 es H o un grupo acilo representado […]
 PEPTIDO BIOLOGICAMENTE NO DEGRADABLE, INHIBIDOR DE LA ENZIMA QUE CONVIERTE ANGIOTENSINA, FARMACO Y ALIMENTO FUNCIONAL, del 29 de Diciembre de 2009, de CALPIS CO., LTD.: Un péptido que tiene Pro en un terminal carboxilo, seleccionado del grupo constituido por Gln-Pro, Met-Pro, y Ser-Pro-Pro o una sal del mismo, para uso en medicina
PEPTIDO BIOLOGICAMENTE NO DEGRADABLE, INHIBIDOR DE LA ENZIMA QUE CONVIERTE ANGIOTENSINA, FARMACO Y ALIMENTO FUNCIONAL, del 29 de Diciembre de 2009, de CALPIS CO., LTD.: Un péptido que tiene Pro en un terminal carboxilo, seleccionado del grupo constituido por Gln-Pro, Met-Pro, y Ser-Pro-Pro o una sal del mismo, para uso en medicina
 Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
 Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Uso de tripeptidil peptidasas tolerantes a la prolina en composiciones de aditivo para piensos, del 26 de Febrero de 2020, de Dupont Nutrition Biosciences ApS: Un método para preparar una composición de aditivo para piensos que comprende: mezclar al menos una tripeptidil peptidasa tolerante a la prolina que tiene […]
Enzimas específicas de sitio y métodos de uso, del 19 de Febrero de 2020, de Poseida Therapeutics, Inc: Un polipéptido que comprende al menos una secuencia de aminoácidos que tiene la secuencia de LSTEQVVAIASX1X2GGKQALEAVKAQLLVLRAAPYE (SEQ ID NO: 1), en donde […]
Composiciones para unir módulos de dedos de cinc, del 15 de Enero de 2020, de Sangamo Therapeutics, Inc: Una proteína de dedos de cinc de múltiples dedos que se une específicamente a un sitio diana, comprendiendo la proteína de dedos de cinc de […]
Concentrado de proteínas de granos que contienen almidón: composición, método de fabricación y usos del mismo, del 1 de Enero de 2020, de THE UNITED STATES OF AMERICA AS REPRESENTED BY THE SECRETARY OF AGRICULTURE: Un proceso para producir un concentrado de proteinas a partir de un grano o semilla oleaginosa que contiene almidon, el proceso comprende: (i) moler el […]