PROCEDIMIENTO DE OBTENCION DE AGREGADOS ANTIGENICOS DE LA HEPATITIS B DESLIPIDADOS Y USO DE LOS MISMOS.
Esta invención se relaciona con un método de obtención de estructuras antigénicas agregadas,
capaces de potenciar la respuesta inmune a antígenos agregados administrados por vía sistémica y/o mucosal, así como con las estructuras químicas, formulaciones de dichas estructuras y su uso. A partir del uso de agentes o compuestos agregantes, delipidantes u oxidantes, se permite la liberación de lípidos de las partículas y la agregación de las mismas. El estado de agregación se puede provocar en el interior de la levadura variando las condiciones de incubación. Las estructuras resultantes pueden utilizarse adyuvadas y/o con varios antígenos, produciéndose sinergismo entre los componentes con respecto a la respuesta inmunogénica , pudiendo contener estabilizadores y preservos. Estas nuevas estructuras antigénicas son aplicables en la industria como formulaciones vacunales, preventivas o terapéuticas, para uso humano, veterinario y /o diagnóstico
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CU01/00009.
Solicitante: CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA (CIGB).
Nacionalidad solicitante: Cuba.
Dirección: AVENIDA 31 ENTRE 158 Y 190, CUBANACAN PLAYA,CIUDAD DE LA HABANA 10600.
Inventor/es: AGUILAR, RUBIDO JULIO CESAR, PENTON ARIAS, EDUARDO, MUZIO GONZALEZ, VERENA LUCILA, CRUZ RICONDO, LUIS JAVIER, TLEUGABULOVA,DINA, SEWER MENSIES,MINERVA, GUILL NENIETO,GERARDO,ENRIQUE, SIMON BERNARD,ILOKI,ASSANGA, FALCON CAMA,VIVIANA, TAMBARA HERNANDEZ,YANET.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K39/29B
Clasificación PCT:
- A61K39/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos virales.
- A61K39/29 A61K 39/00 […] › Virus de la hepatitis.
- A61K39/295 A61K 39/00 […] › Antígenos virales polivalentes (virus de la viruela o de la varicela A61K 39/285 ); Mezclas de antígenos virales y bacterianos.
- B01D15/08 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01D SEPARACION (separación de sólidos por vía húmeda B03B, B03D, mesas o cribas neumáticas B03B, por vía seca B07; separación magnética o electrostática de materiales sólidos a partir de materiales sólidos o de fluidos, separación mediante campos eléctricos de alta tensión B03C; aparatos centrifugadores B04B; aparato de vórtice B04C; prensas en sí para exprimir los líquidos de las sustancias que los contienen B30B 9/02). › B01D 15/00 Procedimientos de separación que implican el tratamientos de líquidos con absorbentes sólidos; Aparatos para ello. › Adsorción selectiva, p. ej. cromatografía.
Clasificación antigua:
- A61K39/12 A61K 39/00 […] › Antígenos virales.
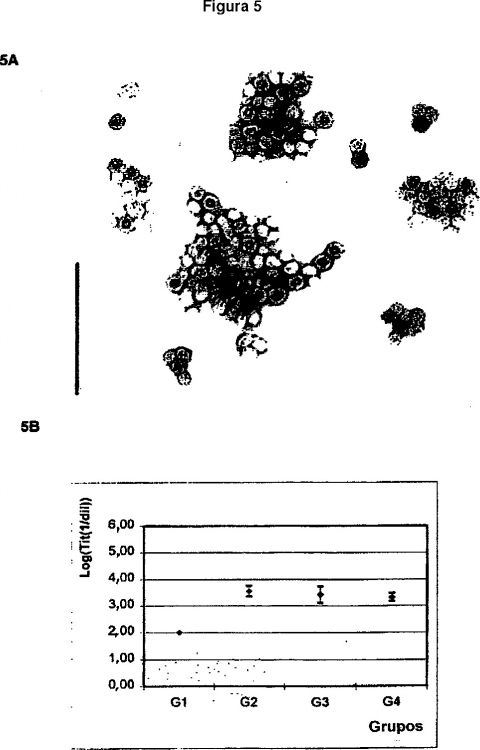
Fragmento de la descripción:
Procedimiento de obtención de agregados antigénicos de la hepatitis B deslipidados y uso de los mismos.
La presente invención está relacionada con la rama médica, particularmente con el uso de nuevas formulaciones de vacunas.
El objetivo técnico de la invención propuesta es el desarrollo de un procedimiento para la preparación de estructuras antigénicas agregadas y sus formulaciones, capaces de potenciar la inmunogenicidad de los presentes antígenos administrados por vías sistémicas o mucosales.
La Patente EP 0 231 039 describe un procedimiento para la preparación de complejos inmunogénicos útiles como una vacuna.
La Patente EP 0 174 759 divulga partículas de agregados de proteínas útiles como una vacuna.
El procedimiento descrito en la presente invención genera estructuras agregadas antigénicas o antígenos en partículas, la adición de otros antígenos, componentes con características de agregación, deslipidación u oxidación, la post-selección de partículas agregadas entre 30-500 nm de tamaño, y la formulación de dichos agregados con los adyuvantes convenientes, favorece la inmunogenicidad de la composición antigénica resultante.
Desde que se sabe que el HBsAg es un inmunógeno eficaz, este fue el primer candidato de vacuna de un amplio uso en humanos y la primera vacuna recombinante anti-hepatitis B autorizada para uso universal. Las proteínas del HBsAg están auto-ensambladas en partículas de 22 nm (Heerman KH, Gerlich WH, Surface protein of Hepatitis B virus, A. McLachlan, ed. CRC Press, Boca Raton, Ann. Harbor, Boston, London, pág. 109, (1991)). La base molecular, celular y genética, de la respuesta inmune al HBsAg ha sido extensamente estudiada en un modelo múrido (Milich, DR., "Genetic and molecular basis for T- and B-cell recognition of hepatis B viral antigens", Immunol. Rev., vol. 99, pág. 71, (1987)). Anteriormente, se había estudiado la forma en que las variaciones de las propiedades físico-químicas del antígeno de superficie afecta su inmunogenicidad para células T restringidas clase I de MHC. Se obtuvo la evidencia de que únicamente se generó una respuesta CTL restringida clase I de MHC eficaz con una inyección de baja dosis del antígeno nativo en partículas de 22 nm o con monómeros desnaturalizados con detergentes sin adyuvante (Schirmbeck, R. y otros, Eur. J. Immunol., vol. 24, pág. 1088, (1994)). Igualmente, se ha investigado la inmunogenicidad de una preparación de agregados del antígeno de superficie de HBV obtenido mediante desnaturalización por calor para producir partículas de aproximadamente 1 µm de diámetro.
El tipo de transformación antigénica in vivo tiene una influencia fundamental sobre la eficacia de la respuesta de la célula T primaria, así como sobre el espectro de la subclase de la célula T implicada. En la presentación de péptidos al MHC evidentemente operan procedimientos alternativos para las células T restringidas CD4+ clase II del MHC y para células T restringidas CD8+ clase I del MHC (Germain, RN. y otros, Annu. Rev. Immunol., vol. 11, pág. 403, (1993)). Se ha descrito una nueva vía endosómica para la transformación de partículas de HBsAg exógenas a los presentes epítopos restringidos clase I del MHC. Esta transformación de partículas de HBsAg exógenas de 1 µm de diámetro desnaturalizadas por calor se produce en macrófagos pero no en otros tipos de células y está acompañada con la regurgitación de péptidos antigénicos procedentes de la transformación del macrófago. Este procedimiento que genera péptidos restringidos clase I del MHC antígenos exógenos ha sido diseñado como una tentativa a la vía fagocítica. Las partículas de HBsAg de 22 nm nativas son transformadas fundamentalmente por los agregados de 1 µm y endocíticos por las vías fagocíticas. Además de la diferente transformación in vitro de estas dos preparaciones exógenas de HBsAg, su inmunogenicidad in vivo para la CTL clase I fue marcadamente diferente cuando se emplearon sin adyuvantes. La partícula de HBsAg nativa fue altamente inmunogénica en tanto que los agregados de antígenos de superficie desnaturalizados fueron de baja inmunogenicidad (Schirmbeck, R. y otros, J. Immunol., vol. 155, págs.. 4676-4684, (1995)).
Otros estudios realizados usando polarización por fluorescencia sugieren que la partícula de HBsAg está organizada como una bicapa lípida que reacciona con agregados de proteína (Sonveaux, N., Res. Virol., vol. 146, (No. 1), págs. 43-51, (1995)).
El tratamiento de HBsAg con cloroformo-metanol (2:1, v/v) y 1,1',3,3'-tetrametil-urea al 50%, no afectó la integridad morfológica de las partículas (mantuvieron su diámetro medio), aunque se liberó una parte importante de sus lípidos. La antigenicidad y la composición del polipéptido HBsAg no resultaron alteradas por la deslipidación (Neurath, AR., y otros, Intervirology, vol. 10, (No. 5), págs. 265-75, (1978)).
Teniendo en cuenta que las agregaciones de partículas no se han producido en las exigentes condiciones del procedimiento de producción, tal como la presencia de agentes caotrópicos, temperaturas moderadas y soluciones altamente concentradas, se ha estudiado la fuente de agregación de partículas del antígeno de superficie de la hepatitis B recombinante usando una combinación de técnicas de inmunoafinidad y cromatografía de exclusión por tamaños molecular. La investigación de los factores que conducen a un incremente en la base del pico que corresponde al HBsAg en la cromatografía de exclusión molecular ha demostrado la existencia de agregados de partículas, además de la variabilidad de tamaño de la partícula de HBsAg (Tleugabulova, D., J. Chromatogr. B. Biomed. Sci. Appl., vol. 707, (Nos. 1-2), págs. 267-73, (1998), Tleugabulova, D., Chromatographia, vol. 45, págs. 317-320, (1997)). Como un resultado de ello, el antígeno agregado se obtuvo en la fracción correspondiente a los agregados de partículas grandes pero no en la fracción en la que se encontró la proteína de HBsAg nativa; otro resultado de este artículo corrobora que los agregados están formados por partículas de 22 nm que migran como monómeros y dímeros en SDS-PAGE, así como el antígeno de superficie plegado correctamente (Tleugavuloba, D. y otros, Chromatogr. B. Biomed. Sci. Appl., vol. 25, (No. 1-2), págs. 209-19, (1998)).
Divulgación de la invención
Uno de los objetivos de la presente invención es un procedimiento para la obtención de estructuras antigénicas agregadas de una inmunigenicidad mayor que los antígenos que las originan. Dicho procedimiento incluye las etapas siguientes:
A) Selección de los antígenos de interés.
B) Adición de uno o varios antígenos de la mezcla en un medio que favorece el procedimiento de agregación, pudiendo estar constituido dicho medio por medios químicos, agentes oxidantes u otros componentes con capacidad de agregación.
C) Incubación de la mezcla.
D) Selección del agregado de partículas con un tamaño entre 30 y 500 nm mediante un procedimiento que permite la retención de estos tamaños moleculares, tal como cromatografía de exclusión molecular, diafiltración y diálisis.
E) Preparación de las formulaciones mediante la mezcla de las estructuras antigénicas seleccionadas en la etapa (C) a través de la adición del adyuvante de elección e igualmente la potencial adición de otros antígenos, estabilizadores y conservantes.
Mediante el procedimiento de la presente invención pueden obtenerse diversos agregados que únicamente contienen el antígeno de superficie del HBV, incluyendo igualmente combinaciones del antígeno de superficie y otra lipoproteína, lipopéptido o antígenos homólogos o heterólogos lipídicos procedentes de cualquier patógeno viral, bacteriano, unicelular o multicelular.
De acuerdo con el procedimiento de la invención, los antígenos que son parte de las estructuras obtenidas en la etapa (B) pueden agregarse al antígeno de superficie del virus de la hepatitis B mediante interacciones hidrófobas, electrostáticas o covalentes, que generan agregados de diferentes tamaños.
El procedimiento para la obtención de estructuras antigénicas permite la agregación de los antígenos nucleocápsidos de la hepatitis B, C o VIH contra el antígeno de superficie del virus de la hepatitis B; igualmente pueden agregarse antígenos procedentes de virus y bacterias tales como virus inactivados o proteínas de membrana exterior de patógenos bacterianos del tipo Neisseria...
Reivindicaciones:
1. Un procedimiento para la preparación de estructuras antigénicas agregadas altamente inmunogénicas, el cual comprende las etapas siguientes:
A) selección de los antígenos de interés;
B) adición de uno o varios antígenos de la mezcla en un medio que favorece la agregación;
C) incubación de la mezcla;
D) deslipidación de la mezcla;
E) selección de los agregados de partículas que tienen un tamaño desde 30 hasta 500 nm usando un procedimiento que permite la retención de estos tamaños moleculares; y opcionalmente,
F) preparación de formulaciones a partir de la mezcla de las estructuras antigénicas seleccionadas en la etapa (E), mediante la adición de un adyuvante de elección y adición opcional de otros antígenos, agentes estabilizantes y agentes conservantes;
en el que los antígenos de interés comprenden el Antígeno de superficie de la Hepatitis B (HBsAg) opcionalmente en combinación con otros antígenos.
2. Un procedimiento de acuerdo con la reivindicación 1, en el que los antígenos de interés comprenden HBsAg únicamente.
3. Un procedimiento de acuerdo con la reivindicación 1, en el que los antígenos de interés comprenden HBsAg en combinación con otros antígenos.
4. Un procedimiento de acuerdo con la reivindicación 3, en el que los otros antígenos están seleccionados entre el grupo constituido por antígeno nucleocápsido del Virus de la Hepatitis B (HBcAg), antígeno nucleocápsido del Virus de la Hepatitis C, antígeno nucleocápsido del Virus de la Inmunodeficiencia Humana tipo 1 ó 2, y proteína de membrana exterior de Neisseria meningitidis.
5. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que el medio usado en la etapa (B) comprende agentes químicos, agentes oxidantes u otros componentes que tienen capacidad de agregación.
6. Un procedimiento de acuerdo con la reivindicación 5, en el que el medio usado en la etapa (B) comprende ß-ciclodextrinas.
7. Un procedimiento de acuerdo con la reivindicación 5 ó 6, en el que el medio usado en la etapa (B) comprende sales de amonio en una concentración de 10-50 mM, potenciado por sales de cobre y hierro y otras que permiten la agregación.
8. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 5-7, en el que el medio usado en la etapa (B) comprende adyuvante de naturaleza hidrófoba total o parcial que favorece la agregación de HBsAg.
9. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que la etapa de incubación (C) precisa desde 10 minutos hasta una semana.
10. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que en la etapa (E) los agregados de partículas están seleccionados de un tamaño de desde 50 hasta 500 nm.
11. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que el adyuvante de interés usado en la etapa (F) es un aluminio o adyuvante de sal de calcio o un adyuvante aceitoso.
12. Un agregado altamente inmunogénico de partículas antigénicas preparado de acuerdo con el procedimiento de una cualquiera de las reivindicaciones precedentes, que comprende Antígeno de superficie de la Hepatitis B (HBsAG) opcionalmente en combinación con otros antígenos, en el que el agregado de partículas tiene un tamaño de desde 30 hasta 500 nm.
13. Un agregado de acuerdo con la reivindicación 12, en el que los antígenos comprenden HBsAg únicamente.
14. Un agregado de acuerdo con la reivindicación 12, en el que los antígenos comprenden HBsAg en combinación con otros antígenos.
15. Un agregado de acuerdo con la reivindicación 14, en el que los otros antígenos están seleccionados entre el grupo constituido por antígeno nucleocápsido del Virus de la Hepatitis B (HBcAg), antígeno nucleocápsido del Virus de la Hepatitis C, antígeno nucleocápsido del Virus de la Inmunodeficiencia Humana tipo 1 ó 2, y proteína de membrana exterior de Neisseria meningitidis.
16. Un agregado de acuerdo con una cualquiera de las reivindicaciones 12 a 15, en el que el agregado comprende adyuvante de naturaleza hidrófoba total o parcial.
17. Una formulación de vacuna que comprende un agregado altamente inmunógeno tal como se define en una cualquiera de las reivindicaciones 12 a 16, conjuntamente con adyuvante, agente estabilizante o agente conservante.
18. Una formulación de vacuna de acuerdo con la reivindicación 17, para aplicación sistémica o mucosal.
Patentes similares o relacionadas:
PROCEDIMIENTOS PARA LA ADAPTACIÓN DE LA RESPUESTA INMUNE A UN ANTÍGENO O INMUNÓGENO, del 14 de Noviembre de 2011, de BIOMEDICAL RESEARCH MODELS, INC. ORAL VACCINE TECHNOLOGIES, INC: Una preparación primaria para administración intramuscular que comprende un ácido nucleico que codifica un antígeno: y una preparación secundaria […]
VACUNAS MEJORADAS, del 7 de Febrero de 2011, de INTERCELL AG: Una vacuna para prevenir infecciones con virus de influenza que comprende - un antígeno de influenza, - un péptido con la secuencia de aminoácidos KLKL5KLK, […]
 LINEAS CELULARES DE HEPATOMAS HUMANOS, SU OBTENCION Y SUS APLICACIONES, del 1 de Julio de 2010, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Línea celular de hepatomas como la depositada el 5 de abril de 2001 en el CNCM, con el nº I-2652
LINEAS CELULARES DE HEPATOMAS HUMANOS, SU OBTENCION Y SUS APLICACIONES, del 1 de Julio de 2010, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Línea celular de hepatomas como la depositada el 5 de abril de 2001 en el CNCM, con el nº I-2652
VACUNAS COMBINADAS QUE COMPRENDEN ANTIGENO DE SUPERFICIE DE LA HEPATITIS B Y OTROS ANTIGENOS, del 5 de Marzo de 2010, de SMITHKLINE BEECHAM BIOLOGICALS S.A.: SE DESCRIBEN COMPOSICIONES DE VACUNA MULTIVALENTES EFECTIVAS Y ESTABLES QUE COMPRENDEN EL ANTIGENO DE SUPERFICIE DE LA HEPATITIS B (HBSAG) EN LAS QUE EL COMPONENTE HBSAG ES ESTABLE […]
 USO DE ACIDOS NUCLEICOS QUE CONTIENEN DINUCLEOTIDO CPG NO METILADO EN COMBINACION CON ALUMBRE COMO ADYUVANTE, del 16 de Febrero de 2010, de OTTAWA HEALTH RESEARCH INSTITUTE
COLEY PHARMACEUTICAL GMBH
UNIVERSITY OF IOWA RESEARCH FOUNDATION
THE UNITED STATES OF AMERICA AS REPRESENTED BY THE SECRETARY DEPARTMENT OF HEALTH AND HUMAN SERVIC: Una composición farmacéutica, para activación de una respuesta inmunitaria en un mamífero, que comprende un oligonucleótido que contiene al menos un dinucleótido CpG […]
USO DE ACIDOS NUCLEICOS QUE CONTIENEN DINUCLEOTIDO CPG NO METILADO EN COMBINACION CON ALUMBRE COMO ADYUVANTE, del 16 de Febrero de 2010, de OTTAWA HEALTH RESEARCH INSTITUTE
COLEY PHARMACEUTICAL GMBH
UNIVERSITY OF IOWA RESEARCH FOUNDATION
THE UNITED STATES OF AMERICA AS REPRESENTED BY THE SECRETARY DEPARTMENT OF HEALTH AND HUMAN SERVIC: Una composición farmacéutica, para activación de una respuesta inmunitaria en un mamífero, que comprende un oligonucleótido que contiene al menos un dinucleótido CpG […]
Composición farmacéutica que comprende un complejo de carga portador polimérico y al menos un antígeno proteínico o peptídico, del 1 de Julio de 2020, de CureVac AG: Composición farmacéutica que incluye: (A) un complejo de carga portador polimérico, que comprende: a) un portador polimérico que comprende componentes catiónicos reticulados […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]