PROTEINA NMB1125 Y USO DE LA MISMA EN FORMULACIONES FARMACEUTICAS.
Uso de un nuevo antígeno vacunal aplicado de manera preventiva o terapéutica contra enfermedades bacterianas,
virales, cancerosas, o de otro origen. El objetivo técnico que se persigue es el desarrollo de formulaciones capaces de elevar el espectro protector de las vacunas ya existentes y extenderlo contra diferentes patógenos. Para lograr este objetivo se aisló e identificó la proteína NMB1125 como componente de las preparaciones de membrana externa de Neisseria meningitidis, capaz de inducir actividad bactericida. Adicionalmente, se clonó y expresó el gen codificante para la proteína NMB1125, la cual se purificó evaluándose luego su inmunogenicidad en biomodelos animales. El secuenciamiento de genes homólogos evidenció, por su elevado grado de conservación, su alto valor como antígeno inductor de una respuesta inmune cruzada cuando es presentado por diferentes vías. Las formulaciones resultantes de esta invención son aplicables en la industria farmacéutica como formulaciones vacunales para uso humano
Tipo: Resumen de patente/invención. Número de Solicitud: W04000015CU.
Solicitante: CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA (CIGB).
Nacionalidad solicitante: Cuba.
Dirección: AVENIDA 31 ENTRE 158 Y 190, CUBANACAN PLAYA,CIUDAD DE LA HABANA 10600.
Inventor/es: GUILLEN NIETO, GERARDO, ENRIQUE, GONZALEZ BLANCO, SONIA, PAJON FEYT,ROLANDO, SARDINAS GARCIA,GRETEL,CALLE JORGE 18, BETANCOURT NUNEZ,LAZARO HIRAM, CASTELLANOS SERRA,LILA,ROSA, PERERA NEGRIN,YASSER, GARCIA DIAZ,DARIEN, NIEBLA PEREZ,OLIVIA, CABALLERO MENENDEZ,EVELIN.
Fecha de Publicación: .
Fecha Concesión Europea: 30 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- C07K14/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Neisseriaceae (F), p. ej. Acinetobacter.
Clasificación PCT:
- A61K39/095 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Neisseria.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C07K14/22 C07K 14/00 […] › de Neisseriaceae (F), p. ej. Acinetobacter.
- C12N1/21 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N15/31 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas microbianas, p. ej. enterotoxinas.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- G01N33/569 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para microorganismos, p. ej. protozoarios, bacterias, virus.
Clasificación antigua:
- A61K39/095 A61K 39/00 […] › Neisseria.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C07K14/22 C07K 14/00 […] › de Neisseriaceae (F), p. ej. Acinetobacter.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/31 C12N 15/00 […] › Genes que codifican proteínas microbianas, p. ej. enterotoxinas.
- C12Q1/68 C12Q 1/00 […] › en los que intervienen ácidos nucleicos.
- G01N33/569 G01N 33/00 […] › para microorganismos, p. ej. protozoarios, bacterias, virus.
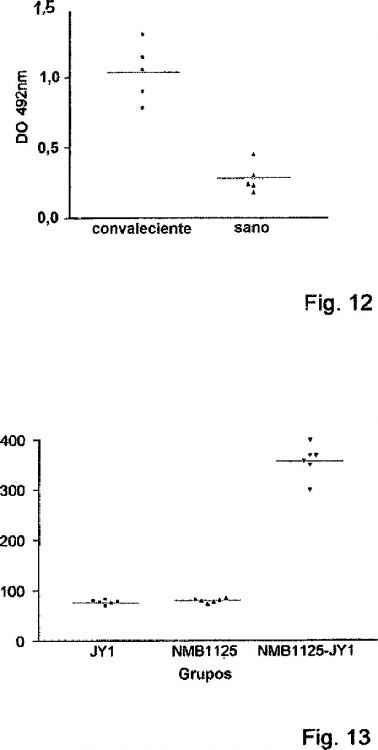
Fragmento de la descripción:
Proteína NMB1125 y uso de la misma en formulaciones farmacéuticas.
La presente invención se refiere al campo de la medicina, particularmente al desarrollo de nuevas formulaciones de vacuna de aplicación preventiva o terapéutica, que permite un incremento de la calidad de la respuesta inmunitaria contra los antígenos vacunales de enfermedades de diferentes fuentes.
Neisseria meningitidis, un diplococo gramnegativo cuyo único huésped conocido es el hombre, es el agente causal de la meningitis meningocócica. Normalmente, esta bacteria se encuentra en portadores asintomáticos entre la población normal, siendo este nicho la fuente más frecuente para su aislamiento microbiológico.
En términos internacionales, los niños menores de dos años de edad son la población más susceptible a contraer meningitis meningocócica, no obstante, también puede afectar a adultos jóvenes y a la población normal de adultos.
La enfermedad meningocócica sin tratar tiene una evolución mortal para la mayoría de los individuos afectados y la vacunación podría evitar esta situación al detener los acontecimientos ya en la fase de colonización bacteriana.
Se han desarrollado varias estrategias con el objetivo de obtener una vacuna capaz de satisfacer los requisitos necesarios con el fin de inducir protección contra esta enfermedad en la población general. Para este fin, se han tenido en cuenta los antígenos capsulares, dado que sus especificidades inmunológicas han permitido la clasificación de este microorganismo en serogrupos. Cinco de estos serogrupos se han definido como responsables de la mayoría de los casos clínicos de enfermedad meningocócica en todo el mundo. El serogrupo A es la causa principal de la epidemia en el África subsahariana. Los serogrupos B y C están asociados, en la mayoría de los casos, con los episodios en las naciones desarrolladas. Los serogrupos Y y W135 son frecuentes en la mayoría de los casos recurrentes de la enfermedad y prevalecen en la mayoría de las áreas de EE.UU., con un marcado incremento en los últimos años. A partir de estos datos, es obvia la razón del uso, estudio y evaluación de polisacáridos capsulares como candidatos a vacunas. En EE.UU. se ha autorizado una vacuna tetravalente, basada en polisacáridos capsulares, que confiere protección contra los serogrupos A, C, Y y W-135. Los anticuerpos producidos tras la vacunación son específicos de serogrupo (Rosenstein N. y col. 2001. Meningococcal disease. N. Engl. J. Med, 344, 1378-1388).
El serogrupo B, que es diferente del resto, continúa siendo una causa significativa de enfermedad meningocócica endémica y epidémica, lo que se debe, principalmente, a la ausencia completa de vacunas eficaces conrea ella. Se ha observado que el polisacárido capsular B es poco inmunógeno, más la existencia del riesgo teórico de que una vacuna basada en este compuesto induzca inmunotolerancia y autoinmunidad por su similitud estructura con las cadenas de oligosacáridos que están presentes en las estructuras neurales fetales humanas. (Finne J. y col. 1987. An IgG monoclonal antibody to group B meningococci cross-reacts with developmentally regulated polysialic acid units of glycoproteins in neural and extraneural tisues. J. Immunol, 138: 4402-4407). Por tanto, el desarrollo de vacunas contra los serogrupos B se concentra en el uso de antígenos subcapsulares.
Vacunas de proteínas de la membrana externa y en vesículas
Los intentos iniciales en la década de 1970 para producir vacunas basadas en las proteínas de la membrana externa se basaron en la depleción de LPS de las preparaciones de proteína de membrana externa mediante detergente (Frasch CE and Robbins JD. 1978. Protection against group B meningococcal disease. III. Immunogenicity of serotype 2 vaccines and specificity of protection in a guinea pig model. J Exp Med 147(3):629-44). Las proteínas de la membrana externa, PME, se precipitaron después para producir agregados suspendidos en cloruro sódico. A pesar de los prometedores resultados en estudios con animales, estas vacunas no han inducido anticuerpos bactericidas ni en adultos ni en niños (Zollinger WD, y col. 1978. Safety and immunogenicity of a Neisseria meningitidis type 2 protein vaccine in animals and humans. J. Infect. Dis. 137(6):728-39), el mal funcionamiento de estas vacunas se atribuyó en gran medida a la pérdida de estructura terciaria que acompañó a la precipitación. Por tanto, la siguiente etapa lógica fue producir una vacuna con proteínas mostradas en su conformación nativa en forma de vesículas de la membrana externa. 1979. complex of meningococcal group B polysaccharide and type 2 outer membrane protein immunogenic in man. J. Clin. Invest. 63(5):836-48, Wang LY y Frasch CE. 1984. Development of a Neisseria meningitidis group B serotype 2b protein vaccine and evaluation in a mouse model. Infect Immun. 46(2):408-14136).
Estas vacunas en vesículas de membrana externa fueron significativamente más inmunógenas que los agregados de PME y se ha demostrado que la inmunogenicidad se reforzaba más mediante la adsorción en el adyuvante de hidróxido de aluminio (Wang LY and Frasch CE. 1984. Neisseria meningitidis group B serotype 2b protein vaccine and evaluation in a mouse model. Infect Immun. 46(2):408-14136).
Se han realizado numerosos ensayos de eficacia usando vacunas solubles de vesículas de membrana externa de diferentes formulaciones. Las dos vacunas más estudiadas se desarrollaron en la década de 1980 en respuesta a los brotes de la enfermedad en Cuba (Sierra GV y col. 1991. Vaccine against group B Neisseria meningitidis: protection trial and mass vaccination results in Cuba. NIPH Ann Dis. 14(2):195-210) y Norway (Bjune G, y col. 1991. Effect of outer membrane vesicle vaccine against group B meningococcal disease in Norway. Lancet. 338(8775):1093-6), respectivamente. La vacuna VME producida por el Finlay Institute en Cuba (comercializada como VAP-MENGOC-BC) se produce a partir de la cepa B:4:P1.19,15 con el polisacárido del serogrupo C y una preparación de PME de alto peso molecular y se absorbe en hidróxido de aluminio (Sierra GV y col. 1991. Vaccine against group B Neisseria meningitidis: protection trial and mass vaccination results in Cuba. NIPH Ann Dis. 14(2):195-210). Esta vacuna contribuyó a la rápida disminución de la epidemia en Cuba (Rodríguez AP, y col. The epidemiological impact of antimeningococcal B vaccination in Cuba. 1999. Mem Inst Oswaldo Cruz. 94(4):433-40).
La vacuna producida por el Norwegian National Institute for Public Health (NIPH) estaba, de igual modo, dirigida inicialmente para usar durante un periodo de enfermedad hiperendémica causada por otro microorganismo del clon ET-5 (B:15:P1,7, 16). También era una vacuna monovalente producida a partir de vesículas purificadas de membrana externa adsorbidas en hidróxido de aluminio (Bjune G, y col. 1991. Effect of outer membrane vesicle vaccine against group B meningococcal disease in Norway. Lancet. 338(8775):1093-6).
Parece que las vacunas de vesículas de membrana externa presentan de forma eficaz en una conformación suficientemente natural para permitir la generación de anticuerpos bactericidas funcionales, al menos en adolescentes y adultos. Asimismo, se ha mostrado que las respuestas de anticuerpo generadas incrementan la opsonofagocitosis de los meningococos. La formulación precisa de las vacunas (es decir, el contenido en PME, contenido en LPS y la presencia o ausencia de adyuvante) tiene un impacto significativo sobre la inmunogenicidad (Lehmann AK, y col. 1991. Immunization against serogroup B meningococci. Opsonin response in vaccinees as measured by chemiluminescence. APMIS. 99(8):769-72, Gomez JA, y col. 1998. Effect of adjuvants in the isotypes and bactericidal activity of antibodies against the transferrin-binding proteins of Neisseria meningitidis. Vaccine. 16(17):1633-9, Steeghs L, y col. 1999. Immunogenicity of Outer Membrane Proteins in a Lipopolysaccharide-Deficient Mutant of Neisseria meningitidis: Influence of Adjuvants on the Immune Response. Infect Immun. 67 (10):4988-93).
El perfil antigénico de los aislamientos de la enfermedad también cambia rápidamente y es probable que una vacuna con una cobertura de únicamente un número limitado de cepas seleccionadas sea ineficaz en pocos años a menos que la composición de la vacuna se modifique para reflejar la epidemiología local.
En la actualidad, las vacunas de VME se han usado más ampliamente que cualquier otra vacuna del serogrupo B y son potencialmente útiles en el contexto de los brotes de la enfermedad causados por un único...
Reivindicaciones:
1. Formulación farmacéutica que comprende la proteína que tiene la secuencia de aminoácidos tal como se describe en la SEC ID Nº 4; o codificada por una secuencia de ácido nucleico tal como se describe en la SEC ID Nº 3.
2. Formulación farmacéutica de la reivindicación 1, que se caracteriza por ser una vacuna capaz de generar en el organismo receptor una respuesta protectora contra las infecciones causadas por bacterias del género Neisseria.
3. Formulación farmacéutica de acuerdo con la reivindicación 1 o la reivindicación 2, que se caracteriza por ser una vacuna capaz de generar en el organismo receptor una respuesta protectora contra las infecciones causadas por bacterias del género Neisseria meningitidis.
4. Formulación farmacéutica de acuerdo con la reivindicación 1 o la reivindicación 2, que se caracteriza por ser una vacuna capaz de generar en el organismo receptor una respuesta protectora contra las infecciones causadas por bacterias del género Neisseria gonorrhoeae.
5. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-4, que se caracteriza por ser una formulación profiláctica o terapéutica.
6. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-4, que se caracteriza por ser una formulación combinada que contiene uno o varios antígenos de diferente naturaleza antigénica.
7. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-4, que se caracteriza porque contiene antígenos polisacáridos.
8. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-4, que se caracteriza porque uno de los componentes de la formulación es un polisacárido capsular de N. meningitidis.
9. Formulación farmacéutica de acuerdo con la reivindicación 5, que se caracteriza porque contiene un conjugado polisacárido-proteína, en el que el resto polisacárido corresponde a un polisacárido bacteriano.
10. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-4, que se caracteriza porque contiene uno o varios microorganismos inactivados.
11. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-4, que se caracteriza porque contiene antígenos peptídicos.
12. Formulación farmacéutica de acuerdo con la reivindicación 1 ó 2, que se caracteriza porque contiene hormonas.
13. Formulación farmacéutica de acuerdo con la reivindicación 1 ó 2, que se caracteriza porque contiene factores de crecimiento.
14. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-13, que se caracteriza por ser una formulación para administrar por vía parental.
15. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-13, que se caracteriza por ser una formulación para administrar por vía mucosa.
16. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-13, que se caracteriza por ser una formulación para administrar por vía oral.
17. Formulación farmacéutica de acuerdo con una cualquiera de las reivindicaciones 1-16, que se caracteriza por ser una formulación inmunoestimulante o inmunopotenciadora.
18. Formulación farmacéutica que se caracteriza porque contiene péptidos de la proteína definida en la reivindicación 1, que tiene la secuencia de aminoácidos como se describe en la SEC ID Nº 4; o codificada por una secuencia de ácido nucleico como se describe en la SEC ID Nº 3, en la que dichos péptidos son capaces de generar en el organismo receptor una respuesta protectora contra las infecciones causadas por bacterias del género Neisseria.
19. Formulación farmacéutica que comprende un organismo modificado genéticamente, que se caracteriza porque contiene el gen que tiene la secuencia de bases identificada en la lista de secuencias como SEC ID Nº 3 y que codifica la proteína que tiene la secuencia de aminoácidos identificada en la lista de secuencias como SEC ID Nº 4, o parte de ella, en la que dicha parte es capaz de generar en el organismo receptor una respuesta protectora contra las infecciones causadas por bacterias del género Neisseria, sola o incluida en otra secuencia génica, en la que la formulación comprende el organismo genéticamente modificado vivo, atenuado, o una preparación del mismo.
20. Formulación farmacéutica que se caracteriza porque contiene la proteína NMB1125, identificada en la lista de secuencias como SEC ID Nº 4 o codificada por el gen que tiene la secuencia de bases de la SEC ID Nº 3, como portador de antígenos de diversa naturaleza.
21. Uso de la proteína NMB1125, identificada en la lista de secuencias como SEC ID Nº 4 o codificada por el gen que tiene la secuencia de bases de la SEC ID Nº 3, para la detección, sola o en presencia de otros componentes, de la enfermedad meningocócica en seres humanos.
22. Uso del gen que tiene la secuencia de bases de la SEC ID Nº 3 y que codifica la proteína NMB1125 identificada en la lista de secuencias como SEC ID Nº 4, para detección, sola o en presencia de otros componentes, de la enfermedad meningocócica en seres humanos.
Patentes similares o relacionadas:
Nuevas composiciones inmunogénicas para la prevención y tratamiento de enfermedad meningocócica, del 11 de Marzo de 2020, de WYETH HOLDINGS LLC: Una composición que comprende al menos una proteína que comprende una secuencia de aminoácidos que tiene identidad de secuencia mayor de 80 % con la […]
Vacunas de polipéptidos para protección amplia contra linajes meningocócicos hipervirulentos, del 18 de Diciembre de 2019, de GLAXOSMITHKLINE BIOLOGICALS SA: NadA de N.meningitidis recombinante en forma trimérica, en donde la NadA consiste de la secuencia de aminoácidos de la SEQ ID NO: 2.
Polipéptidos de fHbp meningocócicos modificados, del 16 de Agosto de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Un polipéptido que comprende una secuencia de aminoácidos que tiene al menos un 80 % de identidad de secuencia con la SEQ ID NO: 5, en el […]
Variante FHBP de Neisseria meningitidis y su uso para vacunación, del 3 de Julio de 2019, de Oxford University Innovation Limited: Una fHbp V2 modificada que tiene elevada estabilidad con respecto a fHbp V2 natural, en donde la fHbp V2 modificada tiene al menos 95 % de identidad con […]
Variantes no lipidadas de antígenos ORF2086 de Neisseria meningitidis, del 3 de Abril de 2019, de WYETH LLC: Una composición que comprende un polipéptido ORF2086 no lipidado no piruvilado aislado en la que el polipéptido comprende la secuencia de aminoácidos SEQ ID NO: 19, en la […]
Polipéptidos de FHPP meningocócicos, del 27 de Marzo de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Un polipéptido que comprende una secuencia de aminoácidos que tiene al menos 97% de identidad con la SEQ ID NO: 76.
Polipéptidos de fusión inmunogénicos, del 15 de Octubre de 2018, de PFIZER INC.: Un polipéptido aislado que comprende la secuencia de un polipéptido transportador, en el que el polipéptido transportador es un citolisoide, ligado operativamente […]
Composición inmunogénica o vacuna contra infección o enfermedad bacteriana gramnegativa, por ejemplo, por Neisseria, del 24 de Enero de 2018, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una vacuna para su uso en el tratamiento o prevención de una infección o enfermedad por bacterias gramnegativas que comprende: (I) un primer antígeno […]