NUEVAS FORMAS CRISTALINAS DEL COMPUESTO ANTICANCERIGENO ZD1839.
Una forma cristalina del compuesto de la Fórmula I
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB03/00794.
Solicitante: ASTRAZENECA AB.
Nacionalidad solicitante: Suecia.
Dirección: ASTRAZENECA AB00699188100649-1X EP,151 85 SODERTALJE.
Inventor/es: BOHLIN, MARTIN, GILDAY,JOHN,PETER, GRAHAM,ANTHONY,STEPHEN, YMEN,BO,INGVAR.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K31/517 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinazolina, perimidina.
- A61K47/38 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Celulosa; Sus derivados.
- A61K9/28H6B
- C07D239/94 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 239/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,3 o diazina-1,3 hidrogenada. › Atomos de nitrógeno.
Clasificación PCT:
- A61K31/517 A61K 31/00 […] › condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinazolina, perimidina.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07D239/94 C07D 239/00 […] › Atomos de nitrógeno.
Clasificación antigua:
- A61K31/517 A61K 31/00 […] › condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinazolina, perimidina.
- A61P35/00 A61P […] › Agentes antineoplásicos.
- C07D239/94 C07D 239/00 […] › Atomos de nitrógeno.
Fragmento de la descripción:
Nuevas formas cristalinas del compuesto anticancerígeno ZD1839.
La presente invención se refiere a formas cristalinas particulares de un compuesto farmacéutico, a procedimientos para su preparación, a su uso en la purificación de un compuesto farmacéutico, a composiciones farmacéuticas que los comprenden y a su uso en terapia.
La Solicitud Internacional de Patente WO 96/33980 describe en el Ejemplo 1 el compuesto 4-(3'-cloro-4'-fluoroanilino)-7-metoxi-6-(3-morfolinopropoxi)quinazolina. Ese compuesto es un inhibidor de la familia del receptor del factor de crecimiento epidérmico (EGFR) de enzimas de tirosina quinasa tal como erbB1 y posee actividad anti-proliferativa tal como actividad anti-cancerígena y, por consiguiente, es útil en métodos de tratamiento de una enfermedad proliferativa tal como cáncer en el cuerpo humano o animal.
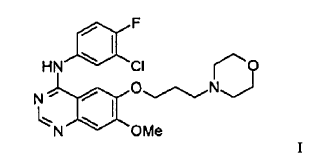
Ese compuesto tiene la estructura de la Fórmula I

y se conoce ahora como Iressa (marca de fábrica registrada) y gefitinib (Nombre Adoptado en Estados Unidos) y por medio del número de código ZD1839 y del número de registro del CAS 184475-35-2.
El objeto del Ejemplo 1 de la Solicitud de Patente Internacional WO 96/33980 describe la preparación del compuesto de Fórmula I que, después de la purificación por cromatografía de columna sobre sílice usando una mezcla 4:1 de acetato de etilo y metanol como eluyente y recristalización de tolueno, se indica que tiene un p.f. de 119-120ºC. El objeto del Ejemplo 10 de esa solicitud de patente describe una vía de síntesis alternativa del compuesto de la Fórmula I que implica la purificación mediante cromatografía de columna sobre sílice usando una mezcla 9:1 de cloruro de metileno y metanol como eluyente y recristalización de tolueno. No hay una descripción específica ni en el Ejemplo 1 ni en el 10 de la Solicitud Internacional de Patente WO 96/33980 de si el compuesto de la Fórmula I es cristalino o amorfo. Además, no hay una descripción específica en esos ejemplos de si el compuesto puede existir en forma solvatada.
En la Solicitud Internacional de Patente WO 96/33980 se indica que los derivados de quinazolina descritos en ella pueden existir en forma solvatada o sin solvatar tales como, por ejemplo, formas hidratadas y que la invención descrita en ella abarca todas las formas solvatadas que poseen actividad antiproliferativa. Sin embargo, se describen formas hidratadas particulares y no se describen solvatos particulares.
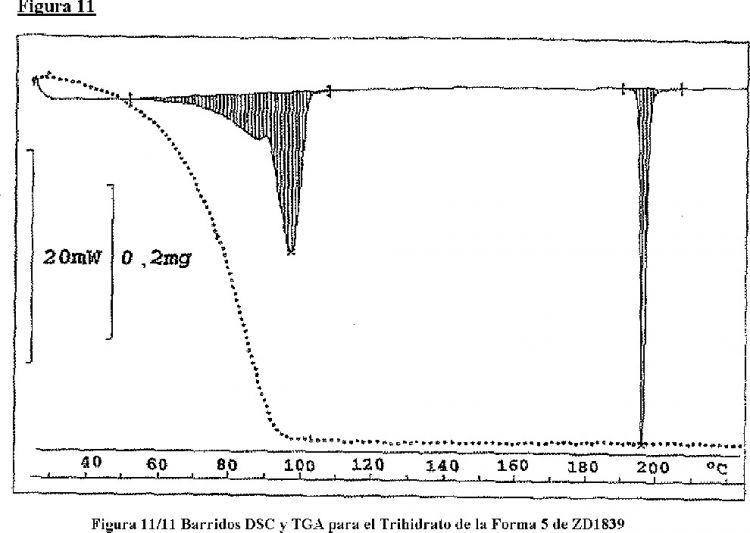
La solicitante ha encontrado que algunas formas del compuesto de Fórmula I que incluyen algunos de sus solvatos son materiales cristalinos que poseen propiedades ventajosas.
Una forma cristalina particular de un compuesto puede tener propiedades físicas que difieren de las de cualquier otra forma cristalina o amorfa y tales propiedades pueden tener una marcada influencia sobre el procesado químico y farmacéutico del compuesto, particularmente cuando el compuesto se prepara o se usa a escala comercial. Por ejemplo, cada forma cristalina de un compuesto puede mostrar diferencias en las propiedades físicas tales como el tamaño y forma cristalina, punto de fusión, densidad, higroscopicidad y estabilidad. Tales diferencias pueden alterar las propiedades de manipulación mecánica del compuesto (tales como las características de flujo del material sólido) y las características de compresión del compuesto. Las diferentes formas cristalinas de un compuesto pueden tener diferentes estabilidades termodinámicas. En general, la forma más estable, por ejemplo la fase polimórfica más estable, es la forma física más adecuada para la formulación y procesado a escala comercial.
Por ejemplo, puede haber problemas en el procesado de una forma menos estable, por ejemplo un polimorfo menos estable. Las fuerzas de compresión, tales como las que se usan en procedimientos de formación de comprimidos podrían convertir algo de una forma menos estableen una forma más estable dando como resultado el crecimiento de cristales de la forma más estable en el producto formulado. Esto podría ser indeseable por que cualquier procedimiento tal de cristalización podría afectar a la integridad del comprimido dando como resultado un comprimido friable de resistencia de comprimido disminuida. Además, si estuviera presente una mezcla variable de dos tales formas, la velocidad de disolución y biodisonibilidad del /de los compuesto(s) activo(s) podría ser variable ya que, por ejemplo, cada forma podría tener un tamaño de partícula diferente. Es bien conocido que el tamaño de partícula puede ejercer efecto sobre la velocidad de disolución y biodisponibilidad de un compuesto farmacéuticamente activo. La calidad del producto podría por lo tanto verse afectada indeseablemente.
Además, se prefiere que los compuestos farmacéuticos en forma de cápsulas o comprimidos se preparen usando la forma más estable, por ejemplo el polimorfo más estable, y no una mezcla de formas o fase metaestable ya que hay un requerimiento para demostrar a las autoridades reguladoras apropiadas que la composición del compuesto está controlada y es estable. Si estuviera presente en un comprimido una forma termodinámicamente menos estable, por ejemplo un polimorfo menos estable, solo o en mezcla con una forma termodinámicamente más estable, sería muy difícil controlar la composición del comprimido, por ejemplo la composición polimórfica del comprimido, ya que la cantidad de la forma termodinámicamente estable podría tender a aumentar durante el almacenamiento.
De acuerdo con esto, estos factores pueden tener un impacto sobre las formulaciones en cápsula, comprimido o fase sólida del compuesto y sobre sus formulaciones en suspensión.
Se ha realizado un estudio de las propiedades del compuesto de la Fórmula I para descubrir si es posible la formación de polimorfismo y/o formación de solvato. Se han investigado una amplia variedad de disolventes de recristalización de varias polaridades. Para la mayoría de estos disolventes, solo se obtuvo una forma cristalina única no solvatada del compuesto de la Fórmula I, que se designa de ahora en adelante polimorfo de Forma 1 de ZD1839. También se identificaron como de interés dos solvatos. El primer solvato se produjo en presencia de metanol y se designa de ahora en adelante en la presente memoria solvato de Forma 2 de ZD1839 con MeOH y el segundo solvato se produjo con sulfóxido de dimetilo y se designa de ahora en adelante en la presente memoria solvato de Forma 3 de ZD1839 con DMSO. También se ha encontrado un trihidrato, designado de ahora en adelante en la presente memoria trihidrato de la Forma 5 de ZD1839.
En particular, se ha encontrado ahora que el solvato de Forma 3 de ZD1839 es cristalina y que, sorprendentemente tiene propiedades ventajosas.
Además, se ha descubierto que el solvato de Forma 3 de ZD1839 con DMSO es inusual y posee una forma física cristalina que se aísla fácilmente y que es también muy estable. Además, este solvato puede prepararse fácilmente a escala comercial con un nivel elevado de pureza y con un elevado rendimiento. Además, este solvato puede convertirse fácilmente al compuesto de Fórmula I, en particular al compuesto de Fórmula I en la forma del polimorfo Forma 1 de ZD 1839. En conjunto, la inclusión de las etapas de preparación de solvato DMSO, su purificación y conversión de vuelta al compuesto de fórmula I es beneficiosa en términos de rendimiento y pureza del compuesto de Fórmula I.
De acuerdo con un aspecto de la presente invención se proporciona una forma cristalina del compuesto de Fórmula I

que tiene al menos 80% del compuesto de la Fórmula I en forma de Forma 3 ZD 1839 solvato DMSO y en el que el grado de cristalinidad es mayor que aproximadamente 80%.
De acuerdo con otro aspecto de la presente invención, se proporciona una forma cristalina del compuesto de la Fórmula I que tiene al menos 80% del compuesto de la Fórmula I en forma de Forma 3 ZD 1839 solvato DMSO y menos de 20% del compuesto de la Fórmula I está en forma de cualquier otro solvato ZD1839 o cualquier polimorfo Forma 1 de ZD 1839.
Cuando se indica que la presente invención se refiere a la forma cristalina del compuesto de la Fórmula I, el grado de cristalinidad determinado mediante datos de difracción de rayos X en polvo es convenientemente mayor que 80%, preferiblemente...
Reivindicaciones:
1. Una forma cristalina del compuesto de la Fórmula I
que tiene al menos 80% del compuesto de la Fórmula I en forma de solvato de Forma 3 de ZD1839 con DMSO y en el que el grado de cristalinidad es mayor que aproximadamente 80%.
2. El solvato según la reivindicación 1, caracterizado por un patrón de difracción de rayos X que tiene picos característicos a aproximadamente 8,9, 17,8, 22,6 y 23,2º en la escala 2?.
3. El solvato según la reivindicación 1, caracterizado por un patrón de difracción de rayos X sustancialmente como se muestra en la Figura 7.
4. El solvato según la reivindicación 1, caracterizado por un punto de desolvatación en el intervalo de aproximadamente 127ºC a 132ºC.
5. El solvato según la reivindicación 1, caracterizado por uno o ambos del termograma de Calorimetría de Barrido Diferencial y la representación gráfica del Análisis Termogravimétrico como se muestra en la Figura 8.
6. El solvato según la reivindicación 1, caracterizado por un espectro por Transformada de Fourier de Infrarrojos de Reflectancia Difusa con picos que se distinguen a aproximadamente 1640, 1520, 1450, 880 y 560 cm-1.
7. El solvato según la reivindicación 1, caracterizado por espectro por Transformada de Fourier de Infrarrojos de Reflectancia Difusa sustancialmente como se muestra en la Figura 9.
8. Una forma cristalina del compuesto de la Fórmula I según la reivindicación 1, que tiene al menos 80% del compuesto de la Fórmula I en forma del solvato de Forma 3 de ZD1839 con DMSO y menos de 20% del compuesto de la Fórmula I está en forma de cualquier otro solvato ZD1839 o cualquier polimorfo de la Forma 1 de ZD1839.1
9. El solvato de Forma 3 de ZD1839 con DMSO según una cualquiera de las reivindicaciones 1 a 8, en donde el grado de cristalinidad es mayor que aproximadamente 90%.
10. El solvato de Forma 3 de ZD1839 con DMSO según una cualquiera de las reivindicaciones 1 a 8, en donde el grado de cristalinidad es mayor que aproximadamente 95%.
11. Un procedimiento para preparar una forma cristalina del compuesto de la Fórmula I que tiene al menos 80% del compuesto de la Fórmula I en forma del solvato de Forma 3 de ZD1839 con DMSO según la reivindicación 1, que comprende:
12. Una forma cristalina del compuesto de la Fórmula I

que tiene al menos 80% del compuesto de la Fórmula I en forma de solvato de la Forma 2 de ZD1839 con MeOH y en el que el grado de cristalinidad es mayor que aproximadamente 80%.
13. El solvato según la reivindicación 12, caracterizado por un patrón de difracción de rayos X que tiene picos característicos a aproximadamente 6,5, 10,0 y 13-2º en la escala 2?.
14. El solvato según la reivindicación 12, caracterizado por un patrón de difracción de rayos X sustancialmente como se muestra en la Figura 4.
15. El solvato según la reivindicación 12, caracterizado por un punto de desolvatación en el intervalo de aproximadamente 125ºC a 130ºC.
16. El solvato según la reivindicación 12, caracterizado por uno o ambos del termograma de Calorimetría de Barrido diferencial y la representación gráfica del Análisis Termogravimétrico como se muestra en la Figura 5.
17. El solvato según la reivindicación 12, caracterizado por un espectro por Transformada de Fourier de Infrarrojos de Reflectancia Difusa con picos que se distinguen a aproximadamente 3380, 1650, 1530,1450, 1235, 870 y 570 cm-1.
18. El solvato según la reivindicación 12, caracterizado por espectro por Transformada de Fourier de Infrarrojos de Reflectancia Difusa sustancialmente como se muestra en la Figura 6.
19. Una forma cristalina del compuesto de la Fórmula I según la reivindicación 12, que tiene al menos 80% del compuesto de la Fórmula I en forma del solvato de la Forma 2 de ZD1839 con MeOH y menos de 20% del compuesto de la Fórmula I está en forma de cualquier otro solvato ZD1839 o cualquier polimorfo de la Forma 1 de ZD1839.1
20. El solvato de la Forma 2 de ZD1839 con MeOH según una cualquiera de las reivindicaciones 12 a 19, en donde el grado de cristalinidad es mayor que aproximadamente 90%.
21. El solvato de la Forma 2 de ZD1839 con MeOH según una cualquiera de las reivindicaciones 12 a 19, en donde el grado de cristalinidad es mayor que aproximadamente 95%.
22. Un procedimiento para preparar una forma cristalina del compuesto de la Fórmula I que tiene al menos 80% del compuesto de la Fórmula I en forma de la Forma 2 ZD1839 solvato DMSO según la reivindicación 12, que comprende:
23. Un procedimiento para la preparación del compuesto de Fórmula I
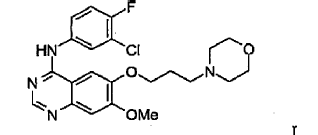
que tiene al menos 80% del compuesto de la Fórmula I en forma del polimorfo de la Forma 1 de ZD1839 que está caracterizado por un patrón de difracción de rayos X que tiene picos característicos a aproximadamente 7,0, 11,2, 15,8, 19,3, 24,0 y 26,3º en la escala 2?, y/o por un punto de fusión en el intervalo de aproximadamente 194ºC a 198ºC y/o por un espectro por Transformada de Fourier de Infrarrojos de Reflectancia Difusa con picos que se distinguen a aproximadamente 3400, 1630, 1525, 1245 y 840 cm-1 que comprende:
24. Un procedimiento para la preparación del compuesto de Fórmula I
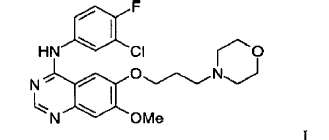
que tiene al menos 80% del compuesto de la Fórmula I en forma del polimorfo de la Forma 1 de ZD1839 que está caracterizado por un patrón de difracción de rayos X que tiene picos característicos a aproximadamente 7,0, 11,2, 15,8, 19,3, 24,0 y 26,3º en la escala 2?, y/o por un punto de fusión en el intervalo de aproximadamente 194ºC a 198ºC y/o por un espectro por Transformada de Fourier de Infrarrojos de Reflectancia Difusa con picos que se distinguen a aproximadamente 3400, 1630, 1525, 1245 y 840 cm-1 que comprende:
25. Un compuesto altamente cristalino de la Fórmula I
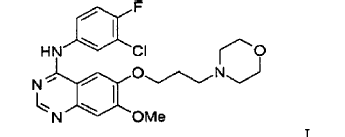
que tiene al menos 80% del compuesto de la Fórmula I en forma del trihidrato de ka forma 5 de ZD1839 y en el que el grado de cristalinidad es mayor que aproximadamente 80%.
26. El trihidrato de la Forma 5 de ZD1839 según la reivindicación 25, caracterizado por un patrón de difracción de rayos X que tiene picos característicos a aproximadamente 6,1, 7,1 y 25,7º en la escala 2?.
27. El trihidrato de la Forma 5 de ZD1839 según la reivindicación 25, caracterizado por un patrón de difracción de rayos X que tiene picos característicos a aproximadamente 6,1, 7,1, 9,3, 14,2, 18,5, 18,8, 19,8, 22,3, 23,3, 24,7 y 25,7º en la escala 2?.
28. El trihidrato de la Forma 5 de ZD1839 según la reivindicación 25, caracterizado por un patrón de difracción de rayos X sustancialmente como se muestra en la Figura 10.
29. El trihidrato de la Forma 5 de ZD1839 según la reivindicación 25, caracterizado por un termograma de Calorimetría de Barrido Diferencial que tiene una primera endoterma con un pico a aproximadamente 100ºC y una segunda endoterma con un pico a aproximadamente 194ºC a 198ºC.
30. El trihidrato de la Forma 5 de ZD1839 según la reivindicación 25, caracterizado por uno o ambos del termograma de Calorimetría de Barrido diferencial y la representación gráfica del Análisis Termogravimétrico como se muestra en la Figura 11.
31. El trihidrato de la Forma 5 de ZD1839 según la reivindicación 25, que tiene al menos 80% del compuesto de la Fórmula I en forma del trihidrato de la Forma 5 de ZD1839 y menos del 20% del compuesto de la Fórmula I está en la forma de cualquier otro solvato ZD1839 o cualquier otra forma cristalina de ZD1839.
32. El trihidrato de la Forma 5 de ZD1839 según una cualquiera de las reivindicaciones 25 a 31, en donde el grado de cristalinidad es mayor que aproximadamente 90%.
33. El trihidrato de la Forma 5 de ZD1839 según una cualquiera de las reivindicaciones 25 a 31, en donde el grado de cristalinidad es mayor que aproximadamente 95%.
34. Un procedimiento para preparar una forma cristalina del compuesto de la Fórmula I que tiene al menos 80% del compuesto de la Fórmula I en forma del trihidrato de la Forma 5 de ZD1839 según la reivindicación 25, que comprende:
35. Un procedimiento para cristalizar un compuesto de la Fórmula I que tiene al menos 80% del compuesto de la Fórmula I en forma del trihidrato de la Forma 5 de ZD1839 según la reivindicación 25, que comprende las etapas de:
36. Un procedimiento para la preparación de un compuesto de Fórmula I
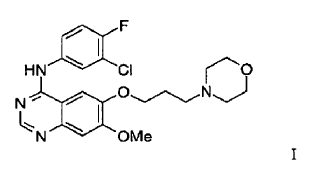
que tiene al menos 80% del compuesto de la Fórmula I en forma del polimorfo de la Forma 1 de ZD1839 que está caracterizado por un patrón de difracción de rayos X que tiene picos característicos a aproximadamente 7,0, 11,2, 15,8, 19,3, 24,0 y 26,3º en la escala 2?, y/o por un punto de fusión en el intervalo de aproximadamente 194ºC a 198ºC y/o por un espectro por Transformada de Fourier de Infrarrojos de Reflectancia Difusa con picos que se distinguen a aproximadamente 3400, 1630, 1525, 1245 y 840 cm-1 que comprende:
37. Un procedimiento para la preparación del compuesto de Fórmula I
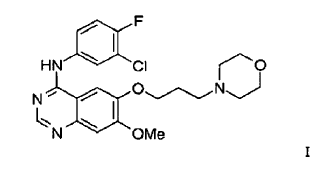
que tiene al menos 80% del compuesto de la Fórmula I en forma del polimorfo de la Forma 1 de ZD 1839, que está caracterizado por un patrón de difracción de rayos X que tiene picos característicos a aproximadamente 7,0, 11,2, 15,8, 19,3, 24,0 y 26,3º en la escala 2?, y/o por un punto de fusión en el intervalo de aproximadamente 194ºC a 198ºC y/o por un espectro de Transformada de Fourier de Infrarrojos de Reflectancia Difusa con picos que se distinguen a aproximadamente 3400, 1630, 1525, 1245 y 840 cm-1 que comprende calentar el compuesto de Fórmula I que tiene al menos 80% del compuesto de la Fórmula I en forma del trihidrato de la Forma 5 de ZD1839 como se define en la reivindicación 25 durante un tiempo suficiente y a una temperatura suficiente para eliminar el agua y efectuar la transformación al polimorfo de la Forma 1 de ZD1839.
38. Una composición farmacéutica que comprende la forma cristalina del compuesto de la Fórmula I según una cualquiera de las reivindicaciones 1, 12 o 25 y un vehículo o diluyente farmacéuticamente aceptable.
39. Una composición farmacéutica composición según la reivindicación 38 que está adaptada para la administración oral.
40. Una composición farmacéutica según la reivindicación 38, que comprende una suspensión en un medio acuoso de un compuesto de Fórmula I que tiene al menos 80% del compuesto de la Fórmula I en forma del trihidrato de la Forma 5 de ZD1839 como se define en la reivindicación 25.
Patentes similares o relacionadas:
Derivados de quinazolina, composiciones de los mismos y uso como productos farmacéuticos., del 26 de Febrero de 2020, de Shanghai Fochon Pharmaceutical Co. Ltd: Un compuesto o sales farmacéuticamente aceptables del mismo, en el que el compuesto es (R,E)-N-(4-(3-cloro-4-fluorofenilamino)-7-etoxiquinazolin-6-il)-4-(2-(metoximetil)azetidin-1-il)but-2-enamida.
Procedimiento de preparación de clorhidrato de 1-(4-(4-(3,4-dicloro-2-fluorofenilamin)-7-metoxiquinazolin-6- iloxi)piperidin-1-il)-prop-2-en-1-ona y productos intermedios usados en el mismo, del 8 de Enero de 2020, de Hanmi Science Co., Ltd. (100.0%): Un método de preparación de un clorhidrato de 1-(4-(4-(3,4-dicloro-2-fluorofenilamin)-7-metoxiquinazolin-6- iloxi)piperidin-1-il)-prop-2-en-1-ona de fórmula […]
Sales de derivado de quinazolina y método de preparación de las mismas, del 25 de Diciembre de 2019, de Chai Tai Tianqing Pharmaceutical Group Co., Ltd: Un maleato de un compuesto de Fórmula I, **(Ver fórmula)** El maleato del compuesto de Fórmula I de acuerdo con la reivindicación 1, en donde una proporción molar del compuesto […]
Modulación de receptores quimiosensoriales y ligandos asociados con los mismos, del 26 de Noviembre de 2019, de SENOMYX INC.: Un compuesto que tiene la fórmula estructural (IIIb1)**Fórmula** o una sal, tautómero, solvato o éster del mismo, en donde A es acilo, acilo sustituido, heteroalquilo, […]
Quinazolinas sustituidas con sulfoximina para composiciones farmacéuticas, del 14 de Agosto de 2019, de Evotec International GmbH: Un compuesto de fórmula (I)**Fórmula** en la que Ar se selecciona del grupo que consiste en:**Fórmula** y en las que X es CH o N; […]
Cristales de dimaleato de un compuesto de crotilo de quinazolina y métodos de preparación y usos de los mismos, del 14 de Agosto de 2019, de Hangzhou Huadong Medicine Group Biopharmaceutical Co., Ltd: Una forma cristalina K del dimaleato del compuesto de fórmula I,**Fórmula** el patrón de difracción de rayos X en polvo (radiación CuKa) […]
Quinazolinas como inhibidores de los canales iónicos de potasio, del 7 de Agosto de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmulas (Ib) o (Ic)**Fórmula** o un enantiómero, un diastereómero, un tautómero o una sal de los mismos, para su uso en terapia en combinación con […]
Derivados de quinazolina usados para tratar el VIH, del 4 de Junio de 2019, de GILEAD SCIENCES, INC.: Un compuesto de fórmula (I):**Fórmula** en la que Q es**Fórmula** X1, X2 y X3 son cada uno independientemente N o C(R11), siempre […]