COMPOSICIONES FARMACEUTICAS DE MEDICAMENTOS CON ESTRUCTURA SEMIORDENADA Y DE POLIMERO.
Composición que comprende:
a) un sólido que comprende un medicamento de baja solubilidad y un polímero potenciador de la concentración;
b) dicho polímero potenciador de la concentración estando presente en dicha composición en una cantidad suficiente para que dicha composición proporcione una concentración intensificada de dicho medicamento de baja solubilidad en un entorno de uso en comparación con una primera composición de control que se compone esencialmente de una mezcla de una cantidad equivalente de dicho medicamento en forma cristalina y una cantidad equivalente de dicho polímero potenciador de la concentración; y
c) donde al menos una parte de dicho medicamento está presente en regiones ricas en medicamento y dichas regiones ricas en medicamento se entremezclan entre todas las regiones pobres en medicamento, ricas en polímero, y donde al menos un 20% en peso de dicho medicamento de baja solubilidad se encuentra en un estado semiordenado
Tipo: Resumen de patente/invención. Número de Solicitud: W03003465IB.
Solicitante: BEND RESEARCH, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 64550 RESEARCH ROAD,BEND, OR 97701-8599.
Inventor/es: FRIESEN,DWAYNE THOMAS BEND RESEARCH INC, SHANKER,RAVI,MYSORE,PFIZER GLOBAL R. & D, BABCOCK,WALTER CHRISTIAN,BEND RESEARCH,INC, CALDWELL,WILLIAM BRETT,BEND RESEARCH,INC, CREW,MARSHALL DAVID,BEND RESEARCH,INC, SMITHEY,DANIEL TOD,BEND RESEARCH,INC.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K9/14H6
- A61K9/16H6B
- A61K9/16P4
Clasificación PCT:
- A61K9/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/16 A61K 9/00 […] › Aglomerados; Granulados; Microbolitas.
Clasificación antigua:
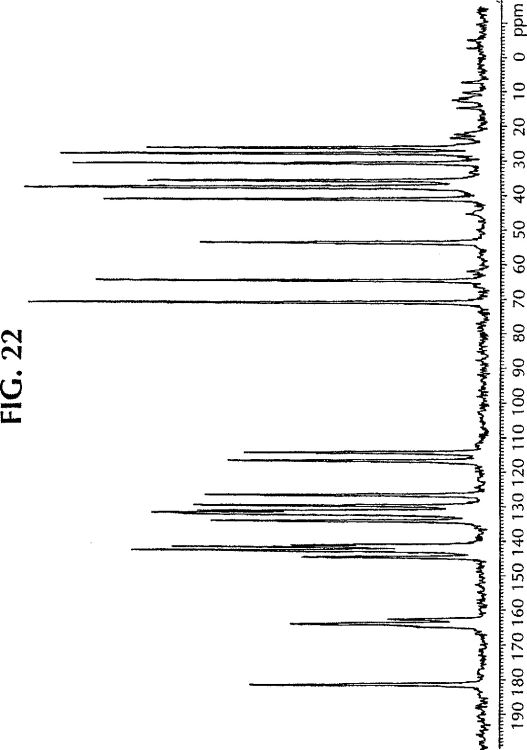
Fragmento de la descripción:
Composiciones farmacéuticas de medicamentos con estructura semiordenada y de polímero.
Antecedentes de la invención
La invención se refiere a composiciones farmacéuticas de un medicamento en un estado semiordenado y a un polímero que mejora la estabilidad del medicamento y aumenta la concentración del mismo en el entorno de su utilización.
A menudo, los medicamentos de baja solubilidad presentan escasa biodisponibilidad o una absorción irregular, viéndose afectado tal grado de irregularidad por factores tales como el nivel de dosificación, el estado nutricional del paciente y la forma del medicamento. El incremento de la biodisponibilidad de los medicamentos de baja solubilidad ha sido objeto de amplias investigaciones. El incremento de la biodisponibilidad depende del incremento de la concentración del medicamento disuelto en solución para mejorar la absorción.
Es bien sabido que, para un medicamento de baja solubilidad que es capaz de existir en forma cristalina o amorfa, la forma amorfa puede proporcionar temporalmente una mayor concentración acuosa del fármaco en comparación con la concentración de equilibrio obtenida mediante la disolución de la forma cristalina del medicamento en su entorno. Estas formas amorfas pueden estar compuestas por el fármaco amorfo solo, por una dispersión del medicamento en un material de matriz o por el fármaco adsorbido en un sustrato. Se piensa que estas formas amorfas del medicamento pueden disolverse más rápidamente que la forma cristalina, disolviéndose a menudo más rápidamente que el medicamento puede precipitar o cristalizar a partir de la solución. Como consecuencia, la forma amorfa puede proporcionar temporalmente una concentración mayor que la de equilibrio del fármaco.
Aunque estas formas amorfas puedan generar temporalmente una mayor concentración del medicamento en el entorno en que se usa, sin embargo la mayor concentración a menudo dura poco tiempo. Típicamente, la concentración de fármaco inicialmente mejorada es sólo temporal y vuelve rápidamente a la concentración de equilibrio, más baja.
Una aproximación para aumentar la biodisponibilidad de los medicamentos de baja solubilidad implica la formación de dispersiones amorfas de los medicamentos con polímeros. Ejemplos donde se trata de aumentar la concentración del fármaco mediante la formación de una dispersión del medicamento con un polímero incluyen la patente de Estados Unidos de Nakamichi y col. Nº 5.456.923 y la EP 0901786A2 de Curatolo y col.
Un problema derivado del uso de la forma amorfa de un fármaco es que el medicamento sólido puede no ser físicamente estable en la forma amorfa. A menudo, la forma cristalina del medicamento tiene una energía libre más baja y, por tanto, con el tiempo, el fármaco amorfo tenderá a cristalizar. La velocidad de cristalización puede verse influida por las condiciones de almacenamiento, tales como temperatura y humedad, así como por los constituyentes de la composición.
De forma similar, una dispersión amorfa sólida del polímero y del medicamento puede ser en algunos casos inestable, debido a la inestabilidad de la dispersión o del fármaco mismo. Por ejemplo, la dispersión puede ser físicamente inestable, provocando que el medicamento amorfo se separe de la dispersión. Una vez se ha separado el medicamento de la dispersión, entonces puede ser susceptible de cristalización. Alternativamente, el fármaco en la dispersión amorfa puede ser químicamente inestable. El fármaco puede degradarse con el tiempo a niveles de temperatura y humedad moderados o el medicamento puede reaccionar con otros constituyentes de la dispersión, lo que resulta en una disminución de la potencia y en un aumento de las impurezas asociadas al medicamento.
En consecuencia, sigue siendo deseable una composición que comprenda un medicamento en una forma que sea física y/o químicamente estable en condiciones típicas de almacenamiento, que se pueda obtener mediante condiciones de procesamiento prácticas y que pueda aumentar la disolución y/o biodisponibilidad de los medicamentos poco solubles. Estas necesidades y otras que se evidenciarán a un especialista son satisfechas por la presente invención, lo que se resume y describe detalladamente a continuación.
Breve sumario de la invención
En un aspecto, la presente invención se refiere a composiciones que comprenden:
- a) un sólido que comprende un medicamento de baja solubilidad y un polímero que incrementa la concentración;
- b) dicho polímero potenciador de la concentración estando presente en dicha composición en una cantidad suficiente para que dicha composición proporcione una concentración intensificada de dicho medicamento de baja solubilidad en su entorno de uso en comparación con una primera composición de control que se compone esencialmente de una mezcla de una cantidad equivalente de dicho medicamento en forma cristalina y una cantidad equivalente de dicho polímero potenciador de la concentración; y
- c) donde al menos una parte de dicho medicamento está presente en regiones ricas en medicamento y dichas regiones ricas en medicamento se entremezclan en todas las regiones pobres en medicamento, ricas en polímero y en la que al menos un 20% en peso de dicho medicamento de baja solubilidad se encuentra en un estado semiordenado.
En una realización preferente, la composición proporciona una estabilidad mejorada con respecto a una segunda composición de control que se compone esencialmente de una dispersión amorfa sólida de una cantidad equivalente de dicho medicamento y una cantidad equivalente de dicho polímero potenciador de la concentración, donde dicho medicamento en dicha segunda composición de control es al menos en un 90% en peso amorfo.
En una realización preferente, el medicamento en dicha composición presenta al menos uno de:
- a) un modelo de difracción de rayos X en polvo que es distinto del modelo de difracción de rayos X en polvo de dicha primera composición de control, donde al menos un pico presente en dicho modelo de difracción de dicha primera composición de control no está presente en dicho modelo de difracción de dicho medicamento en dicha composición;
- b) un modelo de difracción de rayos X en polvo que tiene al menos un pico que tiene un ancho total a media altura de al menos 1,1 vez el de un pico equivalente mostrado por dicho medicamento en dicha primera composición de control;
- c) una temperatura de transición vítrea que es distinta de la temperatura de transición vítrea de dicha segunda composición de control; y
- d) un comienzo o máximo en la endotermia de fusión que se encuentra a una temperatura inferior que el comienzo o máximo en la endotermia de fusión de dicho medicamento en dicha primera composición de control.
En otra realización preferente, la composición comprende desde aproximadamente un 20% en peso hasta aproximadamente un 70% en peso de medicamento.
En otra realización preferente, al menos un 40% en peso de dicho medicamento en dicha composición se encuentra en dicho estado semiordenado.
En otra realización preferente, dicho medicamento comprende una pluralidad de partículas, preferentemente comprendiendo dichas partículas las citadas regiones ricas en medicamento, con un tamaño característico inferior a aproximadamente 100 nm.
En todavía otra realización preferente, al menos un 50% en peso de dichas partículas son todas inferiores a aproximadamente 100 µm de diámetro.
En todavía otra realización preferente, la concentración mejorada se caracteriza por al menos uno de:
- a) una concentración disuelta máxima de dicho medicamento en dicho entorno de uso que es al menos de 1,25 veces aquella proporcionada por la primera composición de control;
- b) una superficie de disolución en una curva de concentración con respecto al tiempo durante un período de al menos 90 minutos que es al menos de 1,25 veces la que proporciona dicha primera composición de control; y
- c) una biodisponibilidad relativa de al menos 1,25 relativa a dicha primera composición de control.
En otra realización preferente, el polímero potenciador de la concentración tiene una temperatura de transición vítrea de al menos 70ºC...
Reivindicaciones:
1. Composición que comprende:
- a) un sólido que comprende un medicamento de baja solubilidad y un polímero potenciador de la concentración;
- b) dicho polímero potenciador de la concentración estando presente en dicha composición en una cantidad suficiente para que dicha composición proporcione una concentración intensificada de dicho medicamento de baja solubilidad en un entorno de uso en comparación con una primera composición de control que se compone esencialmente de una mezcla de una cantidad equivalente de dicho medicamento en forma cristalina y una cantidad equivalente de dicho polímero potenciador de la concentración; y
- c) donde al menos una parte de dicho medicamento está presente en regiones ricas en medicamento y dichas regiones ricas en medicamento se entremezclan entre todas las regiones pobres en medicamento, ricas en polímero, y donde al menos un 20% en peso de dicho medicamento de baja solubilidad se encuentra en un estado semiordenado.
2. Composición según la reivindicación 1, caracterizada porque dicha composición proporciona una estabilidad mejorada con respecto a una segunda composición de control que se compone esencialmente de una dispersión sólida amorfa de una cantidad equivalente de dicho medicamento y una cantidad equivalente de dicho polímero potenciador de la concentración, caracterizada porque dicho medicamento en dicha segunda composición de control es al menos en un 90% en peso amorfo.
3. Composición según la reivindicación 1, caracterizada porque dicho medicamento en dicho estado semiordenado presenta al menos uno de:
- a) un modelo de difracción de rayos X en polvo que es distinto de un modelo de difracción de rayos X en polvo de dicha primera composición de control, donde al menos un pico presente en dicho modelo de difracción de dicha primera composición de control no está presente en dicho modelo de difracción de dicho medicamento en dicha composición;
- b) un modelo de difracción de rayos X en polvo que tiene al menos un pico que tiene un ancho total a media altura de al menos 1,1 veces el de un pico equivalente mostrado por dicho medicamento en dicha primera composición de control;
- c) una temperatura de transición vítrea que es distinta de la temperatura de transición vítrea de una segunda composición de control, dicha segunda composición de control consistiendo esencialmente en una dispersión sólida amorfa de una cantidad equivalente de dicho medicamento y una cantidad equivalente de dicho polímero potenciador de la concentración, caracterizada porque dicho medicamento en dicha segunda composición de control es al menos en un 90% en peso amorfo; y
- d) un comienzo o máximo en la endotermia de fusión que se encuentra a una temperatura inferior que el comienzo o máximo en la endotermia de fusión de dicho medicamento en dicha primera composición de control.
4. Composición según la reivindicación 1, caracterizada porque dicho medicamento tiene una temperatura de fusión Tm medida en Kelvin y una temperatura de transición vítrea Tg medida en Kelvin y Tm/Tg es al menos de 1,3.
5. Composición según la reivindicación 1, caracterizada porque al menos un 40% en peso de dicho medicamento se encuentra en dicho estado semiordenado.
6. Composición según la reivindicación 1, caracterizada porque dichas regiones ricas en medicamento tienen un tamaño característico en su dimensión más pequeña, inferior a aproximadamente 100 nm.
7. Composición según la reivindicación 1, caracterizada porque dicha concentración potenciada se caracteriza por al menos uno de:
- a) una concentración disuelta máxima de dicho medicamento en dicho entorno de uso que es al menos 1,25 veces la que proporciona dicha primera composición de control;
- b) una superficie de disolución en una curva de concentración con respecto al tiempo durante un período de al menos 90 minutos que es al menos 1,25 veces la que proporciona dicha primera composición de control; y
- c) una biodisponibilidad relativa de al menos 1,25 la de dicha primera composición de control.
8. Composición según la reivindicación 2, caracterizada porque dicha estabilidad mejorada se caracteriza por al menos uno de:
- a) una velocidad de cristalización que es inferior al 90% de la velocidad de cristalización de dicho medicamento en dicha segunda composición de control;
- b) un grado relativo de mejora en la estabilidad química de al menos 1,25 con respecto a dicha segunda composición de control; y
- c) un grado relativo de mejora en la estabilidad por rendimiento de la disolución de al menos 1,25 con respecto a dicha segunda composición de control.
9. Proceso para formar una composición farmacéutica, que comprende:
- a) la formación de una dispersión amorfa que comprende un medicamento de baja solubilidad y un polímero potenciador de la concentración;
- b) el tratamiento de dicha dispersión amorfa para aumentar la movilidad de dicho medicamento en dicha dispersión amorfa mediante al menos uno de (1) calentar dicha dispersión y (2) exponer dicha dispersión a un agente potenciador de la movilidad; y
- c) convertir al menos un 20% en peso de dicho medicamento de baja solubilidad a un estado semiordenado.
10. Proceso según la reivindicación 9, caracterizado porque dicho paso de tratamiento de dicha dispersión comprende tanto el calentamiento de dicha dispersión como la exposición de dicha dispersión a dicho agente potenciador de la movilidad.
11. Proceso según la reivindicación 9, caracterizado porque dicho agente potenciador de la movilidad es un vapor.
12. Proceso según la reivindicación 9, caracterizado porque dicha dispersión se calienta a una temperatura T de modo tal que Tg/T sea inferior o igual a aproximadamente 1,0, caracterizado porque dicha Tg es una temperatura de transición vítrea de dicha dispersión sólida amorfa en presencia de dicho agente potenciador de la movilidad y dicha T y dicha Tg se miden en Kelvin.
13. Proceso según la reivindicación 9, caracterizado porque la velocidad máxima de conversión de dicho medicamento de amorfo a dicho estado semiordenado tiene un valor de al menos un 0,25% en peso aproximadamente por hora.
14. Proceso según la reivindicación 9, caracterizado porque al menos un 40% en peso de dicho medicamento se convierte al estado semiordenado en 48 horas.
15. Composición formada por el proceso según cualquiera de las reivindicaciones 9-14.
Patentes similares o relacionadas:
NANOPARTÍCULAS DE ISOFLAVONAS Y SU UTILIZACIÓN, del 9 de Diciembre de 2011, de DSM IP ASSETS B.V.: Composición de isoflavona en nanopartículas, la cual comprende una isoflavona, un soporte y opcionalmente, agua, caracterizada porque, la isoflavona tiene un tamaño de partícula […]
FORMULACION FARMACEUTICA QUE COMPRENDE UN COMPUESTO RECEPTOR CB1 EN UNA SOLUCION SOLIDA Y/O DISPERSION SOLIDA, del 8 de Septiembre de 2011, de LABORATORIOS DEL DR. ESTEVE, S.A.: La presente invención se refiere a una formulación farmacéutica que comprende piperidin-1-ilamida del ácido 5-(4-cloro-fenil)-1-(2,4-dicloro-feniD-4,5-dihidro-1H-pirazol-3-carboxílico […]
 DISPOSITIVO POLIMÉRICO IMPLANTABLE PARA LIBERACIÓN SOSTENIDA DE AGONISTA DE DOPAMINA, del 30 de Mayo de 2011, de TITAN PHARMACEUTICALS, INC.: Un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica […]
DISPOSITIVO POLIMÉRICO IMPLANTABLE PARA LIBERACIÓN SOSTENIDA DE AGONISTA DE DOPAMINA, del 30 de Mayo de 2011, de TITAN PHARMACEUTICALS, INC.: Un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica […]
 AEROSOLES QUE COMPRENDEN FÁRMACOS EN NANOPARTÍCULAS, del 20 de Mayo de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una composición en aerosol de polvo seco que comprende agregados de partículas de fármaco nanoparticulado, en la que: (a) los agregados […]
AEROSOLES QUE COMPRENDEN FÁRMACOS EN NANOPARTÍCULAS, del 20 de Mayo de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una composición en aerosol de polvo seco que comprende agregados de partículas de fármaco nanoparticulado, en la que: (a) los agregados […]
 SISTEMAS LIQUISÓLIDOS Y PROCEDIMIENTOS DE PREPARACIÓN DE LOS MISMOS, del 31 de Marzo de 2011, de Spireas, Spiridon
Bolton, Sanford M: LOS SISTEMAS LIQUISOLIDOS CONSISTEN EN FORMAS PULVERULENTAS DE UNA FLUIDEZ Y DE UNA COMPRESIBILIDAD ACEPTABLES DE MEDICAMENTOS LIQUIDOS. SEGUN […]
SISTEMAS LIQUISÓLIDOS Y PROCEDIMIENTOS DE PREPARACIÓN DE LOS MISMOS, del 31 de Marzo de 2011, de Spireas, Spiridon
Bolton, Sanford M: LOS SISTEMAS LIQUISOLIDOS CONSISTEN EN FORMAS PULVERULENTAS DE UNA FLUIDEZ Y DE UNA COMPRESIBILIDAD ACEPTABLES DE MEDICAMENTOS LIQUIDOS. SEGUN […]
COMPOSICIONES DE AGENTE ACTIVO EN NANOPARTÍCULAS ESTABILIZADAS EN GEL, del 30 de Marzo de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una composición de gelatina sólida o semisólida, que comprende: (a) partículas de al menos un agente activo que tienen un tamaño de partícula promedio […]
 PROCEDIMIENTO PARA LA PREPARACIÓN DE DISPERSIONES DE NANO-PARTÍCULAS CRISTALINAS, del 23 de Marzo de 2011, de ASTRAZENECA AB: Un procedimiento para la preparación de una dispersión de partículas nanocristalinas en un medio acuoso, que comprende combinar: a) una primera disolución que […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE DISPERSIONES DE NANO-PARTÍCULAS CRISTALINAS, del 23 de Marzo de 2011, de ASTRAZENECA AB: Un procedimiento para la preparación de una dispersión de partículas nanocristalinas en un medio acuoso, que comprende combinar: a) una primera disolución que […]
COMPOSICIONES NANOPARTICULADAS QUE TIENEN LISOZIMA COMO UN ESTABILIZADOR DE SUPERFICIE, del 30 de Julio de 2010, de ELAN PHARMA INTERNATIONAL LTD: Una composición nanoparticulada que comprende por lo menos un agente diagnóstico o terapéutico que tiene lisozima adsorbida en la superficie de la misma en una cantidad suficiente […]