DISPOSITIVO POLIMÉRICO IMPLANTABLE PARA LIBERACIÓN SOSTENIDA DE AGONISTA DE DOPAMINA.
Un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita,
que comprende un agonista de dopamina y una matriz polimérica no erosionable, biocompatible, en donde dicho agonista de dopamina se encapsula dentro de dicha matriz por un proceso de extrusión, en donde dicho agonista de dopamina y el polímero se mezclan, se funden y se extruyen en una estructura, en donde el dispositivo implantable está sin recubrir, en donde el agonista de dopamina se selecciona de apomorfina, lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina, y en donde, cuando dicho dispositivo implantable se implanta por vía subcutánea en dicho mamífero, dicho agonista de dopamina se libera en forma continua in vivo durante un período de tiempo sostenido a través de los poros que se abren a la superficie de dicha matriz a una velocidad que origina un nivel plasmático en estado estacionario de al menos 0,01 ng/ml durante el período de tiempo sostenido, en donde el período de tiempo sostenido es de al menos 3 meses
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/010270.
Solicitante: TITAN PHARMACEUTICALS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 400 OYSTER POINT BLVD., SUITE 505 SOUTH SAN FRANCISCO, CA 94080-1021 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BUCALO,LOUIS,R, PATEL,Rajesh,A, COSTANTINI,Lauren, KLEPPNER,Sofie.
Fecha de Publicación: .
Fecha Solicitud PCT: 31 de Marzo de 2004.
Clasificación Internacional de Patentes:
- A61K31/381 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo ciclos de cinco eslabones.
- A61K31/4045 A61K 31/00 […] › Indol-alquilaminas; Sus amidas, p. ej. serotonina, melatonina.
- A61K31/428 A61K 31/00 […] › condensados con carbociclos.
- A61K31/48 A61K 31/00 […] › Derivados de la ergolina, p. ej. ácido lisérgico, ergotamina.
- A61K31/485 A61K 31/00 […] › Derivados del morfinano, p. ej. morfina, codeína.
- A61K9/00M5D
- A61K9/14H6
- A61K9/16H6B
- A61L31/04H
- A61L31/16 A61 […] › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 31/00 Materiales para otros artículos quirúrgicos. › Materiales biológicamente activos, p. ej. sustancias terapéuticas.
Clasificación PCT:
- A61K31/381 A61K 31/00 […] › teniendo ciclos de cinco eslabones.
- A61K31/4045 A61K 31/00 […] › Indol-alquilaminas; Sus amidas, p. ej. serotonina, melatonina.
- A61K31/428 A61K 31/00 […] › condensados con carbociclos.
- A61K31/48 A61K 31/00 […] › Derivados de la ergolina, p. ej. ácido lisérgico, ergotamina.
- A61K31/485 A61K 31/00 […] › Derivados del morfinano, p. ej. morfina, codeína.
- A61P25/16 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Medicamentos contra el Parkinson.
Clasificación antigua:
- A61K31/381 A61K 31/00 […] › teniendo ciclos de cinco eslabones.
- A61K31/4045 A61K 31/00 […] › Indol-alquilaminas; Sus amidas, p. ej. serotonina, melatonina.
- A61K31/428 A61K 31/00 […] › condensados con carbociclos.
- A61K31/48 A61K 31/00 […] › Derivados de la ergolina, p. ej. ácido lisérgico, ergotamina.
- A61K31/485 A61K 31/00 […] › Derivados del morfinano, p. ej. morfina, codeína.
- A61P25/16 A61P 25/00 […] › Medicamentos contra el Parkinson.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359977_T3.pdf
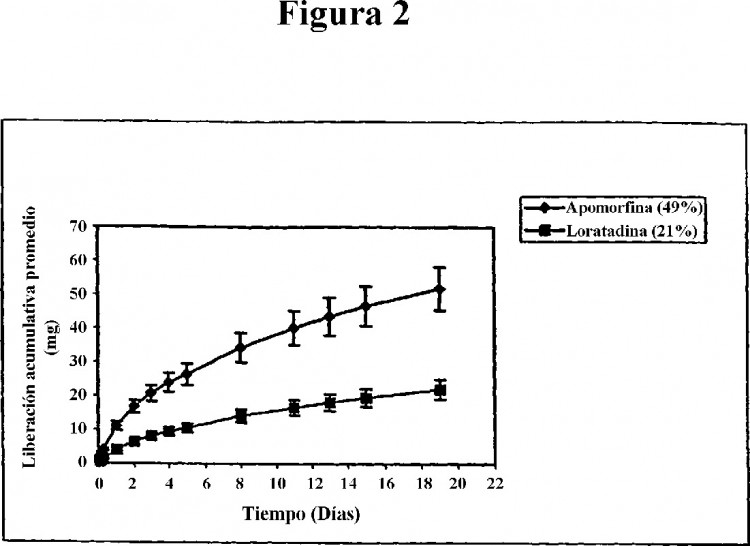
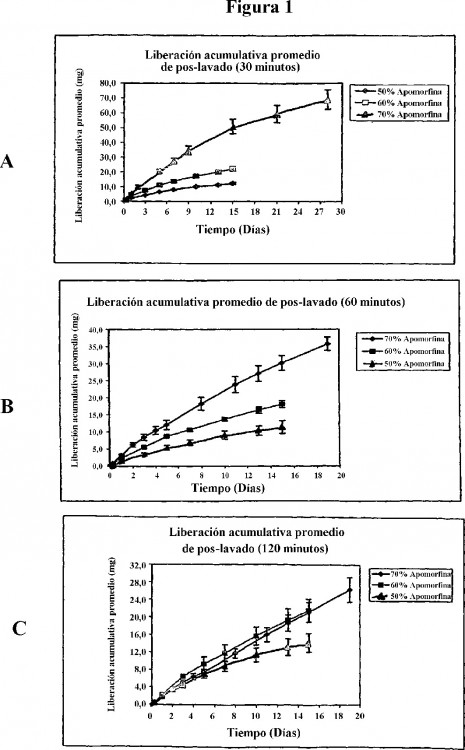
Fragmento de la descripción:
CAMPO TÉCNICO
La invención proporciona un dispositivo polimérico no bioerosionable para la implantación subcutánea y la liberación sostenida del agonista de dopamina para el tratamiento de la enfermedad de Parkinson y otras afecciones para las cuales la administración de un agonista de dopamina es terapéuticamente beneficiosa.
ANTECEDENTES DE LA INVENCIÓN
La enfermedad de Parkinson, un trastorno neurodegenerativo progresivo, se caracteriza por la pérdida de neuronas que sintetizan y liberan dopamina. Esta pérdida de neuronas dopaminérgicas se manifiesta en sí en síntomas tales como rigidez, temblores en reposo (estremecimiento), poco movimiento (aquinesia), lentitud de movimiento (bradiquinesia) y cambios en la marcha y la postura. El tratamiento de la enfermedad de Parkinson se basa en general en la administración terapéutica de sustancias que pueden compensar la carencia de neurotransmisión dopaminérgica debida a la pérdida de neuronas secretoras de dopamina. Un régimen de tratamiento clásico incluye la administración oral crónica de levodopa, que se descarboxila en el cerebro para formar dopamina. A menudo, después de varios años de tratamiento con levodopa, surgen anormalidades, que incluyen movimientos involuntarios durante la fase “activa” de la mejora clínica y la reaparición de los síntomas tipo de Parkinson durante las fases “inactivas”.
Sabel et al., Ann Neurol, 1990; 28:714–717 y US–A–5114719 describen un sistema de matriz polimérica para la implantación para la liberación de levodopa.
El documento US–A–5156844 describe un dispositivo de terapia neurológica para la administración local de un neurotransmisor al cerebro de un sujeto.
La apomorfina, un agonista efectivo en ambos receptores de dopamina del sistema nervioso, se ha usado para el tratamiento de la enfermedad de Parkinson en los pacientes que se vuelven resistentes o que han desarrollado efectos secundarios adversos asociados con la terapia crónica con levodopa. Normalmente, debido a su breve duración de efectividad, la apomorfina se administra por inyecciones subcutáneas repetidas o infusión parenteral continua por medio de una bomba. Estos medios de administración son inconvenientes, en el caso de inyección subcutánea y técnicamente difíciles, en el caso de la administración con bomba, en especial para los pacientes con Parkinson, cuya destreza está deteriorada debido a la enfermedad propiamente dicha y los movimientos asociados con el tratamiento crónico con levodopa. La apomorfina también se puede administrar por vía transdérmica (patente estadounidense N.º 5.562.917), intranasal (patente estadounidense N.º 5.756.483), como un gel aplicado por vía tópica (patente estadounidense N.º 5.939.094) o sublingual (patente estadounidense N.º 5.994.363). Ninguno de estos métodos permite la administración continua durante largos períodos de tiempo.
Los agonistas de dopamina también se han usado para el tratamiento del parkinsonismo que resulta de la lesión del sistema nervioso central por exposición a la toxina o una condición patológica tales como encefalitis, disfunción eréctil, síndrome de piernas inquietas e hiperprolactinemia.
Existe una necesidad de un medio mejor de administración que pueda permitir la dosificación continua de agonistas de dopamina durante un período de tiempo prolongado de varios meses o más, sin los efectos secundarios adversos asociados con los picos y valles en los niveles plasmáticos debido a la dosificación discontinua, o la dependencia del equipo mecánico pesado tal como una bomba.
BREVE SÍNTESIS DE LA INVENCIÓN
La invención proporciona composiciones (es decir, dispositivos poliméricos implantables) y kits para la administración de uno o varios agonistas de dopamina a un mamífero que lo necesita.
En un aspecto, la invención proporciona un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica no erosionable, biocompatible, donde dicho agonista de dopamina está encapsulado dentro de dicha matriz por un proceso de extrusión, donde dicho agonista de dopamina y el polímero se mezclan, se funden y se extruyen en una estructura, donde el dispositivo implantable no está recubierto, donde el agonista de dopamina se selecciona de apomorfina, lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina, y donde, cuando dichos dispositivos implantables se implantan en forma subcutánea en dicho mamífero, dicho agonista de dopamina se libera en forma continua in vivo durante un período de tiempo sostenido a través de los poros que se abren en la superficie de dicha matriz a una velocidad que origina un nivel plasmático en estado estacionario de al menos 0,01 ng/ml durante el período de tiempo sostenido, donde el período de tiempo sostenido es de al menos 3 meses. El dispositivo implantable incluye al menos un agonista de dopamina encapsulado en una matriz polimérica no erosionable, biocompatible. Después de la implantación subcutánea en un mamífero, un dispositivo implantable de la invención libera el agonista de dopamina en forma continua in vivo a través de los poros que se abren a la superficie de la matriz a una velocidad que produce un nivel plasmático de al menos 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 5 ó 10 ng/ml en varias formas de realización. En algunas formas de realización, un dispositivo implantable de la invención incluye acetato de vinilo y etileno (EVA) como un polímero no erosionable y biocompatible para la formación de la matriz polimérica. En diversas formas de realización, el contenido de acetato de vinilo de EVA usado para la preparación de la matriz polimérica es a menudo del 2 al 40, más frecuentemente del 10 al 35, con máxima frecuencia del 30 al 35%. En algunas formas de realización, el contenido de acetato de vinilo es del 33%. Un dispositivo implantable de la invención incluye del 10 al 85% de agonista de dopamina. En una forma de realización, el agonista de dopamina es apomorfina. El agonista de dopamina es, en general, al menos un agonista del receptor de dopamina D2, pero también puede ser un agonista para los receptores de dopamina D1 y/o D3. Los dispositivos implantables a menudo liberan el agonista de dopamina en forma continua in vivo durante al menos 3, 6, 9, 12, 15, 18, 21 ó 24 meses. Los dispositivos implantables de la invención se producen usando un proceso de extrusión, que algunas veces producen dispositivos con dimensiones de 2 a 3 mm de diámetro y 2 a 3 cm de longitud, si bien se contemplan otras formas y tamaños y están dentro de la experiencia de la técnica. A menudo, un dispositivo implantable de la invención libera el agonista de dopamina a una velocidad de al menos 0,1 a 10 mg/día en el estado estacionario in vitro o in vivo. En diversas formas de realización, los dispositivos implantables liberan el agonista de dopamina a una velocidad de al menos 0,01, 0,05, 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 ó 10 mg/día in vitro o in vivo. En algunas formas de realización, un dispositivo implantable que contiene dopamina también puede incluir un agente antiinflamatorio, por ejemplo, un esteroide, un fármaco antiinflamatorio no esteroide (“NSAID”) o una antihistamina y/o un antioxidante dentro de la matriz polimérica.
En otro aspecto de la presente invención, se proporciona un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica no erosionable, biocompatible, donde dicho agonista de dopamina está encapsulado dentro de dicha matriz por un proceso de extrusión, donde dicho agonista de dopamina y el polímero se mezclan, se funden y se extruyen en una estructura, donde el dispositivo implantable no está recubierto, donde el agonista de dopamina se selecciona de apomorfina, lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina, y donde, cuando dicho dispositivo implantable se implanta en forma subcutánea en un mamífero, dicho agonista de dopamina se libera en forma continua in vivo durante un período de tiempo sostenido a través de los poros que se abren a la superficie dicha matriz a una velocidad de al menos 0,1 mg de agonista de dopamina por día en estado estacionario, donde el período de tiempo sostenido es de al menos 3 meses.
En otro aspecto, la invención proporciona un agonista de dopamina para el tratamiento de un mamífero que sufre de una enfermedad o afección... [Seguir leyendo]
Reivindicaciones:
1. Un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica no erosionable, biocompatible,
en donde dicho agonista de dopamina se encapsula dentro de dicha matriz por un proceso de extrusión, en donde dicho agonista de dopamina y el polímero se mezclan, se funden y se extruyen en una estructura,
en donde el dispositivo implantable está sin recubrir,
en donde el agonista de dopamina se selecciona de apomorfina, lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina, y
en donde, cuando dicho dispositivo implantable se implanta por vía subcutánea en dicho mamífero, dicho agonista de dopamina se libera en forma continua in vivo durante un período de tiempo sostenido a través de los poros que se abren a la superficie de dicha matriz a una velocidad que origina un nivel plasmático en estado estacionario de al menos 0,01 ng/ml durante el período de tiempo sostenido,
en donde el período de tiempo sostenido es de al menos 3 meses.
2. Un dispositivo implantable de acuerdo con la reivindicación 1, que comprende dimensiones de 2 a 3 mm de diámetro y 2 a 3 cm de longitud.
3. Un dispositivo implantable de acuerdo con la reivindicación 1 o la reivindicación 2, en donde dicho dispositivo implantable libera 0,1 a 10 mg de agonista de dopamina por día in vitro.
4. Un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica no erosionable, biocompatible,
en donde dicho agonista de dopamina se encapsula dentro de dicha matriz por un proceso de extrusión, en donde dicho agonista de dopamina y el polímero se mezclan, se funden y se extruyen en una estructura,
en donde el dispositivo implantable está sin recubrir,
en donde el agonista de dopamina se selecciona de apomorfina, lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina, y
en donde cuando dicho dispositivo implantable se implanta por vía subcutánea en un mamífero, dicho agonista de dopamina se libera en forma continua in vivo durante un período de tiempo sostenido a través de los poros que se abren a la superficie de dicha matriz a una velocidad de al menos 0,1 mg de agonista de dopamina por día en estado estacionario,
en donde el período de tiempo sostenido es de al menos 3 meses.
5. Un dispositivo implantable de acuerdo con una cualquiera de las reivindicaciones precedentes, en donde la matriz polimérica comprende copolímero de etileno y acetato de vinilo (EVA).
6. Un dispositivo implantable de acuerdo con la reivindicación 5, donde dicho EVA comprende 33% de acetato de vinilo.
7. Un dispositivo implantable de acuerdo con una cualquiera de las reivindicaciones precedentes, que comprende 10 al 85% de agonista de dopamina.
8. Un dispositivo implantable de acuerdo con una cualquiera de las reivindicaciones precedentes, en donde dicho agonista de dopamina se selecciona de lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina.
9. Un dispositivo implantable de acuerdo con una cualquiera de las reivindicaciones 1–7, en donde dicho agonista de dopamina es apomorfina.
10. Un dispositivo implantable de acuerdo con una cualquiera de las reivindicaciones 1–7, en donde dicho agonista de dopamina es lisurida.
11. Un dispositivo implantable de acuerdo con una cualquiera de las reivindicaciones 1–7, donde dicho agonista de dopamina se selecciona de pramipexol, ropinerol y rotigotina.
12. Un dispositivo implantable de acuerdo con una cualquiera de las reivindicaciones precedentes, en donde el dispositivo implantable se lava.
13. Un dispositivo implantable de acuerdo con una cualquiera de las reivindicaciones precedentes, que además comprende un agente antiinflamatorio encapsulado dentro de dicha matriz.
14. Un dispositivo implantable de acuerdo con la reivindicación 13, en donde dicho agente antiinflamatorio es un esteroide.
15. Un dispositivo implantable de acuerdo con la reivindicación 13, en donde dicho agente antiinflamatorio es un fármaco antiinflamatorio no esteroide (“NSAID”).
16. Un dispositivo implantable de acuerdo con la reivindicación 13, en donde dicho agente antiinflamatorio es una antihistamina.
17. Un dispositivo implantable de acuerdo con una cualquiera de las reivindicaciones precedentes, que además comprende un antioxidante encapsulado dentro de dicha matriz.
18. Un agonista de dopamina para el tratamiento de un mamífero que sufre de una enfermedad o afección para la cual la administración del agonista de dopamina es terapéuticamente beneficiosa,
en donde dicho tratamiento comprende administrar al menos un dispositivo implantable por vía subcutánea,
en donde cada uno de dicho al menos un dispositivo implantable comprende el agonista de dopamina encapsulado dentro de una matriz polimérica no erosionable, biocompatible,
en donde dicho agonista de dopamina se encapsula dentro de dicha matriz por un proceso de extrusión, donde dicho agonista de dopamina y el polímero se mezclan, se funden y se extruyen en una estructura,
en donde el dispositivo implantable está sin recubrir,
en donde el agonista de dopamina se selecciona de apomorfina, lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina, y
en donde dicho agonista de dopamina se libera en forma continua in vivo de cada uno de dicho al menos un dispositivo implantable durante un período de tiempo sostenido a través de los poros que se abren a la superficie de dicha matriz a una velocidad que origina un nivel plasmático en estado estacionario de al menos 0,01 ng/ml durante el período de tiempo sostenido,
en donde el período de tiempo sostenido es de al menos 3 meses.
19. Un agonista de dopamina de acuerdo con la reivindicación 18, donde dicho al menos un dispositivo implantable comprende una multiplicidad de dispositivos implantables individuales, y
en donde la combinación de dichos dispositivos implantables libera en forma continua agonista de dopamina in vivo durante un período de tiempo sostenido a una velocidad que origina un nivel plasmático en estado estacionario de al menos 0,05 ng/ml durante el período de tiempo sostenido.
20. Un agonista de dopamina de acuerdo con la reivindicación 18 ó 19, en donde dicho dispositivo implantable es como se define en cualquiera de las reivindicaciones 1 a 16.
21. Un agonista de dopamina de acuerdo con una cualquiera de las reivindicaciones 18 a 20 para el tratamiento de enfermedad de Parkinson.
22. Un agonista de dopamina de acuerdo con una cualquiera de las reivindicaciones 18 a 20 para el tratamiento de parkinsonismo inducido por toxina o enfermedad.
23. Un agonista de dopamina de acuerdo con una cualquiera de las reivindicaciones 18 a 20 para el tratamiento de disfunción eréctil o síndrome de piernas inquietas.
24. Un agonista de dopamina de acuerdo con una cualquiera de las reivindicaciones 18 a 23, en donde dicho tratamiento comprende el implante por vía subcutánea de cada uno de dichos al menos un dispositivo implantable en el sitio seleccionado del brazo superior, la espalda y el abdomen.
25. Un agonista de dopamina de acuerdo con una cualquiera de las reivindicaciones 18 a 23, que además comprende la administración de un agente antiinflamatorio.
26. Un agonista de dopamina de acuerdo con la reivindicación 25, en donde dicho agente inflamatorio está encapsulado en al menos uno de dichos al menos un dispositivo implantable.
27. Un agonista de dopamina de acuerdo con la reivindicación 25, en donde dicho agente antiinflamatorio está encapsulado dentro de una matriz polimérica no erosionable, biocompatible que no comprende dicho agonista de dopamina, y en donde dicho tratamiento comprende la administración de dicha matriz polimérica que comprende dicho agente antiinflamatorio por vía subcutánea.
28. Un agonista de dopamina de acuerdo con la reivindicación 25, en donde dicho agente inflamatorio está
destinado a la administración por medio de una vía seleccionada de inyección local, inyección sistémica, inyección subcutánea y administración oral.
29. Un agonista de dopamina de acuerdo con una cualquiera de las reivindicaciones 18–28, en donde dicho agonista de dopamina se selecciona de lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina.
30. Un agonista de dopamina de acuerdo con una cualquiera de las reivindicaciones 18–28, en donde dicho agonista de dopamina es apomorfina.
31. Un kit que comprende al menos un dispositivo implantable que comprende un agonista de dopamina y encapsulado dentro de una matriz polimérica no erosionable, biocompatible,
en donde dicho agonista de dopamina se encapsula dentro de dicha matriz por un proceso de extrusión, en donde dicho agonista de dopamina y el polímero se mezclan, se funden y se extruyen en una estructura,
en donde el dispositivo implantable está sin recubrir,
en donde el agonista de dopamina se selecciona de apomorfina, lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina, y
en donde, cuando dicho al menos un dispositivo implantable se implanta por vía subcutánea en un mamífero, dicho agonista de dopamina se libera en forma continua in vivo de cada uno de dichos al menos un dispositivo implantable durante un período de tiempo sostenido a través de los poros que se abren a la superficie de dicha matriz a una velocidad que origina un nivel plasmático en estado estacionario de al menos 0,01 ng/ml durante el período de tiempo sostenido, en donde el período de tiempo sostenido es de al menos 3 meses, e instrucciones para uso en un método de administración de un agonista de dopamina a un mamífero que lo necesita.
32. Un kit de acuerdo con la reivindicación 31, en donde dicho al menos un dispositivo implantable comprende una multiplicidad de dispositivos implantables individuales, y en donde, cuando la combinación de dichos dispositivos implantables se implanta por vía subcutánea en un mamífero, dichos dispositivos implantables liberan continuamente el agonista de dopamina in vivo durante un período de tiempo sostenido a una velocidad que origina un nivel plasmático en estado estacionario de al menos 0,05 ng/ml durante el período de tiempo sostenido.
33. Un kit de acuerdo con la reivindicación 31 ó 32, en donde dicho dispositivo implantable libera el agonista de dopamina a una velocidad de al menos 0,1 mg por día in vitro.
34. Un kit de acuerdo con una cualquiera de las reivindicaciones 31 a 33, en donde cada uno de dichos dispositivos implantables comprende EVA.
35. Un kit de acuerdo con la reivindicación 34, en donde dicho EVA comprende el 33% de acetato de vinilo.
36. Un kit de acuerdo con una cualquiera de las reivindicaciones 31 a 35, en donde cada uno de dichos dispositivos implantables comprende 10 al 85% de agonista de dopamina.
37. Un kit de acuerdo con una cualquiera de las reivindicaciones 31 a 36, en donde dicho agonista de dopamina se selecciona de lisurida, pergolida, bromocriptina, pramipexol, ropinerol y rotigotina.
38. Un kit de acuerdo con una cualquiera de las reivindicaciones 31 a 36, en donde dicho agonista de dopamina es apomorfina.
39. Un kit de acuerdo con una cualquiera de las reivindicaciones 31 a 37, en donde dicho agonista de dopamina es lisurida.
Patentes similares o relacionadas:
Regímenes de dosificación de buprenorfina, del 1 de Julio de 2020, de Indivior UK Limited: Buprenorfina para su uso en un método para tratar el trastorno por uso de opioides en un ser humano que lo necesite, que comprende las etapas […]
 Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Forma de dosificación llena de líquido, disuasoria del abuso y de liberación inmediata, del 24 de Junio de 2020, de Pharmaceutical Manufacturing Research Services, Inc: Una cápsula disuasoria del abuso de liberación inmediata, que comprende:
(a) un principio activo susceptible de abuso;
(b) un primer polietilenglicol (PEG) […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Pulverizador de buprenorfina sublingual, del 22 de Abril de 2020, de Fresh Cut Development, LLC: Una formulación de pulverización sublingual que comprende una cantidad efectiva de buprenorfina, o una sal farmacéuticamente aceptable de la misma, […]
Dispositivos de administración transdérmica resistentes al abuso y composiciones que comprenden un agonista de opioides y un derivado N-óxido no administrado por vía transdérmica de un antagonista de opioide para el tratamiento del dolor, del 22 de Abril de 2020, de EURO-CELTIQUE S.A.: Un dispositivo de administración transdérmica que comprende una composición farmacéutica, en el que dicha composición comprende un derivado […]
Formulación farmacéutica a base de ibuprofeno y codeína que tiene estabilidad mejorada, del 15 de Abril de 2020, de FARMASIERRA MANUFACTURING S.L: Formulación farmacéutica a base de ibuprofeno y codeínade estabilidad mejorada. La invención consiste en una nueva formulación farmacéuticaen forma […]
Parche transdérmico de oximorfona, del 8 de Abril de 2020, de Buzzz Pharmaceuticals Limited: Un parche transdérmico que tiene una capa que contiene el fármaco que comprende oximorfona o una sal farmacéuticamente aceptable de la misma, […]
Composiciones de buprenorfina y antagonistas del receptor de opioides mu, del 1 de Abril de 2020, de Alkermes Pharma Ireland Limited: Una composición que comprende buprenorfina y un antagonista del receptor opioide μ, en donde la composición está caracterizada por un Índice […]