Sal de tipo tosilato de un derivado de 5-pirazolil-2-piridona, útil en el tratamiento de la epoc.
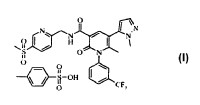
La Forma A del compuesto 4-metilbencenosulfonato de 6-metil-5-(1-metil-1H-pirazol-5-il)-N-{[5-(metilsulfonil)piridin-2-il]metil}-2-oxo-1-[3-(trifluorometil)fenil]-1,
2-dihidropiridin-3-carboxamida donde dicha Forma A presenta un patrón de difracción de rayos X en polvo registrado utilizando una radiación de CuKα con al menos un pico específico en 2θ ≥ aproximadamente 5.1, 7.3, 8.9, 17.0 o 17.8°.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2010/050271.
Solicitante: ASTRAZENECA AB.
Nacionalidad solicitante: Suecia.
Dirección: 151 85 SÖDERTÄLJE SUECIA.
Inventor/es: NICKLASSON, HELENA, BRIGGNER, LARS-ERIK, ALCARAZ,MARIE-LYNE, KLINGSTEDT,PER TOMAS, LÖNN,HANS ROLAND, NIXON,ROBERT ANTHONY, WATTS,ANDREW JAMES, ZUBAN,ROBERT.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4439 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo un ciclo de cinco eslabones con el nitrógeno como heteroátomo del ciclo, p. ej. omeprazol (nicotina A61K 31/465).
- A61P11/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del aparato respiratorio.
- C07D401/14 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 401/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, siendo al menos un ciclo de seis miembros con solamente un átomo de nitrógeno. › que contienen tres o más heterociclos.
PDF original: ES-2469916_T3.pdf
Fragmento de la descripción:
Sal de tipo tosilato de un derivado de 5-pirazolil-2-piridona, ïtil en el tratamiento de la epoc.
Campo de la invenciïn La presente invenciïn describe una sal novedosa de la 6-metil-5- (1-metil-1H-pirazol-5-il) -N-{[5- (metilsulfonil) piridin-2
il]metil}-2-oxo-1-[3- (trifluorometil) fenil]-1, 2-dihidropiridin-3-carboxamida, una forma cristalina novedosa de dicha sal, procesos para preparar dicha sal y dicha forma, composiciones farmacïuticas que comprenden dicha sal y dicha forma, y la sal y la forma para su uso en terapia.
Antecedentes de la invenciïn El documento WO 2005/026123 muestra una clase de inhibidores de elastasa neutrïfila que son ïtiles en terapia.
El documento WO 2005/026123 describe ademïs un compuesto especïfico que actïa como inhibidor de elastasa neutrïfila, identificado en dicho documento como 6-metil-5- (1-metil-1H-pirazol-5-il) -N-{[5- (metilsulfonil) piridin-2il]metil}-2-oxo-1-[3- (trifluorometil) fenil]-1, 2-dihidropiridin-3-carboxamida (Ejemplo 94, pïgina 85) . Este compuesto se denomina en la presente compuesto (I) .
O NN
N O
N
H S
O
N
(I) O
CF3
El documento WO 2005/026123 describe ademïs un proceso para preparar el compuesto (I) .
De este modo, en una realizaciïn de WO 2005/026123, se prepara el compuesto (I) mediante la ruta mostrada en el Esquema 1:
Esquema 1
El compuesto obtenido (I) se purificï mediante HPLC preparativa y se liofilizï para obtener la base libre como un sïlido blanco. En el documento WO 2005/026123 no se describe ninguna sal especïfica ni ninguna forma cristalina 5 del compuesto (I) .
El Compuesto (I) es un inhibidor potente de elastasa neutrïfila y, como tal, es ïtil en terapia.
Sin embargo, el compuesto (I) en forma de base libre es muy poco soluble y las predicciones indican que el compuesto (administrado en forma de base libre) presentarïa una absorciïn limitada por la solubilidad en dosis elevadas (por ejemplo, dosis mayores de aproximadamente 10-20 mg) .
Para poder preparar formulaciones farmacïuticas que contengan el compuesto (I) como principio activo para administraciïn humana, es necesario producir el compuesto (I) en una forma estable y mïs soluble, tal como una forma cristalina estable, con unas propiedades fïsicas de estado sïlido acordes que permitan el procesado farmacïutico.
Por lo tanto, es necesario encontrar mïtodo (s) que permitan que el compuesto farmacolïgicamente activo muy poco soluble (I) se absorba en un grado suficiente dentro de una franja temporal tras la administraciïn oral tal que la concentraciïn del compuesto activo (I) en el (los) fluido (s) biolïgico (s) sea suficiente para conseguir el efecto farmacolïgico deseado durante un periodo de tiempo.
La presente invenciïn proporciona una sal novedosa del compuesto (I) y una forma cristalina estable de dicha sal con propiedades fïsicas ventajosas y acordes. Ademïs, como una caracterïstica independiente adicional, la presente invenciïn tambiïn proporciona una formulaciïn que hace posible que el compuesto farmacolïgicamente activo (I) se absorba en el grado deseado.
Breve descripciïn de las figuras La Figura 1 es un diagrama de difracciïn de rayos X en polvo (DRXP) de la Forma A del tosilato del compuesto (I) . El eje x muestra el valor 2–theta y el eje y la intensidad.
La Figura 2 es una curva de calorimetrïa diferencial de barrido (CDB) (lïnea continua) y una curva de anïlisis tïrmico gravimïtrico (ATG) (lïnea discontinua) de la Forma A del tosilato del compuesto (I) . El eje x muestra la temperatura (ïC) y el eje y el flujo de calor (vatios/g) (CDB) y el % en peso de la muestra (ATG) .
La Figura 3 muestra el perfil de disoluciïn de los comprimidos preparados en el Ejemplo 14; una composiciïn de comprimidos que contiene la Forma A del tosilato del compuesto (I) y celulosa microcristalina (puntos de datos representados por cuadrados) ; y una composiciïn de comprimidos que contiene la Forma A del tosilato del compuesto (I) e Isomalt (puntos de datos representados por rombos) . La disoluciïn se evaluï en un pH de 6.8, segïn se describe en el Ejemplo 14. El eje x muestra el tiempo (horas) , el eje y muestra el % de compuesto (I) disuelto (como el % de contenido declarado (% de CD) ) .
La Figura 4 muestra la concentraciïn en sangre (nM) en un perro tras la administraciïn de la Forma A del tosilato del compuesto (I) (equivalente a 1.0 mg/kg de compuesto (I) en forma de base libre) en una cïpsula de gelatina y la base libre del compuesto (I) (0.8 mg/kg) administrada en una suspensiïn acuosa. El eje x muestra el tiempo (horas) , el eje y muestra la concentraciïn en sangre (nM) en el perro.
La Figura 5 muestra los perfiles de disoluciïn de un comprimido recubierto con una pelïcula que contiene la Forma A del tosilato del compuesto (I) (equivalente a 30 mg de compuesto (I) en forma de base libre) descrito en el Ejemplo 10 (puntos de datos representados por cuadrados) y de la Forma A del tosilato del compuesto (I) (equivalente a 30 mg de compuesto (I) en forma de base libre) en una cïpsula (puntos de datos representados por rombos) . La disoluciïn se evaluï en 900 mL de HCl 0.1 M (pH 1) , segïn se describe en el Ejemplo 10. El eje x muestra el tiempo (minutos) , el eje y muestra el % de compuesto (I) disuelto.
La Figura 6 muestra el perfil de disoluciïn de las composiciones de comprimidos A y B (principio activo equivalente a 30 mg de compuesto (I) en forma de base) , de acuerdo con la Tabla 7 (Ejemplo 13) . La formulaciïn de comprimidos A, que contiene el 5% de fosfato de calcio dibïsico, estï representada por puntos de datos cuadrados y la formulaciïn de comprimidos B, con un 0% de fosfato de calcio dibïsico, estï representada por puntos de datos en forma de rombo. La disoluciïn se evaluï en 900 mL de HCl 0.1 M (pH 1) , segïn se describe en el Ejemplo 13. El eje x muestra el tiempo (minutos) , el eje y muestra el % de compuesto (I) disuelto (como el % de contenido declarado (% de CD) ) .
La Figura 7 es un diagrama de difracciïn de rayos X en polvo (DRXP) de la Forma B del tosilato del compuesto (I) . El eje x muestra el valor 2–theta y el eje y la intensidad.
La Figura 8 es un diagrama de difracciïn de rayos X en polvo de la Forma A del 2, 5-dimetilbencenosulfonato del compuesto (I) . El eje x muestra el valor 2–theta y el eje y la intensidad.
Descripciïn de la invenciïn Sorprendentemente, se ha descubierto que la sal de tipo tosilato (4-metilbencenosulfonato) de la 6-metil-5- (1-metil1H-pirazol-5-il) -N-{[5- (metilsulfonil) piridin-2-il]metil}-2-oxo-1-[3- (trifluorometil) fenil]-1, 2-dihidropiridin-3-carboxamida (en lo sucesivo, tosilato del compuesto (I) ) posee unas propiedades fïsicas de estado sïlido muy mejoradas en comparaciïn con las del compuesto inicial (I) en forma de base libre.
Se llevï a cabo un experimento riguroso de selecciïn de sales con el compuesto (I) . Con este experimento, se descubriï que el tosilato del compuesto (I) presenta unas propiedades de estado sïlido adecuadas que permiten su procesamiento para obtener comprimidos. Ademïs, el tosilato del compuesto (I) tambiïn tiene otras propiedades ventajosas, que incluyen una solubilidad transitoria elevada y una velocidad rïpida de disoluciïn intrïnseca.
Se han preparado y evaluado varias sales del compuesto (I) con ïcidos orgïnicos e inorgïnicos fuertes, segïn se describe a continuaciïn.
Tabla 1
Sal del compuesto (I) Forma sïlida Solubilidad (mg/mL)
Tosilato Cristalina 1.2
p-Xileno-2-sulfonato Cristalina 1.3
Cloruro Amoría 0.047
Mesilato Cristalina 0.43
Esilato Cristalina 0.096
1, 5-Naftalenodisulfonato Amoría No se evaluï
Sulfato Amoría No se evaluï
Compuesto (I) en forma de base libre Cristalina 0.040
El “p-xileno-2-sulfonato” de la Tabla 1 es la sal de tipo 2, 5-dimetilbencenosulfonato del compuesto (I) .
La solubilidad (mg/mL) mostrada en la Tabla 1 se evaluï despuïs de 1 hora en 900 mL de HCl 0.1 M a 75 rpm y 37 ïC utilizando un sistema Multidose G3 de Zymark. El anïlisis se llevï a cabo con un espectrofotïmetro de UV utilizando una longitud de onda de detecciïn de 337 nm.
La elevada solubilidad transitoria y la rïpida disoluciïn del tosilato del compuesto (I) sugieren que cabrïa esperar una biodisponibilidad mejorada en dosis en las que el compuesto (I) en forma de base libre sufrirïa una absorciïn limitada por la solubilidad. Se demostrï que el tosilato del compuesto (I) tenïa una biodisponibilidad mayor en el perro, donde la biodisponibilidad de la Forma A del tosilato del compuesto (I) administrada en... [Seguir leyendo]
Reivindicaciones:
La Forma A del compuesto 4-metilbencenosulfonato de 6-metil-5- (1-metil-1H-pirazol-5-il) -N-{[5 (metilsulfonil) piridin-2-il]metil}-2-oxo-1-[3- (trifluorometil) fenil]-1, 2-dihidropiridin-3-carboxamida donde dicha Forma A presenta un patrïn de difracciïn de rayos X en polvo registrado utilizando una radiaciïn de CuKa con al menos un pico especïfico en 28 = aproximadamente 5.1, 7.3, 8.9, 17.0 o 17.8ï.
2. El compuesto de acuerdo con la reivindicaciïn 1, donde dicha Forma A presenta un patrïn de difracciïn de rayos X en polvo registrado utilizando una radiaciïn de CuKa con picos especïficos en 28 = aproximadamente 5.1, 7.3, 8.9, 17.0 o 17.8ï.
3. El compuesto de acuerdo con la reivindicaciïn 1, donde dicha Forma A presenta un patrïn de difracciïn de rayos X en polvo registrado utilizando una radiaciïn de CuKa con picos especïficos en 28 = aproximadamente 5.1, 7.3, 8.9, 12.9, 16.8, 17.0, 17.8 y 21.9ï.
4. El compuesto de acuerdo con la reivindicaciïn 1, donde dicha Forma A presenta un patrïn de difracciïn de rayos X en polvo registrado utilizando una radiaciïn de CuKa sustancialmente igual al que se muestra en la Figura 1.
5. Una composiciïn farmacïutica que comprende un compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 4 mezclado con un diluyente o portador farmacïuticamente aceptable.
6. Una composiciïn farmacïutica de acuerdo con la reivindicaciïn 5 que comprende un compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 4 y fosfato de calcio dibïsico.
7. Una composiciïn farmacïutica de acuerdo con la reivindicaciïn 5 que comprende un compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 4, fosfato de calcio dibïsico y celulosa microcristalina.
8. Una composiciïn farmacïutica de acuerdo con la reivindicaciïn 5 que comprende un compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 4, un 40% en peso o menos de fosfato de calcio dibïsico, y celulosa microcristalina.
9. Una composiciïn farmacïutica de acuerdo con la reivindicaciïn 5 que comprende:
a) de 0.1 a 40 partes de un compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 4; b) de 2 a 10 partes de fosfato de calcio dibïsico; c) de 60 a 90 partes de celulosa microcristalina; d) de 2 a 10 partes de un desintegrante; e) de 0.1 a 2 partes de un surfactante; y f) de 0.1 a 3 partes de un lubricante;
donde todas las partes son partes por peso de la composiciïn total y la suma de las partes de (a) a (f) = 100.
10. Una composiciïn farmacïutica de acuerdo con cualquiera de las reivindicaciones 5 a 9, la cual es una composiciïn farmacïutica de liberaciïn instantïnea para administraciïn oral.
11. Una composiciïn farmacïutica de acuerdo con la reivindicaciïn 10 que comprende ademïs un recubrimiento.
12. Un compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 4, o una composiciïn farmacïutica de acuerdo con cualquiera de las reivindicaciones 5 a 11, para su uso en terapia.
13. Un compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 4, o una composiciïn farmacïutica de acuerdo con cualquiera de las reivindicaciones 5 a 11, para utilizar en el tratamiento de una enfermedad o afecciïn inflamatoria.
14. Un compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 4, o una composiciïn farmacïutica de acuerdo con cualquiera de las reivindicaciones 5 a 11, para utilizar en el tratamiento de una enfermedad del sistema cardiovascular.
15. Un proceso para preparar un compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 4 que comprende la cristalizaciïn de dicha Forma A en un disolvente que se selecciona entre acetonitrilo, tetrahidrofurano, ciclohexanona, butan-1-ol, butironitrilo, cetona isobutil metïlica, cetona etil metïlica y acetona.
Figura 1
Diagrama de difracciïn de rayos X en polvo de la Forma A del tosilato del compuesto (I) .
101520253035
2Theta (ï)
Figura 2 Curva de calorimetrïa diferencial de barrido (CDB) y curva de anïlisis tïrmico gravimïtrico (ATG) de la Forma A del
tosilato del compuesto (I) .
102 DSC
CDB
–– –– – TGA
ATG
100
98
Flujo de calor (W/g)
Heat Flow (W/g)
-
120 170 220
Peso (%)
Weight (%)
Ex hacia abajo Universal V4.5A TA Instruments
Ex Down Temperature (ïC) Temperatura (ïC)
Figura 3
Perfiles comparativos de disoluciïn para comprimidos de la Forma A del tosilato del compuesto (I) (correspondientes a una concentraciïn de 30 mg del compuesto (I) ) que contienen celulosa microcristalina o Isomalt en un medio de disoluciïn de pH 6.8.
Figura 4
Concentraciïn en sangre (nM) en un perro tras la administraciïn del tosilato del compuesto (I) en cïpsula y la base libre del compuesto (I) administrada como una suspensiïn acuosa.
Figura 5
Perfil de disoluciïn de una composiciïn de comprimidos recubiertos con una pelïcula que contienen la Forma A del tosilato del compuesto (I) de acuerdo con el Ejemplo 10 (puntos de datos representados por cuadrados) y de la Forma A del tosilato del compuesto (I) en una cïpsula (puntos de datos representados por rombos) .
Cïpsula (n=2)
Capsule (n=2)
Comprimido (n=6)
Tablet (n=6) 100
Dissolv ed (% LC)
0 50 100 150 200 250 300
Tiempo (min)
Time (min)
Figura 6
Perfil de disoluciïn de composiciones de comprimidos que contienen un 5% y un 0% de fosfato de calcio dibïsico descritas en la Tabla 7 del Ejemplo 13.
Figura 7
Diagrama de difracciïn de rayos X en polvo de la Forma B del tosilato del compuesto (I) .
Intensidad (recuento)
Figura 8
Diagrama de difracciïn de rayos X en polvo del 2, 5-dimetilbencenosulfonato del compuesto (I) .
Intensidad (recuento)
5 101520253035
2Theta (ï)
Patentes similares o relacionadas:
Compuestos heterocíclicos que activan AMPK y métodos de uso de los mismos, del 29 de Julio de 2020, de RIGEL PHARMACEUTICALS, INC.: Un compuesto que es N-((cis)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; N-((3S,4S)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Formas en estado sólido de sales de Nilotinib, del 15 de Julio de 2020, de PLIVA HRVATSKA D.O.O: Una forma cristalina de fumarato de Nilotinib designada como Forma III, caracterizada por datos seleccionados de uno o más de los siguientes: a. un patrón de […]
Inhibidores de Bcl-2/Bcl-xL y su uso en el tratamiento de cáncer, del 15 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF MICHIGAN: Compuesto que tiene una estructura **(Ver fórmula)**
Derivado de dihidropiridazin-3,5-diona, del 15 de Julio de 2020, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen […]