FORMULACIONES DE VALSARTAN.
Una formulación farmacéutica en forma de comprimido que consiste en
del 20 al 34% de valsartán (peso/peso) como principio activo,
celulosa microcristalina y almidón pregelatinizado en una relación de peso de entre 1:1 y 5:1,
dióxido de silicio coloidal
estearato de magnesio
el comprimido se puede preparar mediante compresión directa de los ingredientes a una presión de 90 N a 270 N
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E08104077.
Solicitante: SANOVEL ILAC SANAYI VE TICARET ANONIM SIRKETI.
Nacionalidad solicitante: Turquía.
Dirección: BUYUKDERE CAD. DEREBOYU SOK. ZAGRA ISMERKEZI C BLOK MASLAK,80670 ISTANBUL.
Inventor/es: TURKYILMAZ,ALI, CIFTER,UMIT, TURP,HASAN ALI.
Fecha de Publicación: .
Fecha Solicitud PCT: 23 de Mayo de 2008.
Fecha Concesión Europea: 9 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/41 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con cinco eslabones con varios heteroátomos, uno al menos nitrógeno, p. ej. tetraazoles.
- A61K9/20H6F2
- A61K9/20H6F4
Clasificación PCT:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Formulaciones de valsartán.
La presente invención se refiere a una nueva formulación farmacéutica en forma de un comprimido que consiste en valsartán como el principio activo, almidón pregelatinizado y celulosa microcristalina.
Antecedentes de la invención
Valsartán, un compuesto que tiene el nombre químico de N-(1-oxopentil)-N-[[2'-(1h-tetrazol-5-il)[1,1'-bifenil]-4-il]-metil]-L-valina, de fórmula I;
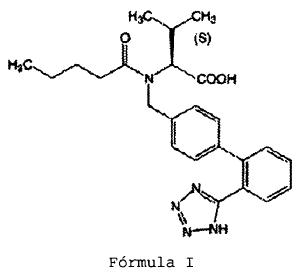
El valsartán pertenece al grupo de fármacos que bloquean los receptores de angiotensina II y de esta manera producen un descenso en la presión sanguínea. Actualmente los comprimidos de valsartán están comercializados por Novartis como DIOVAN® en dosis de 40, 80, 160 y 320 mg y se usa para tratar la hipertensión.
WO 9524901 A1 (CIBA-GEIGY AG) 07-03-1995, página 6 se dirige al uso de valsartán para el tratamiento de nefropatía diabética. Se divulga una cápsula de gelatina dura que comprende valsartán.
En la solicitud de patente internacional WO 9524901 A1 (CIBA-GEIGY AG) 07-03-1995, ejemplo 1, se describe una forma farmacéutica en cápsula de la siguiente composición:

La forma farmacéutica en cápsula descrita anteriormente se prepara mediante el método siguiente. Se granulan el valsartán y la celulosa microcristalina mediante una granulación húmeda con una solución de povidona y lauril sulfato de sodio en agua. Los gránulos se secan. Se añaden la crospovidona y el estearato de magnesio al granulado seco y la mezcla se rellenan las cápsulas.
WO 9749394 A2 (NOVARTIS AG), 18-06-1997, página 14, ejemplo 1:

Se mezclan los primeros cinco componentes de la formulación anterior y se compactan a presiones de 25 a 65 kN. El material compactado se fuerza adicionalmente a través de un tamiz. El granulado producido de esta manera se mezcla con estearato de magnesio y la mezcla se comprime en comprimidos.
Lo que se considera una extraordinaria ventaja del método de producción de la solicitud citada es el hecho de que para la formulación específica es posible encontrar una presión de compactación mínima necesaria dentro del intervalo de presiones de compactación desde 25 hasta 65 kN, lo que produce la obtención de un comprimido que tiene una velocidad de disgregación alrededor de 6 veces más rápida que la obtenida a través de la compactación normal (es decir, usando mayor presión).
WO 9749394 A2 (NOVARTIS AG), 18-06-1997, divulga formas farmacéuticas sólidas orales comprimidas, por ejemplo, mediante compactación de valsartán (opcionalmente en forma de sal) opcionalmente combinado con HCTZ. En esta solicitud, se da el intervalo preferido de celulosa del 10 al 30%, por ejemplo, el 21% para composiciones de valsartán/HCTZ y del 5% para valsartán solo. El intervalo preferido de crospovidona se da como del 10 al 20%, por ejemplo, el 13%.
WO 0038676 A1 (NOVARTIS AG) 22-12-1999, página 24, líneas 23-30, la solicitud se refiere a una forma farmacéutica sólida oral que comprende valsartán como el principio activo y celulosa microcristalina en donde la relación en peso de valsartán a celulosa microcristalina es desde 2,5:1 a 0,3:1, por ejemplo de 2:1 a 1:1, por ejemplo, 1,4:1. Esta solicitud se refiere a una forma farmacéutica sólida oral que comprende valsartán como el principio activo y más del 30% de celulosa microcristalina en peso basado en el peso total de los componentes del núcleo de dicha forma farmacéutica sólida oral, por ejemplo, del 31 al 65%, por ejemplo, el 50%.
WO 0038676 A1, página 24, líneas 15-21, sorprendentemente se ha encontrado que es posible mejorar las características de biodisponibilidad de formulaciones sólidas conocidas de valsartán aumentando la proporción de celulosa microcristalina. También se ha encontrado sorprendentemente que es posible mejorar la calidad, por ejemplo, mejor uniformidad de peso y mejor compresión para los comprimidos, de dichas formulaciones sólidas conocidas de valsartán disminuyendo la proporción de PVP entrecruzada.
En un aspecto adicional, esta solicitud se refiere a una forma farmacéutica sólida oral que comprende valsartán como el ingrediente activo y celulosa microcristalina en donde la relación en peso de valsartán a la celulosa microcristalina es desde 2,5:1 a 0,3:1, por ejemplo de 2:1 a 1:1, por ejemplo, 1,4:1.
WO 2005041941 A2 (ZENTIVA A.S.), 02-11-2004, página 5, líneas 26-32 y página 6, líneas 1-5, el material comprimido descrito en esta solicitud incluye, aparte de la sustancia activa valsartán, opcionalmente valsartán en combinación con HCTZ, otros aditivos, de los que el más importante es un relleno adecuadamente seleccionado, que tiene una importancia decisiva para la calidad de los comprimidos producidos. Para asegurar la función de la compresión directa es necesario seleccionar el relleno que tenga un tamaño de partícula definido y en una cantidad definida.
Una composición preferible del relleno según la invención WO 2005041941 A2 es celulosa microcristalina que tiene un tamaño de partícula de 10 a 1000 µm, preferiblemente de 50 a 190 µm, en especial preferiblemente 90 µm, en cantidades por encima del 40 al 60% en peso, lactosa anhidra secada por rociado que tiene un tamaño de partícula de 10 a 250 µm, preferiblemente de 150 a 250 µm, en cantidades del 30 al 60%, lactosa hidrato compacta que tiene un tamaño de partícula de 10 a 250 µm, en cantidades del 40 al 60% en peso, un polialcohol seleccionado de manitol o sorbitol, que está compactado y tiene un tamaño de partícula de 100 a 850 µm, preferiblemente de 200 a 400 µm, en cantidades del 40 al 60% en peso, hidrogenofosfato de calcio que tiene un tamaño de partícula de 10 a 200 µm en cantidades del 40 al 60% en peso, una combinación de celulosa microcristalina con lactosa, preferiblemente lactosa anhidra secada por rociado, en una relación en peso desde 1:2 a 2:1 en cantidades del 20 al 55%, y una combinación de celulosa microcristalina y un polialcohol, preferiblemente un polialcohol compactado, en una relación de 1:2, en cantidades del 20 al 55%, basado en el peso total de la formulación.
Compendio de la invención
El objetivo de la presente invención es crear un comprimido que contiene valsartán como principio activo, que tiene gran fluidez de polvo y se divide fácilmente en dos o más trozos mientras que es lo suficientemente estable para el transporte y uso comercial y que resiste humedad durante varios días sin coger humedad o romperse si no está envasado en blíster.
Descripción de la invención
El valsartán es un polvo fino de blanco a prácticamente blanco. Es soluble en etanol y metanol y ligeramente soluble en agua. En el estado de la técnica el valsartán se microniza para obtener una mejor disolución. Este proceso produce problemas de fluidez en la producción. Mientras que en el estado de la técnica se conocen comprimidos, dichos comprimidos tienen varias desventajas. Normalmente esos comprimidos son muy porosos y de esta manera no muy duros. Como consecuencia no se pueden partir en dos o más trozos, lo que los hace inútiles para pautas en donde sólo se debe tomar media tableta cada vez. Además estos comprimidos porosos tienden a ser muy sensibles a la humedad. Como consecuencia no se pueden almacenar durante algunos días una vez que se ha abierto el blíster.
Sorprendentemente se ha encontrado que es posible mejorar la estabilidad física de la formulación de valsartán reduciendo la actividad acuosa de la fórmula mediante el uso de relaciones de peso de celulosa microcristalina y almidón pregelatinizado. También se ha encontrado sorprendentemente que es posible mejorar las características de fluidez de formulaciones sólidas conocidas de valsartán aumentando la proporción de celulosa microcristalina y almidón pregelatinizado. Más sorprendentemente es posible mejorar la resistencia a la humedad.
La presente invención se refiere a una formulación farmacéutica en forma de comprimido que consiste en:
Reivindicaciones:
1. Una formulación farmacéutica en forma de comprimido que consiste en
el comprimido se puede preparar mediante compresión directa de los ingredientes a una presión de 90 N a 270 N.
2. El comprimido según la reivindicación 1 en donde el valsartán está presente en una cantidad de entre 80 y 320 mg de valsartán.
3. El comprimido según la reivindicación 1 que consiste en
Patentes similares o relacionadas:
Composiciones que contienen un material biológicamente activo y un óxido inorgánico no ordenado, del 22 de Julio de 2020, de W.R. GRACE & CO.-CONN.: Una composición que comprende un material biológicamente activo y un material de óxido inorgánico, en donde el material de óxido inorgánico comprende […]
Moduladores de la indolamina 2,3-dioxigenasa, del 24 de Junio de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto que tiene la estructura de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: X es **(Ver fórmula)** […]
Compuestos de benzaldehído sustituidos y métodos para su uso en el aumento de la oxigenación tisular, del 27 de Mayo de 2020, de Global Blood Therapeutics, Inc: Un compuesto de Fórmula (I): **(Ver fórmula)** o un tautómero o una sal farmacéuticamente aceptable del mismo, para su uso en el tratamiento […]
Compuesto heterocíclico, del 13 de Mayo de 2020, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un compuesto **(Ver fórmula)** en donde el Anillo A es un anillo opcionalmente sustituido adicionalmente, el Anillo D es un anillo opcionalmente sustituido […]
Derivados de naftofurano para uso como agentes antineoplásicos, del 18 de Marzo de 2020, de KYOTO PHARMACEUTICAL INDUSTRIES, LTD.: Un compuesto representado por la fórmula (IA): **(Ver fórmula)** en donde R1 en el número de n son cada uno en forma independiente […]
Ácidos de carbamoiloximetil triazol ciclohexilo como antagonistas de LPA, del 11 de Marzo de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la fórmula (I): **(Ver fórmula)** o estereoisómeros, tautómeros, sales farmacéuticamente aceptables o solvatos de los mismos, en donde […]
Derivado de la clorina de utilidad en terapia y diagnóstico fotodinámico, del 19 de Febrero de 2020, de RMW Cho Group Limited: Clorina e4 de sodio, que tiene la estructura: **(Ver fórmula)**
AGENTES PARA EL TRATAMIENTO DEL TRASTORNO POR USO DE ALCOHOL, del 13 de Febrero de 2020, de SERVICIO ANDALUZ DE SALUD: La presente invención se refiere al uso de compuestos agonistas PPAR¿ para la prevención, alivio, mejora y/o tratamiento del trastorno por uso de alcohol.