ELEMENTOS DE UNIÓN A CD-3 DESINMUNIZADOS MULTIESPECÍFICOS.
Una construcción de unión específica a CD3 citotóxicamente activa que comprende un primer dominio que se une específicamente a CD3 humano y un segundo dominio de unión derivado de Ig,
en la que dicho primer dominio está desinmunizado y comprende una región CDR-H1 que comprende una secuencia de aminoácidos como se representa en SEC ID Nº: 88, una región CDR-H2 que comprende una secuencia de aminoácidos como se representa en SEC ID Nº: 90 ó 92 y una región CDR-H3, que comprende una secuencia de aminoácidos como se representa en SEC ID Nº: 96, 108, 119, 120, 121, 122, 123, 124, 125, 126 ó 127; y en la que dicho primer dominio comprende adicionalmente en su H1 flanqueante la secuencia VKK y en la que la secuencia de transición entre la región H1 flanqueante y CDRH1 comprende la secuencia Ala-Ser- Gly-Tyr-Thr-Phe (ASGYTF; SEC ID Nº: 233)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/011646.
Solicitante: MICROMET AG.
Nacionalidad solicitante: Alemania.
Dirección: STAFFELSEESTRASSE 2 81477 MUNCHEN ALEMANIA.
Inventor/es: CARR, FRANCIS J., WILLIAMS, STEPHEN, HOFMEISTER,ROBERT, ITIN,CHRISTIAN, KOHLEISEN,Birgit, LENKKERI-SCHÜTZ,Ulla, BÄUERLE,Patrick, HAMILTON,Anita,A.
Fecha de Publicación: .
Fecha Solicitud PCT: 15 de Octubre de 2004.
Clasificación Internacional de Patentes:
- C07K16/28A
- C07K16/28A12
- C07K16/30 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de células tumorales.
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/13 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Inmunoglobulinas.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/13 C12N 15/00 […] › Inmunoglobulinas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2358427_T3.pdf





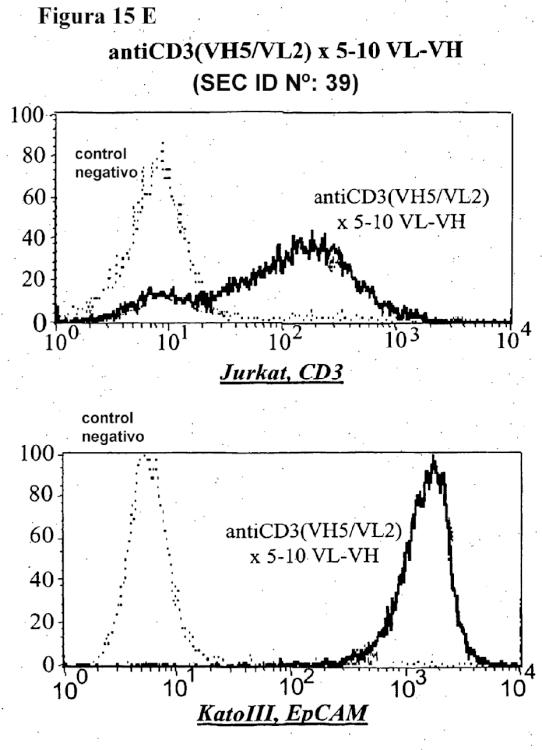
Fragmento de la descripción:
La presente invención se refiere a una construcción de unión específica a un CD3 citotóxicamente activa que comprende un primer dominio que se une específicamente a CD3 humano y un segundo dominio de unión derivado de Ig. Además, se proporciona una secuencia de ácido nucleico que codifica una construcción de unión específica a CD3 de la invención. Son aspectos adicionales de la invención vectores y células huésped que comprenden dicha secuencia de ácido nucleico, un procedimiento para la producción de la construcción de la invención y una composición que comprende dicha construcción. La invención también proporciona el uso de dichas construcciones para la preparación de composiciones farmacéuticas para el tratamiento de enfermedades particulares y un kit que comprende la construcción de unión de la invención.
CD3 humano indica un antígeno que se expresa en linfocitos T como parte del complejo de linfocitos T multimolecular y que consiste en tres cadenas diferentes: CD3-, CD3- y CD3-. El agrupamiento de CD3 en linfocitos T, por ejemplo, por anticuerpos anti-CD3 inmovilizados conduce a una activación de linfocitos T similar a la unión del receptor de linfocitos T pero independientemente de su especificidad típica de clon; véase Documento WO 99/54440 ó Hoffman (1985) J. Immunol. 135:5-8.
Se describen anticuerpos que reconocen específicamente antígeno CD3 en la técnica anterior, por ejemplo en Traunecker, EMBO J 10 (1991), S655-9 y Kipriyanov, Int. J. Cáncer 77 (1998), 763-772. Recientemente, se han propuesto los anticuerpos dirigidos contra CD3 en el tratamiento de una diversidad de enfermedades. Estos anticuerpos o construcciones de anticuerpos actúan como agentes de agotamiento de linfocitos T o como agentes mitógenos, como se desvela en el Documento EP 1 025 854. Se desvelan anticuerpos híbridos de ser humano/roedor que se unen específicamente al complejo de antígeno CD3 humano en el Documento WO 00/05268 y se proponen como agentes inmunosupresores, por ejemplo para el tratamiento de episodios de rechazo después del trasplante de aloinjertos renales, sépticos y cardiacos. El Documento WO 03/04648 desvela un anticuerpo biespecífico dirigido a CD3 y a un antígeno de cáncer ovárico. Además, Kufer (1997) Cancer Immunol lmmunother 45:193-7 se refiere a un anticuerpo biespecífico específico para CD3 y EpCAM para la terapia del cáncer residual mínimo.
Sin embargo, los anticuerpos de la técnica anterior dirigidos contra CD3 derivan de fuentes no humanas. Esto conduce a varios problemas graves cuando se usan tales anticuerpos anti-CD3 como parte de un régimen terapéutico en seres humanos.
Un problema tal es “síndrome de liberación de citocinas (CRS)”. CRS es un síndrome clínico que se ha observado después de la administración de las primeras pocas dosis de anticuerpo anti-CD3 y está relacionado con el hecho de que muchos anticuerpos dirigidos contra CD3 son mitógenos. In vitro, los anticuerpos mitógenos dirigidos contra CD3 inducen proliferación de linfocitos T y producción de citocinas. In vivo, esta actividad mitógena conduce a la liberación a gran escala de citocinas, incluyendo muchas citocinas derivadas de linfocitos T, durante las horas iniciales después de la primera inyección de anticuerpo. La capacidad mitógena de anticuerpos específicos de CD3 es dependiente de monocito/macrófago e implica la producción de IL-6 e IL-1 por estas células.
Los síntomas de CRS varían de síntomas “de tipo gripe” suaves a reacciones presentadas menos frecuentemente de “tipo choque” graves (que pueden incluir manifestaciones cardiovasculares y del sistema nervioso central). Los síntomas incluyen, entre otros, cefalea, temblor, náusea/vómitos, diarrea, dolor abdominal, malestar y achaques de los músculos/articulaciones, debilidad generalizada, acontecimientos cardiorrespiratorios así como acontecimientos neuropsiquiátricos. Se han producido varios edemas pulmonares en pacientes con sobrecarga de fluidos y en los que no parecían tener una sobrecarga de fluidos. Otro problema grave que obstaculiza el uso terapéutico de, especialmente, anticuerpos monoclonales murinos es la inducción de la respuesta inmune humoral contra tales anticuerpos, dando como resultado la producción de anticuerpos anti-ratón humanos (“HAMA”) (Schroff (1985) Cáncer Res.45:879-885, Shawler (1985) J. Immunol. 135:1530-1535). Los HAMA típicamente se generan durante la segunda semana de tratamiento con el anticuerpo murino y neutralizan los anticuerpos murinos, bloqueando de este modo su capacidad para unirse a su diana pretendida. La respuesta de HAMA puede depender de las regiones de anticuerpo constantes murinas (“Fc”) y/o la naturaleza de las regiones variables murinas (“V”).
La técnica anterior contiene diversos enfoques para reducir o prevenir la producción de HAMA mediante la modificación de anticuerpos monoclonales de origen no humano.
Un enfoque para reducir la inmunogenicidad de tales anticuerpos es mediante humanización, como por ejemplo se describe en el Documento WO 91/09968 y el Documento US 6.407.213. En general, la humanización implica sustituciones de secuencia de anticuerpo no humanas con secuencias humanas correspondientes, como es el caso por ejemplo con insertos de CDR.
Otro enfoque para reducir la inmunogenicidad de tales anticuerpos es mediante desinmunización, como por ejemplo se describe en los Documentos WO 00/34317, WO 98/52976, WO 02/079415, WO 02/012899 y WO 02/069232. En general, la desinmunización implica llevar a cabo sustituciones de aminoácidos dentro de epítopos de linfocitos T potenciales. De este modo, la probabilidad de que una secuencia dada de lugar a epítopos de linfocitos T tras el procesamiento proteico intracelular se reduce. Además, el Documento WO 92/10755 describe un enfoque en el que se desarrollan por ingeniería genética determinantes antigénicos en proteínas. Particularmente, las proteínas se mapean con respecto a epítopos y su secuencia de aminoácidos se cambia a través de ingeniería genética.
Sin embargo, los anticuerpos humanizados con frecuencia muestran una afinidad de unión disminuida con respecto a su diana en comparación con sus anticuerpos parentales no humanizados y también con frecuencia aún son inmunogénicos en cierta medida en un huésped humano.
Por lo tanto, el problema técnico de la presente invención fue la provisión de medios y procedimientos para el tratamiento de y/o el alivio de enfermedades tumorales, trastornos proliferativos así como enfermedades relacionadas con linfocitos B por inducción de respuesta inmune mediada por linfocitos T. Los medios y procedimientos anteriormente mencionados deberían superar las desventajas mencionadas de terapias basadas en anticuerpos conocidas.
La solución a dicho problema técnico se consigue proporcionando los anticuerpos caracterizados en las reivindicaciones.
En consecuencia, la presente invención se refiere a una construcción de unión específica a CD3 citotóxicamente activa que comprende un primer dominio que se une específicamente a CD3 humano y un segundo dominio de unión derivado de Ig, en la que dicho primer dominio está desinmunizado y comprende una región CDR-H1 que comprende una secuencia de aminoácidos como se representa en SEC ID Nº: 88, una región CDR-H2 que comprende una secuencia de aminoácidos como se representa en SEC ID Nº: 90 ó 92 y una región CDR-H3, que comprende una secuencia de aminoácidos como se representa en SEC ID Nº: 96, 108, 119, 120, 121, 122, 123, 124, 125, 126 ó 127; y en la que dicho primer dominio comprende adicionalmente en su H1 flanqueante la secuencia VKK (Val-Lys-Lys) y en la que la secuencia de transición entre la región flanqueante H1 y CDR-H1 comprende la secuencia Ala-Ser-Gly-Tyr-Thr-Phe (ASGYTF; SEC ID Nº: 233).
Se descubrió sorprendentemente que las modificaciones específicas anteriormente mencionadas a regiones CDR así como regiones flanqueantes y sus secuencias de transición correspondientes conducen a moléculas de unión específica a CD3 desinmunizadas que muestran una inmunogenicidad reducida pero conservan su actividad citotóxica en comparación con secuencias no desinmunizadas originales. Este hallazgo fue sorprendente en particular porque no todos los protocolos de desinmunización posibles condujeron a construcciones funcionales bioactivas que muestran actividad citotóxica particular; véanse los ejemplos adjuntos. Además, sorprendentemente las moléculas de unión a CD3 citotóxicamente activas desinmunizadas... [Seguir leyendo]
Reivindicaciones:
1. Una construcción de unión específica a CD3 citotóxicamente activa que comprende un primer dominio que se une
específicamente a CD3 humano y un segundo dominio de unión derivado de Ig, en la que dicho primer dominio está desinmunizado y comprende una región CDR-H1 que comprende una secuencia de aminoácidos como se representa en SEC ID Nº: 88, una región CDR-H2 que comprende una secuencia de aminoácidos como se representa en SEC ID Nº: 90 ó 92 y una región CDR-H3, que comprende una secuencia de aminoácidos como se representa en SEC ID Nº: 96, 108, 119, 120, 121, 122, 123, 124, 125, 126 ó 127; y en la que dicho primer dominio comprende adicionalmente en su H1 flanqueante la secuencia VKK y en la que la secuencia de transición entre la región H1 flanqueante y CDRH1 comprende la secuencia Ala-Ser-Gly-Tyr-Thr-Phe (ASGYTF; SEC ID Nº: 233).
2. La construcción de unión específica a CD3 citotóxicamente activa de la reivindicación 1 que comprende adicionalmente en dicho primer dominio una H3 flanqueante que comprende la secuencia Met-Glu-Leu-Ser (MELS; SEC ID Nº: 234).
3. La construcción de unión específica a CD3 citotóxicamente activa de la reivindicación 1 ó 2 que comprende adicionalmente en dicho primer dominio una H3 flanqueante que comprende la secuencia Ile-Thr-Thr-Asp-Lys (ITTDK; SEC ID Nº: 235).
4. La construcción de unión específica a CD3 de una cualquiera de las reivindicaciones 1 a 3, en la que dicho primer dominio que se une específicamente a CD3 humano comprende una H1 flanqueante como se muestra en SEC ID Nº: 152 ó 153.
5. La construcción de unión específica a CD3 de una cualquiera de las reivindicaciones 1 a 4, en la que dicho primer dominio que se une específicamente a CD3 humano comprende una H2 flanqueante como se muestra en SEC ID Nº: 156 ó 157.
6. La construcción de unión específica a CD3 de una cualquiera de las reivindicaciones 1 a 5, en la que dicho primer dominio que se une específicamente a CD3 humano comprende una H3 flanqueante como se muestra en SEC ID Nº: 160 ó 161.
7. La construcción de unión específica a CD3 de una cualquiera de las reivindicaciones 1 a 6, en la que dicho primer dominio que se une específicamente a CD3 humano comprende una H4 flanqueante como se muestra en SEC ID Nº: 164 ó 165.
8. La construcción de unión específica a CD3 de una cualquiera de las reivindicaciones 1 a 7, en la que dicha construcción comprende una región VH como se representa en SEC ID Nº: 74 ó 76.
9. La construcción de unión específica a CD3 de una cualquiera de las reivindicaciones 1 a 8, en la que dicha construcción comprende una CDR-L1 como se representa en SEC ID Nº: 98 ó 100.
10. La construcción de unión específica a CD3 de una cualquiera de las reivindicaciones 1 a 9, en la que dicha construcción una CDR-L2 como se representa en SEC ID Nº: 102.
11. La construcción de unión específica a CD3 de una cualquiera de las reivindicaciones 1 a 10, en la que dicha construcción comprende una CDR-L3 como se representa en SEC ID Nº: 104.
12. La construcción de unión específica a CD3 de una cualquiera de las reivindicaciones 1 a 11, que comprende una región VL en su parte específica de CD3, en la que dicha región VL se selecciona del grupo que consiste en SEC ID Nº: 78, SEC ID Nº: 80, SEC ID Nº: 82 y SEC ID Nº: 112.
13. La construcción de unión específica a CD3 de cualquiera de las reivindicaciones 1 a 12, en la que dicho segundo dominio derivado de Ig es un scFv.
14. La construcción de unión específica a CD3 de cualquiera de las reivindicaciones 1 a 13, en la que dicho segundo dominio derivado de Ig y/o una región o regiones de engarce de conexión están humanizados y/o desinmunizados.
15. La construcción de unión específica a CD3 de cualquiera de las reivindicaciones 1 a 14, en la que dicho segundo dominio derivado de Ig comprende un sitio de interacción con antígeno con especificidad para una molécula de superficie celular.
16. La construcción de unión específica a CD3 de la reivindicación 15, en la que dicha molécula de superficie celular es un marcador específico de tumor.
17. La construcción de unión específica a CD3 de cualquiera de las reivindicaciones 1 a 16, en la que dicho segundo dominio de unión derivado de Ig comprende un sitio de interacción con antígeno con una especificidad para EpCAM.
18. La construcción de unión específica a CD3 de la reivindicación 17, en la que dicha construcción de unión específica a CD3 comprende una secuencia de aminoácidos seleccionada del grupo de
(a) una secuencia de aminoácidos como se muestra en una cualquiera de SEC ID Nº: 31, 33, 35, 37, 39, 49, 55, 58, 61, 63, 65, 67, 237, 239, 241, 243, 245, 247, 249, 251, 253, 255, 257, 259, 261, 263, 265, 267, 269, 271, 273, 275, 277, 279, 281, 283, 285, 287, 289, 291, 293, 295, 297, 299, 301, 303, 305, 307, 309, 311, 313, 315, 317, 319, 321, 323 y 325;
(b) una secuencia de aminoácidos codificada por una secuencia de ácido nucleico como se muestra en una cualquiera de SEC ID Nº: 30, 32, 34, 36, 38, 48, 54, 57, 60, 62, 64, 66, 236, 238, 240, 242, 244, 246, 248, 250, 252, 254, 256, 258, 260, 262, 264, 266, 268, 270, 272, 274, 276, 278, 280, 282, 284, 286, 288, 290, 292, 294, 296, 298, 300, 302, 304, 306, 308, 310, 312, 314, 316, 318, 320, 322 y 324; y
(c) una secuencia de aminoácidos codificada por una secuencia de ácido nucleico que está degenerada como resultado del código genético para una secuencia de nucleótidos de (b);
(d) y secuencia de aminoácidos codificada por una secuencia de ácido nucleico que hibrida con la hebra complementaria de una secuencia de ácido nucleico como se define en (b) en condiciones de hibridación rigurosas.
19. Una secuencia de ácido nucleico que codifica una construcción de unión específica a CD3 de acuerdo con cualquiera de las reivindicaciones 1 a 18.
20. Un vector que comprende una secuencia de ácido nucleico de acuerdo con la reivindicación 19.
21. El vector de la reivindicación 20, que comprende adicionalmente una secuencia de ácido nucleico que es una secuencia reguladora unida operativamente a dicha secuencia de ácido nucleico de acuerdo con la reivindicación
19.
22. El vector de la reivindicación 20 ó 21, en la que el vector es un vector de expresión.
23. Un huésped transformado o transfectado con un vector de acuerdo con cualquiera de las reivindicaciones 20 a
22.
24. Un procedimiento para la producción de una construcción de unión específica a CD3 de acuerdo con cualquiera de las reivindicaciones 1 a 18 comprendiendo dicho procedimiento cultivar un huésped de la reivindicación 23 en condiciones que permiten la expresión de la construcción polipeptídica y recuperar la construcción polipeptídica producida del cultivo.
25. Una composición que comprende una construcción de unión específica a CD3 de acuerdo con cualquiera de las reivindicaciones 1 a 18 o como se produce por el procedimiento de la reivindicación 24, una molécula de ácido nucleico de la reivindicación 19, un vector de una cualquiera de las reivindicaciones 20 a 22 o un huésped de la reivindicación 23 y, opcionalmente, un compuesto proteínico capaz de proporcionar una señal de activación para células efectoras inmunes.
26. La composición de la reivindicación 25, que es una composición farmacéutica que comprende adicional y opcionalmente, formulaciones adecuadas de vehículo, estabilizadores y/o excipientes.
27. La composición de la reivindicación 25, que es una composición de diagnóstico que comprende adicional y opcionalmente, medios y procedimientos para detección.
28. Uso de una construcción de unión específica a CD3 de acuerdo con cualquiera de las reivindicaciones 1 a 18 o como se produce por el procedimiento de la reivindicación 24; una molécula de ácido nucleico de la reivindicación 19; un vector de una cualquiera de las reivindicaciones 20 a 22; o como huésped de la reivindicación 23, para la preparación de una composición farmacéutica para la prevención, tratamiento o alivio de una enfermedad proliferativa, una enfermedad tumoral, una enfermedad inflamatoria, un trastorno inmunológico, una enfermedad autoinmune, una enfermedad infecciosa, una enfermedad viral, reacciones alérgicas, reacciones parasitarias, enfermedades de injerto contra huésped o enfermedades de huésped contra injerto.
29. El uso de la reivindicación 28, en el que la composición farmacéutica es para administrarse de forma simultánea
o no simultánea con un compuesto proteínico capaz de proporcionar una señal de activación para células efectoras inmunes.
30. Una composición farmacéutica que comprende una construcción de unión específica a CD3 de acuerdo con cualquiera de las reivindicaciones 1 a 18 o como se produce por el procedimiento de la reivindicación 24; una molécula de ácido nucleico de la reivindicación 19; un vector de una cualquiera de las reivindicaciones 20 a 22; o un huésped de la reivindicación 23, para su uso en la prevención, tratamiento o alivio de una enfermedad proliferativa, una enfermedad tumoral, una enfermedad inflamatoria, un trastorno inmunológico, una enfermedad autoinmune, una enfermedad infecciosa, una enfermedad viral, reacciones alérgicas, reacciones parasitarias, enfermedades de injerto contra huésped o enfermedades de huésped contra injerto.
31. La composición farmacéutica de la reivindicación 30 que la composición farmacéutica es para administrarse de forma simultánea o no simultánea con un compuesto proteínico capaz de proporcionar una señal de activación para células efectoras inmunes.
32. Un kit que comprende una construcción de unión específica a CD3 de acuerdo con cualquiera de las reivindicaciones 1 a 18 o como se produce por el procedimiento de la reivindicación 24; una molécula de ácido nucleico de la reivindicación 19; un vector de una cualquiera de las reivindicaciones 20 a 22; o un huésped de la reivindicación 23.
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Bloqueo de CD73, del 22 de Julio de 2020, de Innate Pharma: Un anticuerpo aislado que específicamente se une a un polipéptido CD73 humano en la superficie de una célula y que tiene capacidad de neutralizar […]
Método para purificar anticuerpos, del 8 de Julio de 2020, de UNITED THERAPEUTICS CORPORATION: Método para purificar una composición biológica, que comprende someter a diafiltración la composición biológica con solución salina tamponada con fosfato (PBS) para […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Conjugados fármaco-anticuerpo anti-lrrc15 humano y métodos para su uso, del 17 de Junio de 2020, de AbbVie Inc: Un conjugado de farmaco-anticuerpo anti-huLRRC15 ("ADC") que comprende un agente antimitotico unido a un anticuerpo anti-huLRRC15 por medio de un conector, en donde […]
Cadenas ligeras comunes y procedimientos de uso, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una molécula de unión a antígeno biespecífica activadora de linfocitos T que comprende un primer y un segundo resto de unión a antígeno, en la que el primer resto […]
Anticuerpos anti-CD3 y métodos de uso, del 27 de Mayo de 2020, de GENENTECH, INC.: Un anticuerpo biespecífico que comprende un brazo anti-CD3 que comprende un primer dominio de unión que comprende (a) un dominio VH que comprende una secuencia de aminoácidos […]