Nanocristales de monohidrato de calcipotriol.
Una suspensión de monohidrato de calcipotriol en forma de nanocristales de una distribución de tamaño de partícula en el intervalo de 200-600 nm determinado por dispersión dinámica de luz,
la suspensión comprende además una fase acuosa que incluye un surfactante no iónico, polimérico en una cantidad suficiente para prevenir la formación de agregados y/o el crecimiento de cristales de los nanocristales de monohidrato de calcipotriol.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2010/000183.
Solicitante: LEO PHARMA A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: INDUSTRIPARKEN 55 2750 BALLERUP DINAMARCA.
Inventor/es: PETERSSON,KARSTEN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K9/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
PDF original: ES-2523119_T3.pdf




Fragmento de la descripción:
Nanocristales de monohidrato de calcipotriol Campo de la invención
La presente invención se relaciona con el monohidrato de calcipotriol en forma de nanocristales y la inclusión de los nanocristales en una composición farmacéutica para usar en la prevención o tratamiento de enfermedades y afecciones dérmicas.
Antecedentes de la invención
La soriasis es una enfermedad inflamatoria crónica de la piel que se manifiesta como placas descamativas, eritematosas, secas que resultan de la hiperqueratosis. Las placas se encuentran más frecuentemente en los codos, rodillas y cuero cabelludo, aunque lesiones más extensas pueden aparecer en otras partes del cuerpo, notablemente en la región lumbosacra. El tratamiento más común de la soriasis suave a moderada implica la aplicación tópica de una composición que contiene un corticosteroide como el ingrediente activo. Aunque eficaces, los corticosteroides tienen la desventaja de un número de efectos adversos tales como atrofodermia, estrías, erupciones acneiformes, dermatitis perioral, crecimiento excesivo de hongos y bacterias de la piel, hipopigmentación de la piel pigmentada y rosácea.
Por muchos años, sin embargo, un tratamiento no esteroidal ventajoso de la soriasis ha consistido en el tratamiento tópico con el compuesto análogo de la vitamina D, calcipotriol, formulado en una composición de ungüento (comercializada como ungüento Daivonex® o Dovonex®por LEO Pharma) en la que el calcipotriol se presenta en una composición en solución o crema (comercializada como crema Daivonex® o Dovonex® por LEO Pharma) en la que el calcipotriol se presenta en una suspensión de micropartículas. El solvente en la composición de ungüento es propilenglicol que tiene la ventaja de potenciar la penetración del ingrediente activo en la piel, que conduce a una eficacia mejorada, pero que también se conoce por actuar como un irritante de la piel. Así, se informó que la inclusión de propilenglicol en composiciones tópicas frecuentemente causa que los pacientes desarrollen dermatitis por contacto (un estudio informó una serie de reacciones irritantes al propilenglicol de 12.5 % , cf. M. Hannuksela y otros, Contact Dermatitis 1, 1975, págs. 112-116), y el número de reacciones irritantes aumenta cuando se usa propilenglicol en altas concentraciones (revisado por J. Catanzaro y J. Graham Smith, J. Am. Acad. Dermatol. 24, 1991, pp. 9-95). Debido a la penetración mejorada del calcipotriol en la piel como resultado, entre otros, de la presencia del propilenglicol, se encontró que el ungüento Daivonex® era más eficaz en el tratamiento de las lesiones psoriásicas que la crema Daivonex®, pero también causó irritación en la piel en una proporción significativa de pacientes de soriasis.
Resumen de la invención
La piel humana, particularmente la capa externa, el estrato córneo, proporciona una barrera eficaz contra la penetración de patógenos microbianos y químicos tóxicos. Si bien esta propiedad de la piel es generalmente beneficiosa, complica la administración dérmica de productos farmacéuticos ya que una gran cantidad, si no la mayoría, del ingrediente activo aplicado sobre la piel de un paciente que padece de una enfermedad dérmica puede no penetrar en las capas viables de la piel donde ejerce su actividad. Para asegurar la penetración adecuada del ingrediente activo a la dermis y la epidermis, generalmente se prefiere incluir el ingrediente activo en un estado disuelto, típicamente en presencia de un solvente en la forma de un alcohol, por ejemplo etanol, o diol, por ejemplo propilenglicol. El propilenglicol es un potenciador de penetración bien conocido, es decir, una sustancia que es capaz de penetrar el estrato córneo y "atraer" los componentes de bajo peso molecular tal como los componentes terapéuticamente activos en el vehículo en la epidermis. El propilenglicol puede por sí mismo dar lugar a una irritación significativa de la piel, y es además capaz de "llevar" componentes de bajo peso molecular y potencialmente irritantes del vehículo dentro de la epidermis, que conduce al efecto irritante general de los vehículos convencionales que incluyen al propilenglicol. Por esta razón, la presencia del propilenglicol como solvente en composiciones destinadas para el tratamiento de enfermedades inflamatorias de la piel puede exacerbar la respuesta inflamatoria.
En la investigación que conduce a la presente invención, fue un objetivo proporcionar una composición tópica que comprende calcipotriol como el ingrediente activo, que tiene propiedades de penetración en la piel y actividad biológica comparables con las del ungüento Daivonex®, pero que no contiene propilenglicol como el solvente.
Sorprendentemente se encontró posible preparar monohidrato de calcipotriol en forma de nanocristales que son químicamente estables (es decir no degradados en 24-epi calcipotriol u otros productos de degradación) como
inesperadamente cantidades no significativas de calcipotriol amorfo se forman como resultado de alto estrés o fuerzas de impacto o altas temperaturas durante el nanodimensionado. Además, los nanocristales son físicamente estables ya que no se observa agregación o crecimiento del cristal o cambio en la forma del cristal (polimórfico) en una suspensión de los nanocristales después de la preparación. Los nanocristales se formulan fácilmente en composiciones de crema y ungüento tópicos a partir de los que el calcipotriol (monohidrato) puede penetrar en capas viables de la piel (es decir la dermis y la epidermis) en cantidades comparables a la penetración del calcipotriol del ungüento Daivonex® y resulta en niveles similares o más altos de actividad biológica (según se determina por la activación in vitro de un gen objetivo) sin recurrir a la inclusión de un potenclador de la penetración tal como el propilengllcol que es un potencial irritante de la piel.
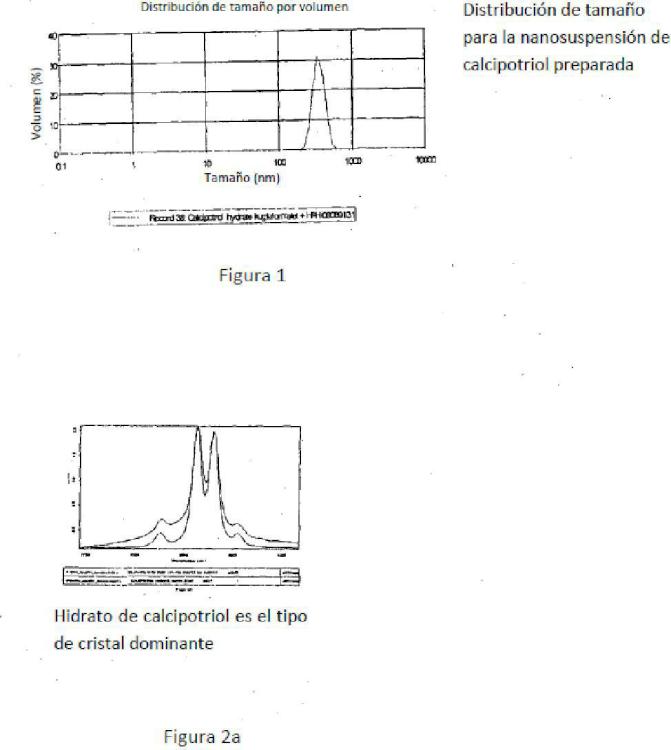
En consecuencia, en un aspecto la presente invención se refiere a una suspensión de monohidrato de calcipotriol en forma de nanocristales de una distribución de tamaño de partícula en el intervalo de 2-6 nm determinado por dispersión dinámica de luz, la suspensión comprende además una fase acuosa que incluye un surfactante no iónico, polimérico en una cantidad suficiente para prevenir la formación de agregados y/o el crecimiento de cristales de los nanocristales de monohidrato de calcipotriol.
En otro aspecto, la solicitud se refiere a un proceso para preparar nanocristales de monohidrato de calcipotriol de una distribución de tamaño de partícula en el intervalo de 2-6 nm determinado por dispersión dinámica de luz, el proceso comprende las etapas de
(a) disminuir el monohidrato de calcipotriol cristalino en una fase acuosa que comprende surfactante no iónico, polimérico en una cantidad en el intervalo de aproximadamente 1 % a aproximadamente 5 % en peso de dicha fase acuosa, lo que resulta en la formación de micropartículas con una distribución de tamaño de partícula en el intervalo de aproximadamente 5-2 pm y un tamaño medio de partícula de aproximadamente 1 pm;
(b) someter la suspensión de la etapa (a) a un primer ciclo de homogeneización a alta presión a una presión de aproximadamente 3-8 bar por un período de tiempo suficiente para obtener aproximadamente 15-4 % de cristales de monohidrato de calcipotriol con una distribución de tamaño de partícula en el intervalo de 2-6 nm;
(c) someter la suspensión de la etapa (b) a un segundo ciclo de homogeneización a alta presión a una presión de aproximadamente 8-12 bar un período de tiempo suficiente para obtener aproximadamente 4-8 % de cristales de monohidrato de calcipotriol con una distribución de tamaño de partícula en el intervalo de 2-6 nm;
(d) someter la suspensión de la etapa (c) a un tercer ciclo de homogeneización a alta presión a una presión de aproximadamente 12-17 bar un período de tiempo suficiente para obtener aproximadamente 9 % o más de cristales de monohidrato de calcipotriol con una distribución de tamaño de partícula en el intervalo de 2-6 nm; y
(e) opcionalmente aislar los nanocristales de monohidrato de calcipotriol resultantes de la fase acuosa.
En un aspecto adicional, la invención se refiere a una composición farmacéutica que comprende los nanocristales de monohidrato de calcipotriol descritos anteriormente y un portador farmacéuticamente aceptable.
Aun en un aspecto, la invención se relaciona con el uso de la composición que comprende nanocristales de monohidrato de calcipotriol o nanosuspensión para el tratamiento de enfermedades o afecciones dérmicas tales como soriasis, sebosoriasis, pustulosis palmoplantar, dermatitis, ictiosis, rosácea o acné.
Breve descripción de las figuras
La... [Seguir leyendo]
Reivindicaciones:
1. Una suspensión de monohidrato de calcipotriol en forma de nanocristales de una distribución de tamaño de partícula en el intervalo de 2-6 nm determinado por dispersión dinámica de luz, la suspensión comprende además una fase acuosa que incluye un surfactante no iónico, polimérico en una cantidad suficiente para prevenir la formación de agregados y/o el crecimiento de cristales de los nanocristales de monohidrato de calcipotriol.
2. La suspensión de conformidad con la reivindicación 1, en donde el surfactante es seleccionado del grupo que consiste en surfactantes de poloxámero o polisorbato, y alquil éter de polioxietileno de C6-24-
3. La suspensión de conformidad con la reivindicación 2, en donde el poloxámero es seleccionado del grupo que consiste en poloxámero 124, poloxámero 188, poloxámero 237, poloxámero 338 y poloxámero 47.
4. La suspensión de conformidad con la reivindicación 3, en donde el surfactante es poloxámero 188.
5. La suspensión de conformidad con la reivindicación 2, en donde el polisorbato es seleccionado del grupo que consiste en polisorbato 2, polisorbato 4, polisorbato 6, polisorbato 61, polisorbato 8 y polisorbato 81.
6. La suspensión de conformidad con la reivindicación 2, en donde el alquil éter de polioxietileno de C6-24 es cetomacrogol 1.
7. La suspensión de conformidad con cualquiera de las reivindicaciones 2-6, en donde la cantidad de surfactante en dicha fase acuosa está en el intervalo de aproximadamente.6 % a aproximadamente 1.2 % en peso de la suspensión.
8. La suspensión de conformidad con la reivindicación 1, en donde los nanocristales de monohidrato de calcipotriol tienen un tamaño medio de partícula de 2-35 nm, 35-4 nm o 4-5 nm determinado por dispersión dinámica de luz.
9. Un proceso para preparar nanocristales de monohidrato de calcipotriol de una distribución de tamaño de partícula en el intervalo de 2-6 nm determinado por dispersión dinámica de luz, el proceso comprende las etapas de
(a) disminuir el monohidrato de calcipotriol cristalino en una fase acuosa que comprende surfactante no iónico, polimérico en una cantidad en el intervalo de aproximadamente 1 % a aproximadamente 5 % en peso de dicha fase acuosa, lo que resulta en la formación de micropartículas con una distribución de tamaño de partícula en el intervalo de aproximadamente 5-2 pm y un tamaño medio de partícula de aproximadamente 1 pm;
(b) someter la suspensión de la etapa (a) a un primer ciclo de homogeneización a alta presión a una presión de aproximadamente 3-8 bar por un período de tiempo suficiente para obtener aproximadamente 15-4 % de cristales de monohidrato de calcipotriol con una distribución de tamaño de partícula en el intervalo de 2-6 nm;
(c) someter la suspensión de la etapa (b) a un segundo ciclo de homogeneización a alta presión a una presión de aproximadamente 8-12 bar un período de tiempo suficiente para obtener aproximadamente 4-8 % de cristales de monohidrato de calcipotriol con una distribución de tamaño de partícula en el intervalo de 2- 6 nm;
(d) someter la suspensión de la etapa (c) a un tercer ciclo de homogeneización a alta presión a una presión de aproximadamente 12-17 bar un período de tiempo suficiente para obtener aproximadamente 9 % o más de cristales de monohidrato de calcipotriol con una distribución de tamaño de partícula en el intervalo de 2- 6 nm; y
(e) opcionalmente aislar los nanocristales de monohidrato de calcipotriol resultantes de la fase acuosa.
1. El proceso de la reivindicación 9, en donde la diminución de la etapa (a) se lleva a cabo mediante molienda de bolas en húmedo por medio del uso de bolas o perlas de un diámetro en el intervalo de 1-4 mm, tal como 1.5-2.5 mm o 2-3 mm.
11. El proceso de la reivindicación 9, en donde el surfactante usado en la etapa (a) es seleccionado del grupo que consiste en surfactantes de poloxámero o polisorbato, y alquil éter de polioxietileno de C6-24-
| 12. | El proceso de la reivindicación 11, en donde el poloxámero es seleccionado del grupo que consiste en poloxámero 124, poloxámero 188, poloxámero 237, poloxámero 338 y poloxámero 47. |
| 13. 14. | El proceso de la reivindicación 12, en donde el surfactante es poloxámero 188. El proceso de la reivindicación 11, en donde el polisorbato es seleccionado del grupo que consiste en polisorbato 2, polisorbato 4, polisorbato 6, polisorbato 61, polisorbato 8 y polisorbato 81. |
| 16. | El proceso de la reivindicación 11, en donde el alquil éter de polioxietileno de C6-24 es cetomacrogol 1. El proceso de cualquiera de las reivindicaciones 9-15, en donde el surfactante se añade en la etapa (a) en una cantidad en el Intervalo de aproximadamente 1.5 a aproximadamente 3 % en peso de la suspensión, en particular aproximadamente 2 % en peso de la suspensión. |
| 17. | El proceso de la reivindicación 9, en donde el primer ciclo de homogeneización a alta presión de la etapa (b) se lleva a cabo a una presión de aproximadamente 5-65 bar. |
| 18. | El proceso de la reivindicación 9, en donde el segundo ciclo de homogeneización a alta presión de la etapa (c) se lleva a cabo aúna presión de aproximadamente 1-11 bar. |
| 19. | El proceso de la reivindicación 9, en donde el tercer ciclo de homogeneización a alta presión de la etapa (d) se lleva a cabo a una presión de aproximadamente 14-15 bar. |
| El proceso de cualquiera de las reivindicaciones 9-19, en donde las etapas de homogeneización a alta presión (b)- (d) se llevan a cabo por medio del uso de un homogeneizador de pistón hueco. | |
| 21. | El proceso de cualquiera de las reivindicaciones 9-2 que comprende además liofilización o secado por aspersión de los nanocrlstales de monohidrato de calclpotrlol. |
| 22. | Una composición farmacéutica que comprende la suspensión de nanocristales de monohidrato de calcipotriol de cualquiera de las reivindicaciones 1-8 y un portador farmacéuticamente aceptable. |
| 23. | La composición de conformidad con la reivindicación 22, en donde la cantidad del surfactante no iónico, polimérico está en el intervalo de aproximadamente.3-.6 % en peso de la composición. |
| 24. | Una composición de conformidad con la reivindicación 22, en donde el portador comprende al menos una parafina seleccionada de parafinas que consiste en hidrocarburos con longitudes de cadena de C5-6, las longitudes de cadena alcanzan un máximo de C14.16, C18-22, C2-22, C2-26, C28-4oy C4-44, mezclas de estas. |
| 25. | Una composición de cualquiera de las reivindicaciones 22-24, que además comprende un emulsionante agua en aceite seleccionado de alquil éteres de polioxietileno de C8-22, por ejemplo estearil éter de polioxietileno, cetil éter de polioxietileno lauril éter de polioxietileno. |
| 26. | Una composición de acuerdo con cualquiera de las reivindicaciones 22-25, que además comprende un ingrediente que aumenta la viscosidad lipofílico. |
| 27. | Una composición de acuerdo con la reivindicación 26, en donde el ingrediente que aumenta la viscosidad es una cera. |
| 28. | Una composición de acuerdo con cualquiera de las reivindicaciones 22-27, que además comprende una cera de silicona un aceite de silicona volátil. |
| 29. | Una composición de acuerdo con la reivindicación 28, en, donde el aceite de silicona volátil es ciclometicona dimeticona. |
| Una composición de acuerdo con cualquiera de las reivindicaciones 22-29, que además comprende un compuesto anti-irritante. |
| 31. | Una composición de acuerdo con la reivindicación 3, en donde el compuesto anti-irritante es glicerina, sorbitol, sacarosa, sacarina, nicotinamida, mentol o eucaliptol. |
| 32. | Una composición de acuerdo con cualquiera de las reivindicaciones 22-31, que además comprende un compuesto capaz de neutralizar las impurezas acídicas perjudiciales para la estabilidad química del monohidrato de calcipotriol en la composición. |
| 33. | Una composición de acuerdo con la reivindicación 32, en donde dicho compuesto es una amina tal como trietanol amina, trometamol, monoetanolamina o dimetanolamina. |
| 34. | Una composición de acuerdo con cualquiera de las reivindicaciones 22-33 que es un ungüento. |
| Una composición de acuerdo con la reivindicación 34 que es un ungüento sustancialmente anhidro. | |
| 36. | Una composición de acuerdo con cualquiera de las reivindicaciones 22-33 que es una crema. |
| 37. | Una composición de acuerdo con cualquiera de las reivindicaciones 22-36 que comprende aproximadamente.1-.5 mg/g, preferentemente aproximadamente.2-.25 mg/g, en particular.5-.5 mg/g, de nanocristales de monohidrato de calcipotriol. |
| 38. | Una composición de acuerdo con cualquiera de las reivindicaciones 22-37, que además comprende uno o más ingredientes adicionales terapéuticamente activos. |
| 39. | Una composición de acuerdo con la reivindicación 38, en donde tales ingredientes activos adicionales son seleccionados del grupo que consiste de fármacos antiinflamatorios tales como corticosteroides, tal como betametasona y ésteres de este, por ejemplo el éster de valerato o dipropionato, clobetasol o ésteres de este, tal como el propionato, hidrocortisona o ésteres de estos, tal como el acetato; fármacos antiinflamatorios no esteroides tales como naproxeno, indometacina, diclofenaco, ibuprofeno, dexibuprofeno, cetoprofeno, flurbiprofeno, piroxicam, lornoxicam o nabumeton, inhibidores de la fosfodiestreasa 4 o inhibidores de la MAP cinasa p38. |
| Una composición de acuerdo con cualquiera de las reivindicaciones 22-39 para usar en el tratamiento de una enfermedad o afección dérmica. | |
| 41. | La composición para usar de conformidad con la reivindicación 4, en donde la enfermedad o afección dérmica es soriasis, sebosoriasis, pustulosis palmoplantar, dermatitis, ictiosis, rosácea o acné. |
Patentes similares o relacionadas:
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]
Composiciones bucales antimicrobianas basadas en sílice, del 1 de Julio de 2020, de Evonik Operations GmbH: Una composición bucal que comprende: (i) un vehículo; (ii) de 0,02 a 2 % p. de un compuesto antimicrobiano catiónico; y (iii) de 0,1 a 4,5 % p. de […]
Granulados secos de polvos de sílice mesoporosa, del 1 de Julio de 2020, de FORMAC PHARMACEUTICALS N.V: Un granulado seco que comprende desde el 50% al 100% p/p de sílice mesoporosa ordenada que tiene una organización bidimensional hexagonalmente […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Composición farmacéutica que comprende partículas de quelante de fosfato, del 3 de Junio de 2020, de Vifor Fresenius Medical Care Renal Pharma, Ltd: Una composición farmacéutica para administración oral, que comprende un quelante de fosfato, donde dicho quelante de fosfato comprende partículas que tienen una distribución […]
Formulaciones de ganaxolona y procedimientos para la preparación y uso de las mismas, del 3 de Junio de 2020, de Marinus Pharmaceuticals, Inc: Una composición que comprende partículas que comprenden ganaxolona; un polímero hidrófilo; un agente humectante; y un agente complejante, en la que el diámetro medio ponderado […]
Procedimiento de estabilización de tamaño de partícula, del 27 de Mayo de 2020, de INKE, S.A.: Un procedimiento para obtener una sal de glicopirronio estable que comprende las siguientes etapas: a) micronizar la sal de bromuro de glicopirronio, opcionalmente […]
Formulaciones de {2-[(1S)-1-(3-etoxi-4-metoxi-fenil)-2-metanosulfonil-etil]-3-oxo-2,3-dihidro-1H-isoindol-4-il}-amida del ácido ciclopropanocarboxílico, del 20 de Mayo de 2020, de Amgen (Europe) GmbH: Una forma de dosificación oral que comprende: 1) una dispersión sólida amorfa de un compuesto de fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente […]