HIDROGELES DE POLOXAMINA Y SU USO PARA LA REGENERACIÓN O REPARACIÓN ÓSEA.
Hidrogeles de poloxamina y su uso para la regeneración o reparación ósea.
La presente invención se relaciona con hidrogeles de poloxamina y ciclodextrina que pueden incorporar una estatina. La incorporación de ciclodextrinas permite disminuir la concentración de poloxamina necesaria para dar lugar a la formación de geles y aumenta además la actividad osteogénica/osteoinductiva de la poloxamina. Dichos hidrogeles promueven la diferenciación de células madre mesenquimales a osteoblastos y pueden utilizarse para la reparación, regeneración o aumento de la formación de hueso.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201330135.
Solicitante: UNIVERSIDADE DE SANTIAGO DE COMPOSTELA.
Nacionalidad solicitante: España.
Inventor/es: ALVAREZ LORENZO,CARMEN, CONCHEIRO NINE,ANGEL, SIMOES,Susana.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/40 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Ciclodextrinas; Sus derivados.
PDF original: ES-2492015_A1.pdf






Fragmento de la descripción:
HIDROGELES DE POLOXAMINA Y SU USO PARA LA REGENERACIÓN O
REPARACIÓN ÓSEA
CAMPO DE LA INVENCIÓN
La presente invención se relaciona con hidrogeles de poloxamina y ciclodextrina que pueden incorporar una estatina. Dichos hidrogeles promueven la diferenciación de células madre mesenquimales a osteoblastos y pueden utilizarse para la reparación, regeneración o aumento de la formación de hueso.
ANTECEDENTES DE LA INVENCIÓN
La prevalencia de enfermedades osteodegenerativas así como de fracturas accidentales, principalmente debido a la esperanza de vida más prolongada y la popularización de las prácticas deportivas, promueve la búsqueda de alternativas a los injertos autólogos y de donante así como a los soportes precargados con costosas proteínas morfogénicas recombinantes. En la actualidad, las proteínas morfogénicas óseas (BMPs), principalmente rhBMP-2 y/o rhBMP-7, se utilizan en clínica incorporadas a esponjas de colágeno para fracturas abiertas de tibia que no cierran y fusiones espinales. También se encuentran en fase de estudio los portadores que pueden ser aplicados en el defecto crítico empleando técnicas mínimamente invasivas, y que además ofrecen estabilización y lenta eliminación de las BMPs del lugar de aplicación. Sin embargo, la rápida metabolización local y el alto coste de las proteínas recombinantes obliga a buscar moléculas sintéticas osteogénicas/osteoinductivas que sean más asequibles y estables y que mimeticen los estímulos bioquímicos que las células madre mesenquimales (MSCs) reciben en su nicho óseo nativo para diferenciarse a precursores de hueso.
Las estatinas son potentes profármacos de inhibidores de la 3-hidroxi-3- metilglutaril-coenzima A (HMG-CoA) reductasa, que actúan bloqueando la conversión de HMG-CoA mevalonato, metabolito clave en la biosíntesis de colesterol. Varios estudios han puesto de manifiesto que las estatinas, en particular la simvastatina, promueven la osteogénesis en líneas celulares murinas y humanas. Comparativamente con otros agentes sintéticos osteoinductivos, las estatinas tienen la ventaja adicional de promover la formación de nuevos vasos sanguíneos (angiogénesis) y de actuar como antiinflamatorios. Se ha demostrado que las estatinas inducen la expresión de BMP-2 y estimulan la formación de hueso de la bóveda craneal (calvaria) de ratones tras la administración diaria de inyecciones subcutáneas (G. Mundy, Science 1999, 286, 1946). Las dosis requeridas para dar lugar a efectos osteoinductivos son mayores que las
requeridas como hipolipemiantes, lo que podría provocar efectos secundarios graves si se administrarse por vía sistémica. La administración oral también se ve limitada por la baja solubilidad de la simvastatina y la tendencia a que se abra el grupo lactona resultando en la forma hidroxiácida, que difícilmente atraviesa la pared del intestino.
En la solicitud de patente WO2011/144785 se describe el uso de copolímeros de bloque de poli(óxido de etileno)-poli(óxido de propileno) (PEO-PPO) de la familia de las poloxaminas (Tetronic®) para la diferenciación de MSCs en osteoblastos. La actividad osteoinductiva intrínseca de las poloxaminas ofrece nuevas perspectivas en el abordaje de la regeneración de hueso al permitir utilizar procedimientos mínimamente invasivos; es decir, la preparación de sistemas acuosos de baja viscosidad que pueden ser fácilmente administrados utilizando una jeringuilla y que experimentan una transición de solución a gel a 37 °C, convirtiéndose en soportes viscoelasticos osteoinductivos. No obstante, la obtención de geles capaces de permanecer en el sitio de inyección (el defecto crítico en nuestro caso) y sostener la liberación del agente terapéutico incorporado requiere una alta concentración del copolímero de bloque. Por ello, sería deseable encontrar sistemas que permitan reducir la concentración del copolímero para reducir así posibles problemas de toxicidad sin detrimento de su efectividad.
RESUMEN DE LA INVENCIÓN
Los inventores han encontrado que la combinación de estatinas y poloxaminas producen un efecto osteogénico y/o osteoinductivo sinérgico. Y además que la incorporación de ciclodextrinas promueve complejos de inclusión con las poloxaminas dando lugar a la formación de hidrogeles que permiten disminuir la concentración de las poloxaminas y que además permiten una liberación controlada de estatinas.
Por tanto, en un primer aspecto, la invención se dirige a un hidrogel que comprende al menos una poloxamina, al menos una ciclodextrina y al menos una estatina.
En otro aspecto, la invención se refiere al uso del hidrogel de la invención como vehículo para la administración de una molécula biológicamente activa adicional.
Otro aspecto se refiere al uso del hidrogel de la invención en la preparación de un medicamento.
Otro aspecto de la invención se refiere al uso del hidrogel de la invención para la preparación de un medicamento para inducir o aumentar la diferenciación de células mesenquimales a osteoblastos, preferiblemente para la reparación, regeneración o aumento de la formación de hueso.
En otro aspecto, la invención se dirige a una composición farmacéutica que
comprende el hidrogel de la invención y un excipiente farmacéuticamente aceptable.
Otro aspecto se refiere a un implante que comprende el hidrogel o la composición farmacéutica de la invención.
En otro aspecto, la invención se dirige a un método in vitro para inducir la diferenciación de células mesenquimales, excepto células madre embrionarias humanas, en osteoblastos que comprende poner en contacto (a) el hidrogel de la invención, con (b) células mesenquimales, excepto células madre embrionarias humanas, que se encuentran en un medio de cultivo.
Otros aspectos adicionales se refieren al hidrogel de la invención para su uso como medicamento y para inducir o aumentar la diferenciación de células mesenquimales a osteoblastos, preferiblemente para su uso en la reparación, regeneración o aumento de la formación de hueso.
En otro aspecto, la invención se refiere a un método para inducir o aumentar la diferenciación de células mesenquimales a osteoblastos, preferiblemente para la reparación, regeneración o aumento de la formación de hueso en un paciente, que comprende la administración del hidrogel de la invención.
RESUMEN DE LAS FIGURAS
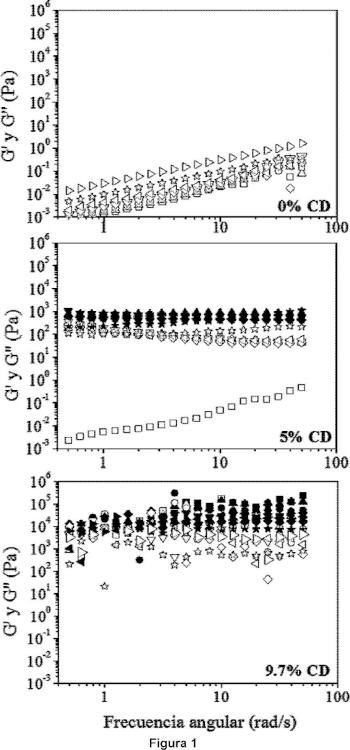
Figura 1. Módulos de almacenamiento (símbolos llenos - G) y de pérdida (símbolos vacíos - G") de las formulaciones de T908-aCD preparadas con 1% (cuadrados), 2% (triángulos hacia arriba), 3% (círculos), 4% (triángulos hacia abajo), 5% (diamantes), 8% (triángulos hacia la izquierda), 13% (estrellas) y 20% (triángulos hacia la derecha) de T908, sin aCD o con 5% y 9,7% aCD a 37°C.
Figura 2. Viabilidad de osteoblastos en contacto con geles supramoleculares de T908- aCD.
Figura 3. Cesión de simvastatina a 37 °C a partir de formulaciones de Tetronic 908 al 4% (cuadrados) y al 8% (círculos), sin aCD (símbolos vacíos y línea continua), con 5% aCD (símbolos con relleno negro y línea continua) y con 9,7% aCD (símbolos con relleno negro y línea discontinua). 100% cedido correspondería a 0,064 mg/cm2.
Figura 4. Evolución temporal de la proliferación de las células madre mesenquimales (determinada utilizando el ensayo MTT) en medio de cultivo (control negativo), medio osteogénico (control positivo) y medio de cultivo al que se incorporó disolución de simvastatina al 0,08, 0,85, 8,5 y 42,5 pM, que se representan en la figura con los siguientes símbolos: ^control negativo; control positivo; HH 0,08 pM de
simvastatina; 0,85 pM de simvastatina; ^55^ 8,5 pM de simvastatina; 42,5
pM de simvastatina. Las concentraciones finales de fármaco en el medio de cultivo fueron 0,01, 0,1, 1 y 5 |jM, respectivamente.
Figura 5. Actividad ALP de células madre mesenquimales en medio de cultivo (control negativo), medio osteogénico (control positivo) y en medio de cultivo al que se incorporó disolución de simvastatina al 0,08, 0,85, 8,5 y 42,5 pM, que se representan en la figura con los siguientes símbolos: ^control negativo; control positivo; HUI 0,08 pM de simvastatina; 0,85 pM de simvastatina; 8,5 pM de simvastatina; 42,5 pM de simvastatina. Las concentraciones finales de fármaco en el medio de cultivo fueron 0,01, 0,1, 1 y 5 pM, respectivamente.
Figura 6. Evolución temporal de la proliferación de las células madre mesenquimales (determinada utilizando el ensayo MTT) en medio de cultivo (control negativo), medio osteogénico (control positivo) y medio de cultivo al que se incorporaron las formulaciones de T908 sin y con aCD y simvastatina, que se representan en la figura con... [Seguir leyendo]
Reivindicaciones:
1. Hidrogel que comprende al menos una poloxamina, al menos una ciclodextrina y al menos una estatina.
2. Hidrogel según la reivindicación 1, donde la poloxamina tiene la siguiente fórmula estructural
H_(OC2H4)a(OC3H6)b^ //(C3H60)b_(C2H40)^H
n-ch2-ch2-n^
H-(OC2H4)a-(OC3H6)b'/ \C3H60)b-(C2H40)a-H
donde a y b tienen, independientemente entre sí, un valor medio de entre 2 y 150.
3. Hidrogel según la reivindicación 2 donde a tiene un valor medio de entre 112 y 116 y b tiene un valor medio de entre 18 y 22.
4. Hidrogel según cualquiera de las reivindicaciones 1 a 3, donde la poloxamina tiene un peso molecular promedio de entre 5000 y 30000 Da.
5. Hidrogel según cualquiera de las reivindicaciones 1 a 4, donde la poloxamina se encuentra en una concentración de entre el 1 y el 20% p/v.
6. Hidrogel según cualquiera de las reivindicaciones 1 a 5, donde la ciclodextrina es a- ciclodextrina.
7. Hidrogel según cualquiera de las reivindicaciones 1 a 6, donde la ciclodextrina se encuentra en una concentración de entre el 1 y el 20% p/v.
8. Hidrogel según cualquiera de las reivindicaciones 1 a 7, donde la poloxamina se encuentra en una concentración de entre el 3 y el 9% p/v y la ciclodextrina se encuentra en una concentración de entre el 3 y el 8% p/v.
9. Hidrogel según cualquiera de las reivindicaciones 1 a 8, donde la poloxamina tiene
un valor medio de a entre 112 y 116, un valor medio de b entre 18 y 22 y un peso molecular promedio entre 20000 y 30000 Da, y la ciclodextrina es a-ciclodextrina.
10. Hidrogel según cualquiera de las reivindicaciones 1 a 9, donde la estatina es simvastatina.
11. Uso de un hidrogel según cualquiera de las reivindicaciones 1 a 10 para la preparación de un medicamento.
12. Uso de un hidrogel según cualquiera de las reivindicaciones 1 a 10 para inducir o aumentar la diferenciación de células mesenquimales a osteoblastos
13. Uso de un hidrogel según cualquiera de las reivindicaciones 1 a 10 para la preparación de un medicamento para la reparación, regeneración o aumento de la formación de hueso.
14. Uso de un hidrogel según cualquiera de las reivindicaciones 1 a 10 para la preparación de un medicamento para el tratamiento o la prevención de una enfermedad o condición seleccionada de osteoporosis, osteoartritis, osteopenia, enfermedad de Paget, fractura ósea, defectos críticos, pseudoartrosis, pérdidas de reserva ósea, hipocalcemia, erosiones periarticulares en artritis reumatoide, osteodistrofia, osteomalacia, lesiones osteoliticas producidas por metástasis de hueso, enfermedad ósea metastásica.
15. Composición farmacéutica que comprende un hidrogel según cualquiera de las reivindicaciones 1 a 10 y un excipiente farmacéuticamente aceptable.
16. Composición según la reivindicación 15, donde la composición farmacéutica es una composición inyectable.
17. Composición según cualquiera de las reivindicaciones 15 o 16, donde la composición farmacéutica es una composición de cesión controlada.
18. Implante que comprende un hidrogel según cualquiera de las reivindicaciones 1 a 10.
19. Implante según la reivindicación 18 seleccionado de implante dental e implante ortopédico.
20. Método in vitro para inducir la diferenciación de células mesenquimales, excepto
células madre embrionarias humanas, en osteoblastos que comprende poner en
contacto (a) un hidrogel según cualquiera de las reivindicaciones 1 a 10, con (b) células mesenquimales, excepto células madre embrionarias humanas, que se encuentran en un medio de cultivo.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
COMPOSICIÓN PARA AUMENTAR LA SOLUBILIDAD DE COMPUESTOS, del 9 de Junio de 2020, de ASÍN LLORCA, Manuel: La presente invención se refiere a una composición que comprende al menos una ciclodextrina, benzoato sódico, y sorbato potásico. La presente invención […]
Formulación farmacéutica basada en minoxidil para uso tópico y kit de la misma, del 3 de Junio de 2020, de Farmalabor S.r.l: Una disolución viscosa o formulación de gel para el tratamiento tópico de la alopecia androgenética, que comprende: - minoxidil como principio activo a una concentración […]
Método de producción de compuestos de inclusión de flavonoide, del 3 de Junio de 2020, de TAIYO KAGAKU CO., LTD.: Un método de producción de un compuesto de inclusión de flavonoide, que comprende una etapa de escisión que comprende tratar un flavonoide escasamente […]
Formulaciones transdérmicas de pergolida y utilizaciones de las mismas, del 3 de Junio de 2020, de Audevard: Formulación transdérmica de tipo sin parche para la utilización en el tratamiento de la enfermedad de Cushing equina en un equino, que comprende pergolida o una sal de la misma, […]
Formulación granular compleja con estabilidad mejorada, que comprende levocetirizina y montelukast, del 13 de Mayo de 2020, de HANMI PHARM. CO., LTD.: Una formulación granular compleja que comprende: (a) una primera parte granular que comprende levocetirizina o una sal farmacéuticamente aceptable de la misma, ciclodextrina […]
Activación de procaspasa 3 mediante terapia de combinación, del 19 de Febrero de 2020, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: Una composición que comprende: (a) un compuesto PAC-1: **(Ver fórmula)** (b) un segundo agente activo, en donde el segundo agente activo es bortezomib, […]
Complexación continua de ingredientes farmacéuticos activos, del 19 de Febrero de 2020, de Hovione Scientia Limited: Un procedimiento de preparación de un complejo de al menos una ciclodextrina y al menos un ingrediente farmacéutico activo que comprende las etapas de: a. Preparar una primera […]