Conjugado de factor viia - ácido (poli)siálico con una vida media in vivo prolongada.
Constructo proteináceo modificado químicamente que comprende
a) una molécula de factor VII activado (FVIIa) seleccionado entre el grupo consistente en FVIIa plasmático y FVIIa recombinante (rFVIIa) y un derivado biológicamente activo de FVIIa que presenta una identidad de secuencia de aminoácidos superior al 90% con respecto al FVIIa de longitud completa;
y
b) al menos un ácido polisiálico que comprende de 1 a 4 unidades de ácido siálico unido a dicha molécula de FVIIa;
donde el ácido polisiálico se enlaza de forma covalente directamente con al menos un residuo aminoácido de dicha molécula de FVIIa; y donde la vida media in vivo de dicho constructp en la sangre de un mamífero se prolonga en comparación con la vida media in vivo de una molécula de FVIIa que no está modificada químicamente.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/087553.
Solicitante: BAXTER INTERNATIONAL INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE BAXTER PARKWAY DEERFIELD, ILLINOIS 60015 ESTADOS UNIDOS DE AMERICA.
Inventor/es: TURECEK, PETER, SCHEIFLINGER, FRIEDRICH, SIEKMANN,JUERGEN, CANAVAGGIO,MICHEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/48
PDF original: ES-2521490_T3.pdf



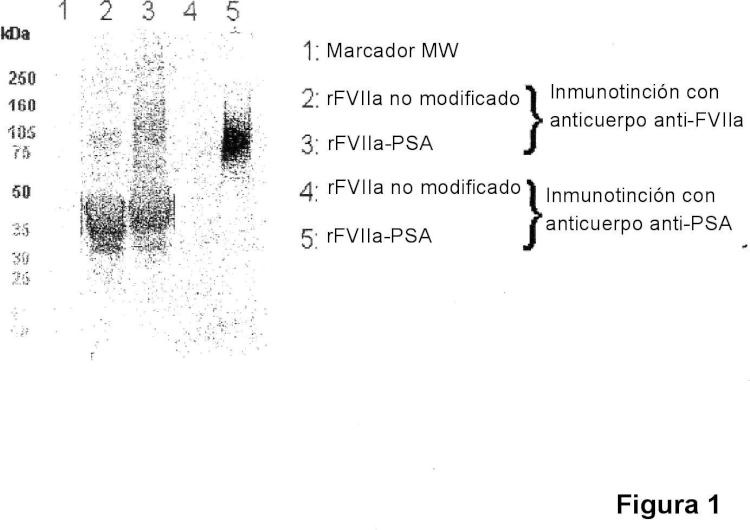
Fragmento de la descripción:
Conjugado de factor VIIa - ácido (poli) siálico con una vida media in vivo prolongada.
CAMPO DE LA INVENCIÓN
La presente invención se refiere a un constructo proteináceo que comprende factor de coagulación VIIa (FVIIa) que está unido a una fracción carbohidrato que incluye una cadena de 1-4 unidades de ácido siálico. Además, la 5 presente invención se refiere a métodos para prolongar la vida media in vivo de proteínas de coagulación sanguínea, en especial de FVIIa en la sangre de un mamífero que padece un trastorno hemorrágico asociado a defectos funcionales o deficiencias de al menos FVIIa, factor VIII (FVIII) y factor IX (FIX) .
ANTECEDENTES DE LA INVENCIÓN
La cascada de la coagulación sanguínea se divide en tres segmentos diferentes: las vías intrínseca, extrínseca y 10 común (Schenone y col., Curr Opin Hematol. 2004; 11: 272-7) . La cascada implica una serie de enzimas serina proteasa (zimógenos) y cofactores de proteína. Cuando se requiere, un precursor de zimógeno inactivo se convierte en la forma activa, que en consecuencia convierte la siguiente enzima de la cascada.
La vía intrínseca requiere de los factores de coagulación VIII, IX, X, XI y XII. La iniciación de la vía intrínseca se produce cuando la precalicreína, quininógeno de alto peso molecular, factor XI (FXI) y factor XII (FXII) se exponen a 15 una superficie cargada negativamente. También se requieren iones calcio y fosfolípidos segregados por las plaquetas.
La vía extrínseca se inicia en caso de daños en el lumen vascular de los vasos sanguíneos. El factor tisular de glicoproteína de membrana queda expuesto y se une al factor VII (FVII) circulante y a pequeñas cantidades preexistentes de su forma activada FVIIa. Esta unión facilita la conversión completa de FVII en FVIIa y, 20 posteriormente, en presencia de calcio y fosfolípidos, la conversión del factor IX (FIX) en factor IXa (FIXa) y del factor X (FX) en factor Xa (FX) . La asociación del FVIIa con el factor tisular intensifica la actividad proteolítica, provocando un acercamiento más estrecho de los sitios de unión de FVII para el sustrato (FX y FIX) e induciendo un cambio conformacional que intensifica la actividad enzimática del FVIIa. La tasa de activación del FX por la vía extrínseca es aproximadamente 50 veces más lenta que la velocidad alcanzada por la vía (intrínseca) de FIXa, 25 FVIIIa, fosfolípido e iones calcio.
La activación del FX es el punto común de las dos vías. Junto con fosfolípidos y calcio, los factores Va (FVa) y Xa convierten la protrombina en trombina (complejo de protrombinasa) , que después descompone el fibrinógeno para formar monómeros de fibrina. Los monómeros se polimerizan formando cadenas de fibrina. El factor XIIIa (FXIIIa) une estas cadenas entre sí de forma covalente para formar una red rígida. 30
La conversión del FVII en FVIIa también es catalizada por una serie de proteasas, incluyendo trombina, FIXa, FXa, factor XIa (FXIa) y factor XIIa (FXIIa) . Para la inhibición de la fase temprana de la cascada, el inhibidor de la vía del factor tisular se dirige al complejo producto FVIIa/factor tisular /FXa.
El FVII (también conocido como factor estable o proconvertina) es una glicoproteína de serina proteasa dependiente de la vitamina K con un papel fundamental en la hemostasia y la coagulación (Eigenbrot, Curr Protein Pept Sci. 35 2002; 3: 287-99) .
El FVII es sintetizado en el hígado y segregado como una glicoproteína monocatenaria de 48 kD. El FVIIa comparte con todas las glicoproteínas de serina proteasa dependientes de la vitamina K una estructura de dominio de proteína similar, consistente en un dominio de ácido gamma-carboxiglutámico (Gla) amino-terminal con 9-12 residuos, responsable de la interacción de la proteína con las membranas lipídicas, un dominio de serina proteasa carboxi-40 terminal (dominio catalítico) y dos dominios similares al factor de crecimiento epidérmico que contienen un sitio de unión de iones calcio que media en la interacción con el factor tisular.
La gamma-glutamil-carboxilasa cataliza la carboxilación de los residuos Gla en la porción amino-terminal de la molécula. La carboxilasa depende de una forma reducida de la vitamina K para desarrollar su acción, que se oxida en la forma epoxídica. La epóxido reductasa de vitamina K es necesaria para convertir la forma epoxídica de la 45 vitamina K de vuelta a la forma reducida.
La mayoría del FVII circula en el plasma en forma de zimógeno, y la activación de esta forma conduce a la descomposición del enlace peptídico entre la arginina 152 y la isoleucina 153. El FVIIa activado resultante consiste en una cadena ligera derivada de NH2 (20 kD) y una cadena pesada derivada de COOH terminal (30 kD) unidas por un único enlace disulfuro (Cys 135 a Cys 262) . La cadena ligera contiene el dominio Gla de unión de membrana, 50 mientras que la cadena pesada contiene el dominio catalítico.
La concentración de FVII en plasma determinada por factores genéticos y ambientales es de aproximadamente 0, 5 mg/ml (Pinotti y col., Blood. 2000, 95:3423-8) . Diferentes genotipos de FVII pueden conducir a diferencias varias veces mayores en los niveles medios de FVII. El nivel de FVII en plasma ses elevado durante el embarazo en hembras sanas y también aumenta con la edad, y es más alto en hembras y en personas con hipertrigliceridemia. El FVII tiene la vida media más corta de todos los factores de procoagulación (3-6 h) . La concentración media de FVIIa 5 en plasma es de 3, 6 ng/ml en individuos sanos y la vida media del FVIIa en circulación es relativamente larga (2, 5 h) en comparación con otros factores de coagulación.
La deficiencia de FVII hereditaria es un trastorno hemorrágico recesivo autosómico raro, con una prevalencia estimada de 1 caso por 500.000 personas en la población general (Achar y a y col., J Thromb Haemost. 2004; 2248-56) . La deficiencia de FVII adquirida de inhibidores es también muy rara. También se ha informado sobre casos 10 donde la deficiencia se produce en asociación con fármacos tales como cefalosporinas, penicilinas y anticoagulantes orales. Además se ha informado de deficiencias de FVII adquiridas producidas espontáneamente o con otras enfermedades, como mieloma, sepsis, anemia aplástica, con terapia de interleuquina-2 y globulina antitimocito.
La terapia de sustitución es el pilar principal del tratamiento de pacientes con deficiencia de FVII (Mariani y col., Semin Hematol. 2006; 43 (Suppl 1) : S42-7) . Ésta se lleva a cabo tradicionalmente utilizando plasma fresco 15 congelado (fresh frozen plasma - FFP) , concentrados de complejo protrombínico (prothrombin complex concentrates - PCC) o concentrados de FVII derivados de plasma. Sin embargo, el FVIIa recombinante (rFVIIa) no se utiliza mucho para la terapia de estos pacientes.
También se ha desarrollado rFVIIa para el tratamiento de hemorragias en pacientes de hemofilia A y B con inhibidores, comprobándose que induce una hemostasia incluso durante cirugías mayores, como cirugía mayor 20 ortopédica (Hedner, J Biotechnol. 2006; 124: 747-57) . Actualmente se está produciendo rFVIIa en cultivos de células BHK y se ha comprobado que es muy similar al FVIIa derivado de plasma. El uso de rFVIIa en el tratamiento de la hemofilia se basa en la unión de baja afinidad del FVIIa con la superficie de plaquetas activadas con trombina. Mediante la administración de dosis farmacológicas de rFVIIa exógeno se incrementa la generación en la superficie plaquetaria en el sitio de la lesión, independientemente de la presencia de FVIII/FIX. Debido a la mayor y rápida 25 formación de trombina, se forma un fuerte coágulo hemostático de fibrina.
Aunque originalmente se desarrolló para el tratamiento de la deficiencia de FVII y la hemofilia A y B complicada con inhibidores, nuevas indicaciones para el rFVIIa (basadas en informes de casos y ensayos clínicos menores) incluyen el uso en pacientes con enfermedad hepática, trombocitopenia o disfunción plaquetaria cualitativa, así como en pacientes sin trastornos de coagulación que están sangrando a consecuencia de una cirugía extensa o de un 30 traumatismo importante.
Los polipéptidos terapéuticos, fármacos tales como proteínas de coagulación sanguínea que incluyen FVIIa, son degradados rápidamente por las enzimas proteolíticas y son neutralizados por los anticuerpos. Esto reduce su vida media y su tiempo de circulación, limitando así su eficacia terapéutica. Para lograr y mantener el efecto terapéutico o profiláctico deseado del FVIIa se requieren dosis relativamente altas y una administración frecuente. Como 35 consecuencia, es difícil obtener una regulación adecuada de las dosis y la necesidad de... [Seguir leyendo]
Reivindicaciones:
1. Constructo proteináceo modificado químicamente que comprende
a) una molécula de factor VII activado (FVIIa) seleccionado entre el grupo consistente en FVIIa plasmático y FVIIa recombinante (rFVIIa) y un derivado biológicamente activo de FVIIa que presenta una identidad de secuencia de aminoácidos superior al 90% con respecto al FVIIa de longitud 5 completa; y
b) al menos un ácido polisiálico que comprende de 1 a 4 unidades de ácido siálico unido a dicha molécula de FVIIa;
donde el ácido polisiálico se enlaza de forma covalente directamente con al menos un residuo aminoácido de dicha molécula de FVIIa; y donde la vida media in vivo de dicho constructp en la sangre de un mamífero 10 se prolonga en comparación con la vida media in vivo de una molécula de FVIIa que no está modificada químicamente.
2. Constructo proteináceo según la reivindicación 1, caracterizado porque la vida media in vivo de dicho constructo se incrementa en al menos un factor de aproximadamente dos en comparación con la vida media in vivo de una molécula de FVIIa que no está modificada químicamente. 15
3. Constructo proteináceo según la reivindicación 1, caracterizado porque la vida media in vivo de dicho constructo se incrementa en al menos un factor de aproximadamente tres en comparación con la vida media in vivo de una molécula de FVIIa que no está modificada químicamente.
4. Composición farmacéutica que comprende una cantidad eficaz del constructo proteináceo según la reivindicación 1 y uno o más compuestos seleccionados de entre el grupo consistente en vehículo, 20 diluyente, sal, tampón y excipiente farmacéuticamente aceptables.
5. Constructo proteináceo según la reivindicación 1 para su uso para controlar hemorragias en un mamífero que presenta un trastorno hemorrágico asociado con defectos funcionales o deficiencias de al menos uno de FVIIa, factor VIII (FVIII) y factor IX (FIX) .
6. Constructo proteináceo según la reivindicación 1 para su uso para controlar hemorragias en un mamífero 25 durante cirugías o traumas.
7. Kit que comprende una cantidad eficaz del constructo proteináceo de la reivindicación 1 envasada en un recipiente, conteniendo dicho kit opcionalmente un segundo agente terapéutico, y que además comprende una etiqueta unida al recipiente o envasada con éste, etiqueta que describe el contenido del recipiente y proporciona indicaciones y/o instrucciones con respecto al uso del contenido del recipiente para controlar 30 hemorragias en un mamífero.
8. Kit según la reivindicación 7, donde el recipiente es un vial o una botella o una jeringuilla precargada.
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]