Antagonistas de glucagón.
Antagonista de glucagón que comprende la secuencia de la SEQ ID NO:
42, o un derivado de la SEQ ID NO: 42 que difiere de la SEQ ID NO: 42 por sustituciones de aminoácidos en una a tres posiciones de aminoácidos seleccionadas entre las posiciones 5, 6, 8, 9, 12, 13 y 14 de la SEQ ID NO: 42, en la que el NH2 N-terminal del antagonista de glucagón "o derivado" está sustituido por un grupo hidroxilo, de manera que la Phe en la posición 1 del antagonista de glucagón es ácido fenil láctico (PLA), y sales farmacéuticamente del mismo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/080973.
Solicitante: INDIANA UNIVERSITY RESEARCH AND TECHNOLOGY CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 351 WEST 10TH STREET INDIANAPOLIS, IN 46202 ESTADOS UNIDOS DE AMERICA.
Inventor/es: YANG, BIN, DIMARCHI, RICHARD D..
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
PDF original: ES-2509883_T3.pdf




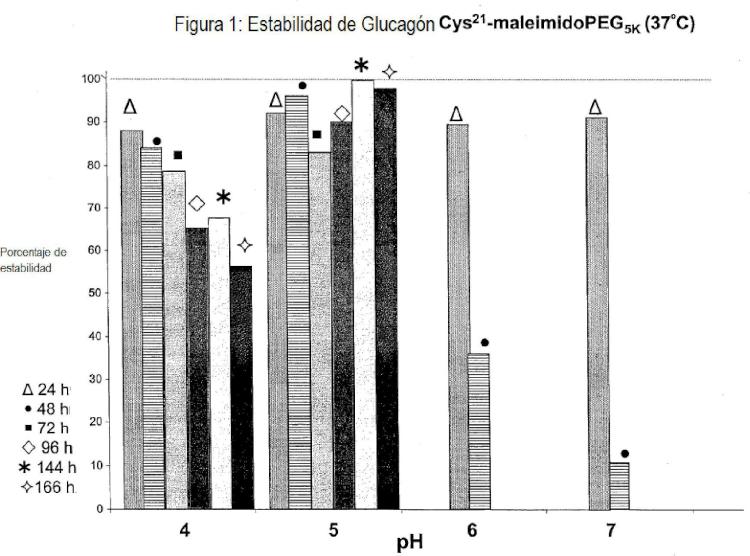
Fragmento de la descripción:
Antagonistas de glucagón ANTECEDENTES
[1] El glucagón nativo es un péptido de 29 aminoácidos que regula los niveles de glucosa en sangre mediante el aumento de la síntesis y la movilización de glucosa en el hígado. En consecuencia, la supresión de la acción del glucagón endógeno ha sido un objetivo para el desarrollo de fármacos para tratar afecciones caracterizadas por una producción excesiva de glucosa, tal como la diabetes.
[2] El glucagón generalmente funciona como una hormona contrareguladora, oponiéndose a las acciones de la insulina, para mantener el nivel de glucosa en sangre, en particular en casos de hipoglucemia. Sin embargo, en algunos pacientes con diabetes tipo 1 o tipo 2, se ha demostrado que los niveles absolutos o relativos elevados de glucagón contribuyen al estado hiperglucémico. Tanto en animales de control sanos como en modelos animales de la diabetes tipo 1 y tipo 2 y, la eliminación de glucagón circulante con anticuerpos selectivos y específicos ha dado como resultado la reducción del nivel glucémico (Brand et al., Diabetologia 37, 985 (1994); Diabetes 43, [supl. 1], 172A (1994); Am. J. Physiol. 269, E469-E477 (1995); Diabetes 44 [supl. 1], 134A (1995); Diabetes 45, 176 (1996)). Estos estudios sugieren que el antagonismo del glucagón podría ser útil en el control glucémico de la diabetes.
[3] El glucagón ejerce su acción uniéndose a su receptor y activando al mismo, que es parte de la rama de glucagón-secretina de la familia de receptores acoplados a proteína G con 7 dominios transmembrana. El receptor funciona mediante la activación de la adenilato ciclasa que da lugar a un aumento de los niveles de AMPc. En informes anteriores se han identificado antagonistas de glucagón a base de péptidos, (ver Unson, CG et al. (1989) J. Biol. Chem. 264, 789-94, Ahn, J. et al. (21) J. Peptide Research 58, 151-8 y Ahn J. et al. (21) J. Med. Chem. 44, 1372-9), así como antagonistas de glucagón a base de nucleótidos (Balandra K. et al. (24) J. Clinical Invest. 113, 1571-1581). La inhibición a base de péptidos actúa a nivel de unión del receptor, mientras que las últimas funciones actúan mediante la supresión de ARNm intracelular específico para el receptor del glucagón.
[4] Se han descrito inhibidores del receptor de glucagón, y generalmente, se basan en la secuencia de aminoácidos del glucagón. Se han descrito varios análogos en los que uno o más aminoácidos se han eliminado o sustituido para producir potentes antagonistas del receptor de glucagón, por ejemplo, [des Hls1] [Glu7 * 9 *]-glucagón amida (Unson et al., (1989) Peptldes 1, 1171; Post et al., (1993) Proc. Nati. Acad. Sel. USA 9, 1662), des His1, Phe6 [Glu9]-glucagón amida (Azizh et al, (1995.) Bloorg. & Med. Chem. Lett. 16, 1849) y Nle9, Ala11,16-glucagón amida (Unson et al. (1994) J. Biol. Chem. 269 (17), 12548). Otros análogos incluyen sustituciones en las posiciones 4 (Ahn JM et al. (21) J. Pept. Res. 58 (2): 151- 8), 1 (Dharanipragada, R. et al. (1993) Int. J. Pept. Res. 42 (1): 68-77) y 4, 5, 12, 17 y 18 en la secuencia del glucagón (Gysin B et al. 1986. Biochemistry 25 (25): 8278-84).
[5] Tal como se describe aquí, se proporcionan antagonistas de glucagón de alta potencia que representan modificaciones del péptido de glucagón nativo. Más particularmente, el nuevo antagonista de glucagón representa nuevas modificaciones químicas del extremo N-terminal de la secuencia de glucagón nativo, produciendo un antagonista altamente específico que no muestra ninguna actividad agonista aparente. Estos compuestos se pueden usar en cualquier situación en la que se desea la supresión del agonismo del glucagón. Según una realización, los compuestos se pueden usar en el tratamiento de la diabetes.
CARACTERÍSTICAS DE LA INVENCIÓN
[6] Según una realización, se proporcionan análogos de glucagón que tienen actividades antagonistas de glucagón puras. Los antagonistas de glucagón se utilizarían en cualquier situación en la que se desea la supresión del agonismo del glucagón. El uso más inmediato y obvio sería en el tratamiento de la diabetes donde el antagonismo del glucagón se ha demostrado en modelos preclínicos de hiperglucemia para producir una disminución de la glucosa en sangre. Estos antagonistas de glucagón se pueden modificar adicionalmente para mejorar la estabilidad biofísica y/o la solubilidad acuosa de los compuestos, mientras se mantiene la actividad antagonista del compuesto original.
[7] Según una realización, se proporciona un antagonista de glucagón que comprende un péptido de glucagón
nativo que ha sido modificado mediante la deleción de los primeros 2-5 residuos de aminoácidos del extremo N- terminal, y una sustitución de ácido aspártico en la posición 9 del péptido nativo con un aminoácido seleccionado del
grupo que consiste en ácido glutámico, ácido homoglutámico, ácido p-homoglutámico, un derivado de ácido sulfónico de
cisteína, o un derivado alquilcarboxilato de cisteína que tiene la estructura de:
H2N
COO H
H ^
S
Í5OH
en la que X5 es alquilo C1-C4, alquenilo C2-C4 o alqulnllo C2-C4.
[8] En una realización, el derivado de ácido sulfónlco de la cisteína es ácido cisteico o ácido homocisteico. En una realización, el ácido carboxílico natural del aminoácido C-terminal se sustituye por un grupo de carga neutra, tal como una amida o éster.
[9] En otra realización, se proporciona un antagonista de glucagón (referido aquí como análogo PLA6) que comprende un péptido de glucagón nativo que ha sido modificado mediante la deleción de los primeros 5 residuos de aminoácidos del extremo N-terminal, y la modificación del aminoácido N-terminal restante (fenilalanina) para reemplazar el grupo amino N-terminal nativo por un grupo hidroxilo (es decir, un ácido fenil-láctico N-terminal (PLA)). El análogo PLA6 aumenta tres veces la afinidad, y la potencia del antagonismo, en relación con un análogo que comprende una deleción de los primeros cinco aminoácidos, pero conserva la fenilalanina nativa N-terminal. En una realización adicional, el residuo de ácido aspártico en la posición de las nueve de la proteína nativa está constituido por un aminoácido seleccionado del grupo que consiste en ácido aspártico, ácido glutámico, ácido homoglutamic, ácido p- homoglutámico, un derivado de ácido sulfónico de cisteína, o un derivado alquilcarboxilato de cisteina que tiene la estructura de:
en la que X5 es alquilo C1-C4, alquenilo C2-C4 o alquinilo C2-C4.
[1] En una realización, el antagonista de glucagón comprende una secuencia seleccionada del grupo que consiste en SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 36, SEQ ID NO: 37 y SEQ ID NO: 38, y en una realización el antagonista de glucagón comprende la secuencia de SEQ ID NO: 7 u 8. 11 * * * *
[11] Según una realización, se proporciona un antagonista de glucagón que comprende la secuencia de SEQ ID NO: 7 o SEQ ID NO: 37, en el que una cadena de polietilenglicol está unida covalentemente a un aminoácido en la posición
11, 12, 16, 19 ó 24, o en el aminoácido N o C-terminal del péptido. En una realización, se proporciona un antagonista de
glucagón que comprende la secuencia de SEQ ID NO: 9, SEQ ID NO: 1, SEQ ID NO: 11 o SEQ ID NO: 12, en el que
una cadena de polietilenglicol está unida covalentemente a un aminoácido en la posición 11 de la SEQ ID NO: 9, la
posición 16 de la SEQ ID NO: 1, la posición 19 de la SEQ ID NO: 11 o en ambas posiciones 11 y 19 de SEQ ID NO:
s
12. En una realización, una sola cadena de polietilenglicol que tiene un peso molecular seleccionado del intervalo de aproximadamente 1. a aproximadamente 5. Daltons está unida covalentemente al péptido antagonista de glucagón. En otra realización, una sola cadena de polietilenglicol que tiene un peso molecular de al menos aproximadamente 2. Daltons está unida covalentemente al péptido antagonista de glucagón. Alternativamente, el antagonista de glucagón comprende la secuencia de SEQ ID NO: 12 y tiene una cadena de polietilenglicol unida covalentemente a las posiciones de los aminoácidos 11 y 19, en el que el peso molecular combinado de las dos cadenas de polietileno es de aproximadamente 1. a aproximadamente 5. Daltons o es mayor que aproximadamente 2. Daltons.
[12] En una realización, se proporciona un antagonista de glucagón en el que el aminoácido carboxi terminal del péptido de SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 36, SEQ ID NO: 39 o SEQ ID NO: 4 está unido covalentemente a un segundo péptido que comprende la secuencia de SEQ ID NO: 19 (GPSSGAPPPS). Estos compuestos se pueden modificar adicionalmente mediante la unión covalente de un... [Seguir leyendo]
Reivindicaciones:
1. Antagonista de glucagón que comprende la secuencia de la SEQ ID NO: 42, o un derivado de la SEQ ID NO: 42 que difiere de la SEQ ID NO: 42 por sustituciones de aminoácidos en una a tres posiciones de aminoácidos seleccionadas entre las posiciones 5, 6, 8, 9, 12, 13 y 14 de la SEQ ID NO: 42, en la que el NH2 N-terminal del antagonista de glucagón o derivado está sustituido por un grupo hidroxilo, de manera que la Phe en la posición 1 del antagonista de glucagón es ácido fenil láctico (PLA), y sales farmacéuticamente del mismo.
2. Antagonista de glucagón, según la reivindicación 1, en el que cuando el antagonista de glucagón comprende la secuencia de la SEQ ID NO: 42:
(i) el aminoácido terminal del antagonista de glucagón tiene un grupo amida en lugar del grupo ácido carboxílico que está presente en el aminoácido nativo,
(ii) el aminoácido en la posición 4 de la SEQ ID NO: 42 es ácido aspártlco,
(iii) el antagonista de glucagón comprende además el aminoácido de la SEQ ID NO: 19 fusionado al aminoácido carboxl terminal de la SEQ ID NO: 42,
(iv) el antagonista de glucagón comprende además un grupo hidrófilo unido covalentemente a un residuo de aminoácido en la posición 11, 16 ó 19 de la SEQ ID NO: 42, y sales farmacéuticamente aceptables de dicho péptldo de glucagón,
(v) el antagonista de glucagón comprende la secuencia de la SEQ ID NO: 46 ó 47,
(vi) cuando el aminoácido en la posición 23 es Asn, el aminoácido en la posición 24 se selecciona del grupo que consiste en Asp o Glu, y, cuando el aminoácido en la posición 24 es Thr, el aminoácido en la posición 23 se selecciona del grupo que consiste en Asp o Glu (según la numeración de la SEQ ID NO: 42),
(vil) el antagonista de glucagón comprende además uno a dos aminoácidos añadidos al extremo carboxl terminal del antagonista de glucagón de la SEQ ID NO: 42, en el que dichos aminoácidos añadidos al extremo carboxi terminal se seleccionan Independientemente del grupo que consiste en Asp o Glu,
(vili) el aminoácido en la posición 1 de la SEQ ID NO: 42 se selecciona del grupo que consiste en Glu, ácido cisteico, ácido homoglutámlco y ácido homocistelco,
(¡x) el antagonista de glucagón comprende la secuencia de cualquiera de las SEQ ID NOs: 7, 8, 36, 37, 39, 4 y 41.
3. Antagonista de glucagón, según la reivindicación 1, en el que el grupo hidrófilo es una proteína plasmática o la parte Fe de una inmunoglobulina, o un polietilenglicol, o un polietilenglicol que tiene un peso molecular de al menos aproximadamente 2. Daltons o un peso molecular seleccionado del intervalo de aproximadamente 1. a aproximadamente 5. Daltons.
4. Antagonista de glucagón, según la reivindicación 3, en el que el antagonista de glucagón tiene la secuencia de cualquiera de las SEQ ID NOs: 9-12, 16-18 y 43-45.
5. Antagonista de glucagón que comprende la estructura general A-B-C, en la que
A es ácido fenil láctico (PLA);
B representa los aminoácidos 7 a 26 de la SEQ ID NO: 1 que comprende una o más modificaciones de aminoácido seleccionadas del grupo que consiste en:
(iv) Asp en la posición 9 (según la numeración de aminoácidos de la SEQ ID NO: 1) está sustituido por Glu, un derivado de ácido sulfónico de Cys, ácido homoglutámico, ácido (3-homoglutámico, o un derivado alquilcarboxilato de cisteína que tiene la estructura de:
s
en la que Xs es alquilo C1-C4, alquenilo C2-C4 o alquinilo C2-C4.
(v) sustitución de uno o dos aminoácidos en las posiciones 1, 2 y 24, (según la numeración de aminoácidos de la SEQ ID NO: 1) por un aminoácido unido covalentemente a un grupo acilo o alquilo a través de un enlace éster, éter, tioéter, amida, o alquilamina;
(vi) sustitución de uno o dos aminoácidos en las posiciones 16, 17, 2, 21, y 24 (según la numeración de aminoácidos de la SEQ ID NO: 1) por un aminoácido seleccionado del grupo que consiste en: Cys, Lys, ornitina, homocisteína, y acetil-fenilalanina (Ac-Phe), en la que el aminoácido del grupo está unido covalentemente a un grupo hidrófilo;
(vii) Asp en la posición 15 (según la numeración de la SEQ ID NO: 1) está sustituido por ácido cisteico, ácido glutámico, ácido homoglutámico, y ácido homocisteico;
(viii) Ser en la posición 16 (según la numeración de la SEQ ID NO: 1) está sustituido por ácido cisteico, ácido glutámico, ácido homoglutámico, y ácido homocisteico;
(ix) sustitución por AIB en una o más de las posiciones 16, 2, 21, y 24 según la numeración de aminoácidos de la SEQ ID NO: 1;
Y
C se selecciona del grupo que consiste en:
(x) X;
(xi) X-Y;
(xii) X-Y-Z; y
(xiii) X-Y-Z-R1,
en el que X es Met, Leu, o Nle; Y es Asn o un aminoácido cargado; Z es Thr, Gly, Cys, Lys, ornitina (Orn), homocisteína, acetil fenilalanina (Ac-Phe), o un aminoácido cargado; en el que R1 se selecciona de un grupo que consiste en las SEQ ID NO: 19-21 y 53; y
(xiv) cualquiera de (x) a (xiii) en que el carboxilato C-terminal está sustituido por una amida o una sal farmacéuticamente aceptable del mismo.
6. Antagonista de glucagón, según la reivindicación 5, en el que: (A) cuando Y o Z es un aminoácido cargado, el aminoácido cargado se selecciona del grupo que consiste en Lys, Arg, His, Asp y Glu, o (B) el antagonista de glucagón comprende además de uno a dos aminoácidos cargados C-terminales a Z, cuando C comprende X-Y-Z.
7. Antagonista de glucagón, según la reivindicación 5 ó 6, en el que B comprende la modificación de aminoácido designada como (v) o (vi), o una combinación de las mismas.
8. Antagonista de glucagón, según la reivindicación 7, en el que B comprende además una o más modificaciones de aminoácido seleccionadas del grupo que consiste en (iv), (vii), (viii), (ix) y una combinación de las mismas.
9. Antagonista de glucagón, según cualquiera de las reivindicaciones 5 a 8, que comprende (A) un grupo hidrófilo unido covalentemente a un residuo de aminoácido en la posición 16, 21 ó 24, según la numeración de la SEQ ID NO: 1, o el residuo N-terminal o C-terminal del antagonista de glucagón o (B) un aminoácido unido covalentemente a un grupo acilo o un grupo alquilo a través de un enlace éster, éter, tioéter, amida o alquilamina, en el que el aminoácido está en la posición 1, 2 ó 24 (según la numeración de aminoácidos de la SEQ ID NO: 1), o es el residuo N-terminal o C-terminal del antagonista de glucagón o, (C) tanto (A) como (B).
1. Dímero o multímero que comprende dos o más antagonistas de glucagón, según cualquiera de las reivindicaciones 1, 2, 3, 4, 5, 6, 7, 8 y 9, o un conjugado que comprende un antagonista de glucagón, según cualquiera de las reivindicaciones 1, 2, 3, 4, 5, 6, 7, 8 y 9, y un péptido heterólogo.
11. Composición farmacéutica estéril que comprende un antagonista de glucagón, según cualquiera de las reivindicaciones 1, 2, 3, 4, 5, 6, 7, 8 y 9, un dímero o multímero o conjugado, según la reivindicación 1, o una combinación de los mismos, y un vehículo farmacéuticamente aceptable.
12. Composición para utilizar en el tratamiento de hiperglucemia, supresión del apetito, reducción de la ganancia de peso, inducción de la pérdida de peso, o tratamiento del desgaste catabólico en un paciente, que comprende un péptido, según cualquiera de las reivindicaciones 1, 2, 3, 4, 5, 6, 7, 8 y 9, un dímero o multímero o conjugado, según la reivindicación 1, o una combinación de los mismos.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]