Utilización de imidazoquinolinas para el tratamiento de enfermedades dependientes de EGFR o enfermedades que han adquirido resistencia a agentes que tienen como objetivo mienbros de la familia de EGFR.
Utilización del compuesto 2-metil-2-[4-(3-metil-2-oxo-8-quinolin-3-il-2,
3-dihidro-imidazo[4,5-c]quinolin-1-il)-fenil]-propionitrilo (Compuesto A) o uno de sus tautómeros, o una sal farmacéuticamente aceptable, o uno de sus hidratoso solvatos, para la fabricación de una preparación farmacéutica para el tratamiento de una enfermedad dependientede EGFR, en donde la enfermedad que se va a tratar es
• carcinoma pulmonar macrocítico
• cáncer de cabeza y cuello
• carcinoma colorrectal
• cáncer de mama
• tumores malignos cerebrales incluyendo glioblastoma
• cáncer de próstata
• cáncer de vejiga urinaria
• carcinoma de células renales
• cáncer de páncreas
• cáncer de cuello uterino
• cáncer esofágico
• cáncer gástrico
• cáncer ovárico
o cualquiera de sus combinaciones.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/059642.
Solicitante: NOVARTIS AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35 4056 BASEL SUIZA.
Inventor/es: GARCIA-ECHEVERRIA, CARLOS, MAIRA,SAUVEUR-MICHEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/444 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo un ciclo de seis eslabones con el nitrógeno como heteroátomo del ciclo, p. ej. amrinona.
- A61K31/4709 A61K 31/00 […] › Quinoleínas no condensadas conteniendo otros heterociclos.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
PDF original: ES-2401822_T3.pdf
Fragmento de la descripción:
Utilización de imidazoquinolinas para el tratamiento de enfermedades dependientes de EGFR o enfermedades que han adquirido resistencia a agentes que tienen como objetivo miembros de la familia de EGFR.
La presente divulgación describe la utilización del compuesto 2-metil-2-[4- (3-metil-2-oxo-8-quinolin-3-il-2, 3-dihidroimidazo[4, 5-c]quinolin-1-il) -fenil]-propionitrilo (Compuesto A) o uno de sus tautómeros, o una sal farmacéuticamente aceptable, o uno de sus hidratos o solvatos, en el tratamiento de enfermedades dependientes de miembros de la familia de receptores del factor de crecimiento epidérmico (EGFR) (incluyendo EGFR1 también conocido como HER1 o Erb-B1; EGFR2 también conocido como HER2 o Erb-B2; y EGFR3 también conocido como HER3 o Erb-B3)
o enfermedades que han adquirido resistencia a agentes que tienen como objetivo miembros de la familia de EGFR, la utilización de dicho compuesto, o uno de sus tautómeros, o una sal farmacéuticamente aceptable, o uno de sus hidratos o solvatos, para la fabricación de composiciones farmacéuticas para el tratamiento de dichas enfermedades, combinaciones de dichos compuestos con moduladores de EGFR para dicha utilización, métodos para tratar dichas enfermedades con dichos compuestos, y preparaciones farmacéuticas para el tratamiento de dichas enfermedades que comprenden dichos compuestos, solos o en combinación, especialmente con un modulador de EGFR.
Las mutaciones somáticas en el dominio de tirosina cinasa de EGFR se han asociado con la respuesta clínica a un inhibidor de tirosina cinasa de EGFR tal como Gefitinib (fressa®) o Erlotinib (Tarceva®) (Paez et ál., EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy, science, vol 304, 1497-1500) . La resistencia adquirida a moduladores de EGFR se produce en pacientes que inicialmente respondían clínicamente a la terapia, pero a continuación desarrollaban tumores progresivos. Una respuesta refractaria a inhibidores de cinasa de EGFR se ejemplifica con la mutación resistente secundaria T790M (Kobayashi et ál.; EGFR mutation and resistance of non-small cell lung cancer to gefitinib, N. Engl J Med, Vol 352, 786-792) ; que es comparable con la mutación o mutaciones de resistencia observadas para Gleevec/Glivec o Dasatininb en pacientes con leucemia mielógena crónica (CML) (Gorre et ál.; Bcr-Abl point mutants isolated from patients with imatinib mesylate resistant chronic leukemia reamin sensitive to inhibitors of the Bcr-Abl chaperone heat shock protein 90, Blood, vol 100, 30413044) o GIST. (Antonescu et ál.; Acquired resistance to Imatinib in gastrointestinal stromal tumors occurs through secondar y gene mutation, Clin Cancer Res, Vol 11, 4182-4190) .
Existen en la bibliografía evidencias de la activación de la ruta de PI3K aguas abajo de EGFR activado. Así, la ablación genética de la subunidad catalítica de PI3K (p110) en fibroblasto embrionario de ratón hace a las células resistentes para la transformación mediante una forma activada de EGFR (Zhao et ál.; The p110 alpha isoform of PI3K is essential for proper growth factor signaling and oncogenic transformation, PEAS, vol 103, 16296-16300) . HER3 (ErbB-3) , uno de los cuatro miembros de la familia de EGFR y socio de HER1 (EGFR1) a menudo se sobreexpresa en tumores sensibles a inhibidores de EGFR, y aquel está correlacionado con el reclutamiento y la activación de PI3K constitutivos (Engelman et ál.; ErbB-3 mediates phosphoinositide 3-kinase activity In gefitinibsensitive non small cell lung cancer cell lines, PNAS vol 102, 3788-3793; Sergina et ál.; Escape from HER family tyrosine kinase inhibitor therapy by the kinase-inactive HER 3) . La caracterización genética y bioquímica de biopsias de tumor y líneas de células tumorales que albergan amplificación de EGFR y resistencia a inhibidores de EGFR han revelado un estado de activación constitutivo de la ruta de PI3K (Engelman et ál.; Allelic disruption obscures detection of a biologically significant resistance mutation in EGFR amplified lung cancer, The Journal of Clinical investigation, vol 116, 2695-2706) .
Zhao Jean J et ál., Proceedings of the National Academy of Sciences of the United States of America, 31 de octubre de 2006, vol. 103, nº 44, páginas 16296-16300, describen experimentos que implican ratones que portan un alelo condicionalmente elegido como objetivo del gen PI3KCA y sugieren que la isoforma p11Oa de PI3K es esencial para la señalización y la transformación oncogénica del factor de crecimiento apropiado.
Ivanov Vladimir N et ál., Oncogene, 20 de enero de 2005, vol. 24, nº 4, páginas 616-626, divulgan los efectos de un tratamiento combinado de varios inhibidores de EGFR y arsenita sobre melanomas positivos a EGFR humanos.
Bianco et ál. (International Journal of Biochemistr y and Cell Biology, 10 de julio de 2007, vol. 39, nº 7-8, páginas 1416-1431) revisan el papel de EGFR en la carcinogénesis y la progresión de tumores y analizan un número de anticuerpos monoclonales y algunas moléculas pequeñas que actúan como inhibidores de tirosina cinasas.
WO2005/054238 divulga ciertas imidazoquinolinas y sus sales que se describen como útiles en el tratamiento de enfermedades dependientes de proteína cinasas.
Sorprendentemente, se ha encontrado que derivados de imidazoquinolina específicos, que se han descrito en WO2006/122806, provocan una fuerte actividad antiproliferativa y una respuesta antitumoral in vivo de líneas celulares de cáncer de mama y pulmón con EGFR amplificados y/o EGFR1 mutado como un solo agente y en combinación con moduladores de cinasa de EGFR. Por lo tanto, dichos compuestos son útiles para el tratamiento de una enfermedad dependiente de EGFR.
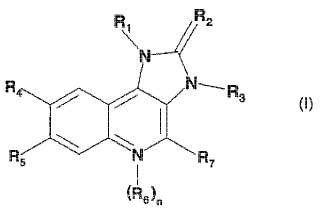
Derivados de imidazoquinolina específicos, su preparación y formulaciones farmacéuticas adecuadas que contienen los mismos se describen en WO2006/122806 e incluyen compuestos de fórmula I
en los que R1 es naftilo o fenilo en donde dicho fenilo está sustituido con uno o dos sustituyentes seleccionados independientemente del grupo que consiste en halógeno; alquilo inferior no sustituido o sustituido con halógeno, ciano, imidazolilo o triazolilo; cicloalquilo; amino sustituido con uno o dos sustituyentes seleccionados independientemente del grupo que consiste en alquilo inferior, alquil (inferior) -sulfonilo, alcoxi inferior y alcoxi (inferior) -alquil (inferior) -amino; piperacinilo no sustituido o sustituido con uno o dos sustituyentes seleccionados independientemente del grupo que consiste en alquilo inferior y alquil (inferior) sulfonilo; 2-oxo-pirrolidinilo; alcoxi (inferior) -alquilo (inferior) ; imidazolilo; pirazolilo; y triazolilo;
R2 es O o S;
R3 es alquilo inferior;
R4 es piridilo no sustituido o sustituido con halógeno, ciano, alquilo inferior, alcoxi inferior o piperacinilo no sustituido o sustituido con alquilo inferior; pirimidinilo no sustituido o sustituido con alcoxi inferior; quinolinilo no sustituido o sustituido con halógeno; quinoxalinilo; o fenilo sustituido con alcoxi;
R5 es hidrógeno o halógeno;
n es 0 o 1 ;
R8 es óxido;
con la condición de que si n=1, el átomo de N que soporta el radical R8 tenga una carga positiva;
R7 es hidrógeno o amino;
o uno de sus tautómeros, o una sal farmacéuticamente aceptable, o uno de sus hidratos o solvatos.
Los radicales y símbolos que se utilizan en la definición de un compuesto de fórmula I tienen los significados que se 25 divulgan en WO2006/122806.
El compuesto de la presente invención es un compuesto que se describe específicamente en WO2006/122806, es decir, el compuesto 2-metil-2-[4- (3-metil-2-oxo-8-quinolin-3-il-2, 3-dihidro-imidazo[4, 5-c]quinolin-1-il) -fenil]propionitrilo (Compuesto A) o uno de sus tautómeros, o una sal farmacéuticamente aceptable, o uno de sus hidratos o solvatos.
Un compuesto de la presente invención muy preferido es el 2-metil-2-[4- (3-metil-2-oxo-8-quinolin-3-il-2, 3-dihidro
imidazo[4, 5-c]quinolin-1-il) -fenil]-propionitrilo (Compuesto A) y su sal de monotosilato. La síntesis de 2-metil-2-[4- (3metil-2-oxo-8-quinolin-3-il-2, 3-dihidro-imidazo[4, 5-c]quinolin-1-il) -fenil]-propionitrilo se describe, por ejemplo, en WO2006/12280 como Ejemplo 1.
Los compuestos que tienen como objetivo miembros de la familia de EGFR según la presente divulgación incluyen moduladores de cinasa de la familia de EGFR, compuestos que alteran los niveles de expresión de EGFR o 35 provocan una respuesta inmunitaria celular conectada a la expresión de miembros de la familia de EGFR en las células tumorales. Los moduladores de EGFR preferibles exhiben su actividad como inhibidores de la actividad funcional de EGFR. Compuestos que tienen como objetivo... [Seguir leyendo]
Reivindicaciones:
1. Utilización del compuesto 2-metil-2-[4- (3-metil-2-oxo-8-quinolin-3-il-2, 3-dihidro-imidazo[4, 5-c]quinolin-1-il) -fenil]propionitrilo (Compuesto A) o uno de sus tautómeros, o una sal farmacéuticamente aceptable, o uno de sus hidratos o solvatos, para la fabricación de una preparación farmacéutica para el tratamiento de una enfermedad dependiente de EGFR, en donde la enfermedad que se va a tratar es
• carcinoma pulmonar macrocítico
• cáncer de cabeza y cuello
• carcinoma colorrectal 10 • cáncer de mama
• tumores malignos cerebrales incluyendo glioblastoma
• cáncer de próstata
• cáncer de vejiga urinaria
• carcinoma de células renales 15 • cáncer de páncreas
• cáncer de cuello uterino
• cáncer esofágico
• cáncer gástrico
• cáncer ovárico 20 o cualquiera de sus combinaciones.
2. La utilización según la reivindicación 1, en la que dicha enfermedad es resistente al tratamiento con un modulador de EGFR seleccionado del grupo que consiste en gefitinib, erlotinib, lapatinib, cetuximab, nimotuzumab, panitumumab y trastuzumab.
3. La utilización según la reivindicación 2, en la que la resistencia al tratamiento con un modulador de EGFR se ha 25 adquirido durante el tratamiento con dicho modulador de EGFR.
4. La utilización según la reivindicación 3, en la que la resistencia se debe a una mutación o mutaciones en la proteína.
5. La utilización según la reivindicación 1, junto con un modulador de EGFR seleccionado del grupo que consiste en gefitinib, erlotinib, lapatinib, NVP-AEE778, ARRY334543, BIRW2992, BMS690514, pelitinib, vandetanib, AV412,
anticuerpo monoclonal anti-EGFR 806, anticuerpo monoclonal anti-EGFR Y90/Re-188, cetuximab, panitumumab, matuzumab, nimotuzumab, zalutumumab, pertuzumab, MDX-214, CDX110, IMC11F8; pertuzumab, trastuzumab, zemab®, la vacuna de Her2 PX 1041, y los inhibidores de HSP90 CNF1010, CNF2024, tanespimicina, alvespimicina, IPI504, SNX5422 y NVP-AUY922.
6. Combinación del compuesto 2-metil-2-[4- (3-metil-2-oxo-8-quinolin-3-il-2, 3-dihidro-imidazo[4, 5-c]quinolin-1-il) -fenil]
propionitrilo (Compuesto A) y un modulador de EGFR seleccionado del grupo que consiste en gefitinib, erlotinib, lapatinib, NVP-AEE778, ARRY334543, BIRW2992, BMS690514, pelitinib, vandetanib, AV412, anticuerpo monoclonal anti-EGFR 806, anticuerpo monoclonal anti-EGFR Y90/Re-188, cetuximab, panitumumab, matuzumab, nimotuzumab, zalutumumab, pertuzumab; MDX-214, CDX110, IMC11F8, pertuzumab, trastuzumab, zemab®, la vacuna de Her2 PX 1041, y los inhibidores de HSP90 CNF1010, CNF2024, tanespimicina, alvespimicina, IPI504,
SNX5422 y NVP-AUY922, en donde los ingredientes activos están presentes en cada caso en forma libre o en la forma de una sal farmacéuticamente aceptable, y opcionalmente al menos un vehículo farmacéuticamente aceptable, para la utilización simultánea, separada o secuencial para el tratamiento de carcinoma pulmonar macrocítico, cáncer de cabeza y cuello, carcinoma colorrectal, cáncer de mama, tumores malignos cerebrales incluyendo glioblastoma, cáncer de próstata, cáncer de vejiga urinaria, carcinoma de células renales, cáncer de páncreas, cáncer de cuello uterino, cáncer esofágico, cáncer gástrico y/o cáncer ovárico.
7. Una preparación farmacéutica para la utilización en el tratamiento de una enfermedad dependiente de EGFR o una enfermedad que ha adquirido resistencia durante el tratamiento con un modulador de EGFR, en donde la enfermedad que se va a tratar es carcinoma pulmonar macrocítico, cáncer de cabeza y cuello, carcinoma colorrectal, cáncer de mama, tumores malignos cerebrales incluyendo glioblastoma, cáncer de próstata, cáncer de vejiga urinaria, carcinoma de células renales, cáncer de páncreas, cáncer de cuello uterino, cáncer esofágico, cáncer gástrico, cáncer ovárico o cualquiera de sus combinaciones, que comprende un compuesto según la reivindicación 1
o una de sus sales farmacéuticamente aceptables y al menos un vehículo farmacéuticamente aceptable.
8. La preparación farmacéutica para la utilización según la reivindicación 7, que comprende además un modulador de EGFR seleccionado del grupo que consiste en gefitinib, erlotinib, lapatinib, NVP-AEE778, ARRY334543, BIRW2992, BMS690514, pelitinib, vandetanib, AV412, anticuerpo monoclonal anti-EGFR 806, anticuerpo monoclonal anti-EGFR Y90/Re-188, cetuximab, panitumumab, matuzumab, nimotuzumab; zalutumumab, pertuzumab, MDX-214, CDX110, IMC11F8, pertuzumab, trastuzumab, zemab®, la vacuna de Her2 PX 1041, y los inhibidores de HSP90 CNF1010, CNF2024, tanespimicina, alvespimicina, IPI504, SNX5422 y NVP-AUY922.
9. Un compuesto según la reivindicación 1 o una de sus sales farmacéuticamente aceptables, para la utilización en el tratamiento de un enfermedad dependiente de EGFR o una enfermedad que ha adquirido resistencia durante el tratamiento con un modulador de EGFR, en donde la enfermedad que se va a tratar es carcinoma pulmonar macrocítico, cáncer de cabeza y cuello, carcinoma colorrectal, cáncer de mama, tumores malignos cerebrales incluyendo glioblastoma, cáncer de próstata, cáncer de vejiga urinaria, carcinoma de células renales, cáncer de páncreas, cáncer de cuello uterino, cáncer esofágico, cáncer gástrico, cáncer ovárico o cualquiera de sus combinaciones.
Patentes similares o relacionadas:
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Análogos de éteres fosfolipídicos como vehículos de fármacos que seleccionan como objetivo el cáncer, del 22 de Julio de 2020, de Cellectar Biosciences, Inc: Un compuesto terapéutico que comprende la fórmula A-B-D, en donde: A es al menos un compuesto de fórmula (I), **(Ver fórmula)** […]