Procedimiento de preparación estereoselectiva de derivados de aminoácidos.
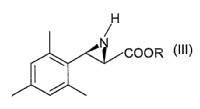
Comprende una reacción de hidrogenación del compuesto de fórmula(III),
alternativamente su enantiómero, donde R es (C1-C8)-alquilo; seguido de una reacción de hidrólisis para dar la L-mesitilalanina, alternativamente su enantiómero D-mesitilalanina y, opcionalmente, someter dicho compuesto a una reacción de protección del.grupo amino, en particular como Fmoc. Comprende también la Fmoc-L- o Fmoc-D- mesitilalánina como productos per se, útiles como intermedios en la preparación de péptidos o análogos peptídicos conactividad terapéutica o biológica.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/ES2008/000724.
Solicitante: BCN PEPTIDES, S.A..
Nacionalidad solicitante: España.
Inventor/es: RAFECAS JANE,LLORENC, RIERA ESCALE,ANTONI, ALONSO XALMA,MONICA, RAMÓN ALBALATE,Rosario.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C227/32 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 227/00 Preparación de compuestos que contienen grupos amino y carboxilo unidos a la misma estructura carbonada. › por síntesis estereoespecífica.
PDF original: ES-2394748_T3.pdf
Fragmento de la descripción:
Procedimiento de preparación estereoselectiva de derivados de aminoácidos
CAMPO DE LA INVENCIÓN
La presente invención está relacionada con un procedimiento para la preparación estereoselectiva de L- y Dmesitilalanina, útiles para la preparación de péptidos. Más particularmente, la invención está relacionada con un procedimiento para la preparación de L-o D-mesitilalanina protegidas con un grupo Fmoc, así como con dichos compuestos per se.
ANTECEDENTES DE LA INVENCIÓN
Los fármacos peptídicos representan un mercado de aproximadamente 1000 millones de dólares estadounidenses y alrededor del 1% del total de ventas de principios activos farmacéuticos. En la actualidad, hay más de cuarenta péptidos sintéticos en el mercado y más de 500 moléculas peptídicas nuevas se encuentran en desarrollo.
La química de péptidos es un área de investigación muy importante ya que estos compuestos presentan interesantes propiedades biológicas y terapéuticas. De la misma manera, los aminoácidos no proteinogénicos tienen una importancia cada vez mayor como intermedios de dichos péptidos con actividad biológica y terapeutica.
Se sabe que la actividad de un fármaco depende de la conformación que es capaz de adoptar en su interacción con el receptor y ésta, por su parte, en el caso de compuestos peptídicos, depende de los aminoácidos presentes en la cadena. Así, una forma de modificar su actividad como fármacos es introducir análogos conformacionalmente restringidos de los aminoácidos que forman parte de la secuencia del péptido biológicamente activo (cfr. e.g. T. Osaka et al., Current Opinion in Chemical Biology 2002, vol. 6, pp. 809-815; D. R. Hodgson et al., Chem. Soc. Rev 2004, vol. 33, pp. 422-430) .
El uso de aminoácidos no naturales incrementa la vida media de los correspondientes péptidos que se degradan más difícilmente por proteasas. Asimismo, se ha descrito que la sustitución de fenilo por mesitilo (2, 4, 6-trimetilfenilo) en diversos aminoácidos incrementa notablemente las barreras rotacionales sin cambiar significativamente la geometría del confórmero más estable (cfr. E Medina et al., Helv. Chim. Acta 2000, vol. 83, pp. 972-988) . Con esta sustitución de fenilalanina por mesitilalanina se han preparado análogos peptídicos con gran actividad biológica, como análogos de [D-har8]vasopresina (cf. M. Zertova et al., Collect. Czech. Chem. Comun. 1993, vol. 58, pp. 2751) , agentes analgésicos y antihipertensivos (cfr. EP 0213481 A2) , análogos de encefalina (cfr. EP 0136720 A2) , análogos de la hormona LHRH (cfr EP 0049628 A1) y péptidos con secuencias de fibroína. La preparación de estos análogos se ha llevado a cabo incorporando el aminoácido protegido con el grupo protector Boc en forma racémica, y posteriormente los péptidos resultantes se han separado por HPLC con una fase estacionaria quiral (cfr. J.Hlavaceck et al., Collect. Czech. Chem. Comun., 1991, vol. 56, p. 2991) .
La L-fenilalanina es un aminoácido natural presente en la mayoría de proteínas y péptidos naturales. La mesitilalanina es un aminoácido no natural útil para la preparación de diversos péptidos y análogos peptídicos. La mesitilalanina se ha preparado en forma racémica y se ha separado de forma analítica, pero no preparativa. Sin embargo, hasta la fecha, el uso de mesitilalanina es poco habitual, probablemente debido a las dificultades encontradas en la preparación de aminoácidos enantioméricamente puros que contienen el grupo mesitilo en la cadena lateral.
E. Medina et al. han descrito una síntesis de mesitilaminoácidos basada en una epoxidación de Sharpless y una aminohidroxilación de Sharpless (cfr. Helv. Chim. Acta 2000, vol. 83, pp. 972-988) . Sin embargo, esta síntesis presenta inconvenientes importantes que dificultan su utilización a nivel industrial. Entre estos inconvenientes destaca que se obtiene una baja conversión en la epoxidación de Sharpless del mesitilpropenol y los crudos de la reacción de aminohidroxilación necesitan ser cromatografiados para eliminar los reactivos en exceso. También está descrita una síntesis del hidrocloruro de la L- mesitilalanina mediante una hidrogenación catalítica asimétrica enantioselectiva de un precursor acetamidoacrilato (cf. T. Li et al., Chem. Pharm. Bull. 2006, vol. 54, pp.873-877) .
Las enseñanzas de todos estos documentos del estado de la técnica muestran que la investigación de nuevos procedimientos para la preparación de L- o D- mesitilaminoácidos es aún un campo activo, en particular de la L- o la D- mesitilalanina, aminoácidos útiles para la preparación de diversos péptidos y análogos peptídicos que presentan una gran actividad biológica pero que han sido poco utilizados hasta la fecha debido a la complejidad de los procedimientos de preparación que se conocen para la preparación de aminoácidos enantioméricamente puros que contienen este grupo.
DESCRIPCIÓN DE LA INVENCIÓN
Los inventores han encontrado un procedimiento práctico con un elevado rendimiento para la preparación de manera estereoselectiva tanto de la L-mesitilalanina como de la D-mesitilalanina. El procedimiento es particularmente
apropiado para la preparación de L- o D-mesitilalanina, protegida lo cual resulta muy conveniente para la síntesis en fase sólida de péptidos.
Así, un primer aspecto de la presente invención, es proporcionar un procedimiento de preparación estereoselectiva de un enantiómero sustancialmente puro de un compuesto de fórmula (I) , alternativamente su enantiómero (I’) ,
COOH
COOH
NHFmoc
NHFmoc
(I) (I’) donde P es hidrógeno o un grupo protector de amina, que comprende las siguientes etapas: a) someter un compuesto de fórmula (III) , alternativamente su enantiómero (III’) , a una reacción de hidrogenación para dar el compuesto de fórmula (II) , alternativamente su enantiómero (II’) ; donde R es (C1-C8) -alquilo;
HH
(III) (III’)
COOR
COOR
NH2
NH2
(II) (II’)
b) someter el compuesto de fórmula (II) , alternativamente su enantiómero (II’) , a una reacción de hidrólisis para dar un compuesto de fórmula (I) , alternativamente su enantiómero (I’) , donde P es hidrógeno y, opcionalmente, someter dicho compuesto (I) , alternativamente su enantiómero (I’) , a una reacción de protección del grupo amino.
Por enantiómero sustancialmente puro se entiende que tiene un exceso enantiomérico de dicho enantiómero igual o superior al 95%, preferentemente igual o superior al 98%, más preferentemente igual o superior al 99%.
Preferentemente, R es un (C1-C4) -alquilo. En una realización particular R es metilo. En otra realización particular, R es etilo.
La etapa de hidrogenación transcurre con rendimiento cuantitativo y regioselectividad completa. La hidrogenación se realiza por los métodos convencionales y con los catalizadores conocidos en el estado de la técnica, como por ejemplo y sin sentido limitativo, metales o complejos metálicos. Preferentemente, el catalizador de la reacción de hidrogenación se selecciona del grupo formado por el catalizador de Wilkinson, catalizador de Crabtree, níquel Raney, metales en estado de oxidación cero en combinación con ácidos próticos o metales del grupo del platino en combinación con carbón activo. Más preferentemente, el catalizador de la reacción de hidrogenación es un metal del grupo del platino en combinación con carbón activo, y en particular paladio/carbón activo (Pd/C) . Entre las fuentes de hidrógeno para la reacción de hidrogenación se encuentran además del hidrógeno (H2) todas aquellas moléculas donoras de hidrógeno conocidas por el experto en la materia, como por ejemplo y sin sentido limitativo, hidrazina, hidrazinas sustituidas, isopropanol o ácido fórmico.
La hidrólisis se puede llevar a cabo en condiciones básicas o ácidas. En una realización preferida, la hidrólisis se lleva a cabo en medio básico. Entre los compuestos que aportan un medio básico a la reacción de hidrólisis se encuentra cualquier base conocida en el estado de la técnica. En una realización más preferida, la base es un hidróxido de metal alcalino. En una realización particular el hidróxido de metal alcalino es hidróxido de litio.
El procedimiento de la presente invención permite proteger la L- mesitilalanina y la D-mesitilalanina con difererentes grupos protectores. Existen numerosos grupos protectores adecuados de la función amino tal como carbamatos, amidas, sulfonamidas, alilo, bencilo opcionalmente sustituido, siendo el sustituyente seleccionado del grupo formado por (C1-C8) -alquilo, (C1-C8) -alcoxilo... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de preparación estereoselectiva de un enantiómero sustancialmente puro de un compuesto de fórmula (I) , alternativamente su enantiómero (I’) ,
(I) (I’)
donde P es hidrógeno o un grupo protector de amina, que comprende las siguientes etapas: a) someter un compuesto de fórmula (III) , alternativamente su enantiómero (III’) , a una reacción de hidrogenación
para dar el compuesto de fórmula (II) , alternativamente su enantiómero (II’) ; donde R es (C1-C8) -alquilo;
HH
(III) (III’)
COOR
COOR
NH2
NH2
(II) (II’)
b) someter el compuesto de fórmula (II) , alternativamente su enantiómero (II’) , a una reacción de hidrólisis para dar un compuesto de fórmula (I) , alternativamente su enantiómero (I’) , donde P es hidrógeno y, opcionalmente, someter dicho compuesto (I) , alternativamente su enantiómero (I’) , a una reacción de protección del grupo amino.
2. Procedimiento de preparación estereoselectiva según la reivindicación 1, donde P se selecciona del grupo formado por carbamato de 9-fluorenilmetilo (Fmoc) , t-butoxicarbonilo (BOC) , benciloxicarbonilo (Cbz) , alilo, 4metoxibencilo, 2, 4-dimetoxibencilo y bencilo.
3. Procedimiento de preparación estereoselectiva según cualquiera de las reivindicaciones 1-2, donde la etapa de hidrogenación se lleva a cabo utilizando como catalizador cualquier metal o complejo metálico.
4. Procedimiento de preparación estereoselectiva según cualquiera de las reivindicaciones 1-3, donde la reacción de hidrólisis se lleva a cabo en medio básico.
5. Procedimiento de preparación estereoselectiva según la reivindicación 4, donde la base de la reacción de hidrólisis es un hidróxido de un metal alcalino.
6. Procedimiento de preparación estereoselectiva según cualquiera de las reivindicaciones 1-5, donde se hace reaccionar el compuesto de fórmula (IV) , alternativamente su enantiómero (IV’) , donde R es (C1-C8) -alquilo,
(IV) (IV’)
con una fosfina de fórmula P (R1) 3, donde R1 se selecciona independientemente entre el grupo formado por (C1-C8) alquilo, (C1-C8) -cicloalquilo, fenilo opcionalmente sustituido, (CH2) n-fenilo opcionalmente sustituido, donde n es un entero de 1 a 4, y los sustituyentes de los radicales con anillos bencénicos se seleccionan independientemente del grupo formado por (C1-C8) -alquilo, (C1-C8) -alcoxilo o halógeno, para para dar el compuesto de fórmula (III) , alternativamente su enantiómero (III’) ,
HH
COOR
COOR
(III) (III’) donde en las fórmulas (III) , (III’) , (IV) y (IV’) R es (C1-C8) -alquilo.
7. Procedimiento de preparación estereoselectiva según la reivindicación 6, donde se hace reaccionar el compuesto de fórmula (V) , alternativamente su enantiómero (V’) ,
(V) (V’)
con una azida de metal alcalino o alcalinotérreo para dar el compuesto de fórmula (IV) , alternativamente su enantiómero (IV’) ,
COOR
COOR
(IV) (IV’) donde en las fórmulas (IV) , (IV’) , (V) y (V’) R es (C1-C8) -alquilo.
8. Procedimiento de preparación estereoselectiva según la reivindicación 7, donde el compuesto de fórmula (VI) , alternativamente su enantiómero de fórmula (VI’) ,
OH OH
COOR
COOR
(VI) (VI’)
se hace reaccionar con un halogenuro de tionilo para dar el compuesto de fórmula (V) , alternativamente su enantiómero (V’) ,
OO OS
OS O
O COOR COOR (V) (V’)
donde en las fórmulas (V) , (V’) , (VI) y (VI’) R es (C1-C8) -alquilo.
9. Procedimiento de preparación estereoselectiva según la reivindicación 8, donde el compuesto de fórmula (VII) (VII)
se somete a una reacción de dihidroxilación asimétrica de Sharpless utilizando un ligando quiral apropiado para dar el compuesto de fórmula (VI) , o alternativamente el compuesto de fórmula (VI’) ,
OH OH
(VI) (VI’) donde en las fórmulas (VI) , (VI’) y (VII) R es alquilo.
10. Procedimiento de preparación estereoselectiva según la reivindicación 9, donde el ligando quiral apropiado se selecciona del grupo formado por hidroquinina 1, 4-ftalazinediil dieter ( (DHQ) 2PHAL) para dar el compuesto de fórmula (VI) o hidroquinidina 1, 4-ftalazinediil dieter ( (DHQD) 2PHAL) para dar el compuesto de fórmula (VI’) .
11. Compuesto Fmoc- (L) -mesitilalanina de fórmula (Ip)
COOH
NHFmoc
Ip
12. Compuesto Fmoc- (D) -mesitilalanina de configuración opuesta al compuesto de fórmula (Ip) .
13. Procedimiento de preparación en fase sólida de péptidos con uno o más residuos de mesitilalanina, que comprende llevar a cabo el procedimiento de preparación estereoselectiva de cualquiera de las reivindicaciones 1
10.
14. Procedimiento de preparación en fase sólida de péptidos según la reivindicación 13, que comprende la utilización de un aminoácido N-protegido seleccionado del grupo formado por: Fmoc- (L) -mesitilalanina, Fmoc- (D) mesitilalanina, Cbz- (L) -mesitilalanina, Cbz- (D) -mesitilalanina, alil- (L) -mesitilalanina, alil- (D) -mesitilalanina, 4metoxibencil- (L) -mesitilalanina, 4-metoxibencil- (D) -mesitilalanina, 2, 4-dimetoxibencil- (L) -mesitilalanina, 2, 4dimetoxibencil- (D) -mesitilalanina, bencil- (L) -mesitilalanina, y bencil- (D) -mesitilalanina.
Patentes similares o relacionadas:
Procedimientos de síntesis asimétrica de la 6-fluoro-L-dopa y de sus análogos, del 7 de Septiembre de 2016, de LABORATOIRES CYCLOPHARMA: Compuesto de fórmula (II): **Fórmula** en la que: F es el 19F o el 18F; R1 representa un grupo aroílo; R2 representa un grupo aroílo; […]
Proceso para preparar ácido 5-bifenil-4-amino-2-metil pentanoico, del 10 de Agosto de 2016, de NOVARTIS AG: Un compuesto de acuerdo con la fórmula , o tautómero, o sal del mismo,**Fórmula** en el que R1 es hidrógeno o un grupo protector de nitrógeno […]
Un proceso de hidrogenación de cetoésteres, del 27 de Enero de 2016, de LONZA LTD.: Un proceso para la produccion de un (S)- o (R)-4-halo-3-hidroxibutirato, que comprende la reaccion de un 4- haloacetoacetato con hidrogeno […]
Procedimiento de producción de un beta-aminoácido ópticamente activo, del 1 de Julio de 2015, de TAKASAGO INTERNATIONAL CORPORATION: Un procedimiento de producción de un ß-aminoácido ópticamente activo de fórmula , **Fórmula** en la que b es 0 o 1; el símbolo * denota que el átomo de carbono es un carbono […]
Procedimiento para la preparación de ácido (R)-(-)-3-(carbamoilmetil)-5-metilhexanoico y de pregabalina e intermediarios de síntesis, del 27 de Mayo de 2015, de LABORATORIO CHIMICO INTERNAZIONALE S.P.A.: Un procedimiento de preparación de acido (R)- -3-(carbamoilmetil)-5-metilhexanoico, que comprende hacer reaccionar racemato de acido 3-(carbamoilmetil)-5-metilhexanoico […]
 Proceso para la preparación de ácido 4-amino-butírico sustituido con biarilo o derivados del mismo y su uso en la producción de inhibidores de NEP, del 23 de Julio de 2014, de NOVARTIS AG: Un proceso para producir un compuesto de acuerdo con la fórmula (I) o una sal del mismo,
en donde R1 y R1` son independientemente hidrógeno […]
Proceso para la preparación de ácido 4-amino-butírico sustituido con biarilo o derivados del mismo y su uso en la producción de inhibidores de NEP, del 23 de Julio de 2014, de NOVARTIS AG: Un proceso para producir un compuesto de acuerdo con la fórmula (I) o una sal del mismo,
en donde R1 y R1` son independientemente hidrógeno […]
Un proceso para la preparación de derivados de isoserina, del 10 de Abril de 2013, de INDENA S.P.A.: Un proceso para la preparación de los compuestos de la Fórmula general en la cual R1 es un grupo (C1-C6)-alquilo lineal o ramificado, un grupo arilo o heteroarilo no substituido […]
Una síntesis asimétrica de ácido (S)-(+)-3-(aminometil)-5-metilhexanoico, del 20 de Marzo de 2013, de TEVA PHARMACEUTICAL INDUSTRIES LTD.: Ácido (3S)-5-metil-3-(2-oxo-2{[(1S)-1-aril-alquil]amino}etil)hexanoico de la siguiente fórmula 24, en la que Ar es un grupo aromático C6-10 y R es un ácido carboxílico, éster […]