Deferasirox para el tratamiento de la hemocromatosis hereditaria.
Utilización del Compuesto de la Fórmula I**Fórmula*+
para la preparación de un medicamento para la utilización en el tratamiento de un exceso de hierro en un pacienteque tiene hemocromatosis hereditaria (HH),
en donde el tratamiento de la HH comprende:
(a) una fase de inducción en la que el Compuesto de la Fórmula I se administra en una dosificación diaria de5 a 20 mg/kg de peso corporal con o sin flebotomía, seguida por
(b) una fase de mantenimiento en la que el Compuesto de fórmula I se administra en una dosis diaria de 1 a 5mg/kg de peso corporal.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/069319.
Solicitante: NOVARTIS AG.
Nacionalidad solicitante: Suiza.
Dirección: CORPORATE INTELLECTUEL PROPERTY CH-4002 BASEL SUIZA.
Inventor/es: NICK,HANSPETER, ROJKJAER,LISA, BODNER,JANET ELLEN, MARKS,PETER WAYNE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4196 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › 1,2,4-Triazoles.
- A61P3/12 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › para la homeostasia de los electrolitos.
- A61P43/00 A61P […] › Medicamentos para usos específicos, no previstos en los grupos A61P 1/00 - A61P 41/00.
PDF original: ES-2440806_T3.pdf
Fragmento de la descripción:
Deferasirox para el tratamiento de la hemocromatosis hereditaria La presente invención se refiere a la utilización del Compuesto I en el tratamiento de la hemocromatosis hereditaria.
Antecedentes de la invención
La hemocromatosis hereditaria, abreviada como HH, es el trastorno monogénico hereditario más común en la población caucasiana. El gen HFE es el nombre del gen de la hemocromatosis. La mutación del gen HFE está asociada muy frecuentemente con la hemocromatosis hereditaria, y está situada en el brazo corto del cromosoma 6. Aproximadamente una de cada 250 a 300 personas blancas es homocigótica para la mutación del gen HFE C282Y y al menos una de cada 10 personas es un portador, es decir la mutación reemplaza la cisteína por tirosina en la posición 282 de la cadena proteínica de los aminoácidos, también escrita como C282Y o Cys282Tyr. Otra mutación común en el gen HFE que puede conducir a sobrecarga de hierro es la mutación H63D, es decir la mutación reemplaza la histidina por ácido aspártico en la posición 63, escrita como H63D o His63Asp. El riesgo de sobrecarga de hierro es superior en personas que son homocigóticas para la mutación C282Y, en comparación con heterocigotos compuestos C282Y/H63D u homocigotos H63D. Otra mutación en el gen HFE, S65C, explica casi 8% de mutaciones de hemocromatosis que no son C282Y ni H63D. La función exacta del producto génico de HFE no se conoce, sin embargo, parece tener parte en la regulación de la expresión de hepcidina.
La HJV, hemocromatosis juvenil, se debe a mutaciones en el gen HJV que codifica hemojuvelina y el gen HAMP que codifica hepcidina. Con la hemocromatosis juvenil, la acumulación de hierro empieza pronto en la vida, y los síntomas se presentan antes de los 30 años. Los hombres y las mujeres están afectados por igual. Los signos y los síntomas de la hemocromatosis juvenil son más graves que los del tipo HFE y las complicaciones implican las glándulas endocrinas y, clínicamente más importante, el corazón. La enfermedad hemocromatosis juvenil debida a mutaciones de HJV y HAMP es muy rara, pero se ha presentado en varios grupos étnicos diferentes. Las mutaciones en los genes HAMP y HFE2 provocan HJV. Los genes HAMP y HFE2 parecen representar un papel en la regulación de la absorción de hierro durante la digestión. El gen HAMP ordena a las células fabricar una pequeña proteína llamada hepcidina, que se identificaba originalmente que tenía propiedades antimicrobianas. La evidencia reciente indica que los niveles de hepcidina son importantes para determinar la cantidad de hierro absorbido de la dieta. Niveles bajos de hepcidina, p. ej. debido a mutación de HAMP, incrementan la entrada de hierro desde la mucosa intestinal. La hemojuvelina actúa aguas arriba de la hepcidina y codetermina la cantidad de expresión de hepcidina. Los investigadores descubrieron recientemente que el nivel de hepcidina representa un papel en el mantenimiento del balance de hierro en seres humanos.
Generalmente, los diversos tipos de hemocromatosis hereditaria se caracterizan por una absorción intestinal incrementada de hierro, que conduce a la deposición de hierro en el cuerpo, es decir en múltiples órganos tales como el hígado, el páncreas, el corazón y otros órganos. El exceso de deposición de hierro, si se deja sin tratar, provoca daño tisular y fibrosis con daño irreversible a diversos órganos, p. ej. órganos sobrecargados de hierro, p. ej. disfunción endocrina o cirrosis hepática.
El inicio del tratamiento de la hemocromatosis hereditaria está indicado para pacientes con evidencia de sobrecarga de hierro basada en parámetros o marcadores de hierro elevados, p. ej. ferritina sérica y saturación de transferrina. La flebotomía es el patrón actual de cuidado debido a que es simple, eficaz y segura. La flebotomía implica la eliminación de hasta dos unidades de sangre, p. ej. de 800 a 1.000 ml correspondientes a aproximadamente 500 mg de hierro por semana, para información, una unidad de sangre, p. ej. aproximadamente 500 ml, elimina aproximadamente 250 mg de hierro. El objetivo es eliminar el hierro corporal en exceso y disminuir el valor de ferritina hasta 50 mcg/l (microgramos por litro) o menos. Esta fase, que lleva hasta 1-3 años, raramente más, corresponde a la llamada "fase de inducción". Una vez que se efectúa la reducción de hierro, la mayoría de los pacientes requiere de cuatro a ocho flebotomías al año para mantener la concentración de ferritina sérica por debajo de 50 mcg/l, esto corresponde a la llamada "fase de mantenimiento".
Sin embargo, de 5 a 10% de los pacientes son poco aptos para, inadecuadamente tratados por, p. ej. debido a un escaso cumplimiento terapéutico, o poco dispuestos a tener flebotomías debido a un mal acceso venoso, anemia, fallo cardíaco congestivo/disfunción del ventrículo izquierdo o "belonefobia".
Una alternativa a la flebotomía es la utilización de la quelación de hierro. El quelante de hierro se puede unir al hierro y promover su secreción. Durante este procedimiento, se administra un fármaco que se une al hierro libre en exceso.
Por lo tanto, existe una necesidad de proporcionar un tratamiento alternativo para pacientes con hemocromatosis hereditaria, p. ej. para pacientes con hemocromatosis poco dispuestos o incapaces de sufrir un régimen de flebotomías. Como la cantidad de hierro eliminada por flebotomía es limitada, y el número de flebotomías que un individuo es capaz de tolerar también es limitado; también existe una necesidad de un tratamiento alternativo para ser utilizado en combinación con la atención estándar, es decir la flebotomía, para acortar la duración de la eliminación de hierro en pacientes con niveles de ferritina moderadamente elevados, a fin de prevenir el avance del daño orgánico.
El tratamiento de la sobrecarga de hierro mediante desferrioxamina (abreviada como DFO) , es decir Desferal®, subcutánea se estudió en 3 pacientes con HH en los que la flebotomía no era posible o no lo era transitoriamente debido a sus graves afecciones clínicas o a la falta de acceso venoso periférico. Se observó que el tratamiento con DFO era tan eficaz como la flebotomía semanal, p. ej. 500 ml (Nielsen P. et al, Br. J. Haematol 2003, 123 (5) :952-3) . Sin embargo, los datos disponibles que presentan la utilización de desferrioxamina en esta población de pacientes son muy limitados.
Por otra parte, a pesar de los méritos de la DFO, la DFO no se puede administrar oralmente y su semivida dentro de la corriente sanguínea es corta. La DFO se administra a través de infusión intravenosa o subcutánea 8-12 h/día al menos 5 días a la semana y conduce a un escaso cumplimiento terapéutico de los pacientes. WO 2005/097062 menciona la utilización potencial del Compuesto I en el tratamiento de la hemocromatosis, sin detalles sobre un protocolo de tratamiento. Se sabe que el Compuesto de fórmula I que se divulga posteriormente se utiliza en el tratamiento de la sobrecarga de hierro en pacientes sometidos a transfusión de sangre, p. ej. en pacientes con talasemia ß. Sin embargo, no hay información disponible o hay muy poca sobre la seguridad del Compuesto I con bajos niveles de ferritina, p. ej. niveles de ferritina por debajo de 500 mcg/l, p. ej. 100 mcg/l, p. ej. 50 mcg/l. Por lo tanto, existía una necesidad de determinar la seguridad del Compuesto I con tales valores bajos de ferritina, p. ej. a fin de determinar un esquema de tratamiento adecuado para la utilización del Compuesto I en la eliminación de hierro en pacientes con hemocromatosis hereditaria. Sorprendentemente, los inventores han encontrado que el Compuesto I es adecuado y seguro para pacientes con hemocromatosis hereditaria.
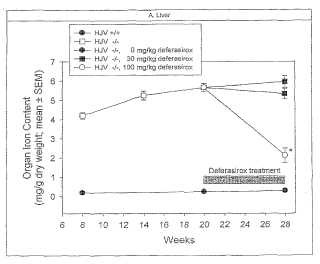
Descripción de los dibujos:
La Figura 1A-D muestra el contenido de hierro en órganos frente al tiempo en semanas en el hígado, el corazón, el bazo y el páncreas.
Descripción Detallada de la Invención:
El Compuesto I es un 3 5-difenil-1, 2, 4-triazol de la siguiente fórmula: ácido 4-[3, 5-bis (2-hidroxifenil) -[1, 2, 4]triazol-1il]benzoico y se puede administrar oralmente.
El Compuesto I tiene la siguiente fórmula:
El Compuesto I en forma de ácido libre, las sales del mismo y sus formas cristalinas se divulgan en la Publicación de Patente Internacional WO 97/49395.
El Compuesto I y su procedimiento de preparación se describen, p. ej., en US 6.465.504 B1.
Preparaciones farmacéuticas que comprenden el Compuesto I se describen en la Solicitud de Patente Internacional WO 97/49395.
Sin embargo, US 6.465.504 no divulga que el Compuesto I sea adecuado para tratar la sobrecarga de hierro debida a hemocromatosis hereditaria. US 6.465.504 no divulga ni la dosificación particular ni... [Seguir leyendo]
Reivindicaciones:
1. Utilización del Compuesto de la Fórmula I
para la preparación de un medicamento para la utilización en el tratamiento de un exceso de hierro en un paciente 5 que tiene hemocromatosis hereditaria (HH) , en donde el tratamiento de la HH comprende:
(a) una fase de inducción en la que el Compuesto de la Fórmula I se administra en una dosificación diaria de 5 a 20 mg/kg de peso corporal con o sin flebotomía, seguida por
(b) una fase de mantenimiento en la que el Compuesto de fórmula I se administra en una dosis diaria de 1 a 5 mg/kg de peso corporal.
2. Utilización según la reivindicación 1, en la que dicho paciente que tiene hemocromatosis hereditaria es poco apto para o es tratado inadecuadamente mediante flebotomía.
3. Utilización según la reivindicación 1 o 2, en la que la hemocromatosis hereditaria se debe a la mutación genética homocigótica C282Y o H63D.
4. Utilización según la reivindicación 1, en la que la fase de inducción se continúa hasta que el nivel de ferritina 15 sérica alcanza un valor de aproximadamente 100 mcg/l.
5. Utilización según la reivindicación 4, en la que el nivel de ferritina sérica alcanza un valor de aproximadamente 50 mcg/ml o menor.
Patentes similares o relacionadas:
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivado de dihidropiridazin-3,5-diona, del 15 de Julio de 2020, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Un compuesto representado por la fórmula (I) o una sal del mismo, o un solvato del compuesto o la sal: **(Ver fórmula)** en donde R1, R4 y R5 se definen […]
Derivado de dihidroindolizinona, del 1 de Julio de 2020, de ONO PHARMACEUTICAL CO., LTD.: (3S)-3-[2-(6-amino-2-fluoro-3-piridinil)-4-fluoro-1H-imidazol-5-il]-7-[5-cloro-2-(1H-tetrazol-1-il)fenil]-2,3-dihidro- (1H)-indolizinona, una…
Inhibidor de fibrosis, del 1 de Julio de 2020, de NIPPON SHINYAKU CO., LTD.: Composición farmacéutica que comprende un derivado heterocíclico seleccionado de ácido 2-{4-[N-(5,6-difenilpirazin-2-il)-N-isopropilamino]butiloxi}acético […]
Derivado de amina cíclica y uso farmacéutico del mismo, del 1 de Julio de 2020, de TORAY INDUSTRIES, INC.: Un derivado de amina cíclica representado por la siguiente fórmula general (I): **(Ver fórmula)** donde R1 representa un grupo alquiloxi que tiene de 1 a 3 átomos […]
Compuestos utilizados como inhibidores de la quinasa reordenada durante la transfección (RET), del 1 de Julio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto de acuerdo con la Fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: X es N o CR5; Y es un enlace; […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]