Construcciones que contienen múltiples casetes de expresión para terapia de cáncer.
Una construcción de ácido nucleico, que comprende:
un primer marco abierto de lectura que codifica una toxina diftérica,
estando el primer marco abierto de lecturaunido operativamente a una secuencia reguladora de la transcripción específica de H19; y
un segundo marco abierto de lectura que codifica una toxina diftérica, estando el segundo marco abierto delectura unido operativamente a una secuencia reguladora de la transcripción de IGF-II seleccionada de lassecuencias P4 de IGF-II y P3 de IGF-II,
o que comprende:
un primer marco abierto de lectura que codifica una toxina diftérica, estando dicho primer marco abierto delectura unido operativamente a una secuencia reguladora de la transcripción P3 de IGF-II; y
un segundo marco abierto de lectura que codifica una toxina diftérica, estando dicho segundo marco abierto delectura unido operativamente a una secuencia reguladora de la transcripción P4 de IGF-II,
en la que:
la secuencia reguladora de la transcripción específica de H19 es un promotor cuya secuencia es SEC ID Nº: 1 oSEC ID Nº: 2; la secuencia reguladora de la transcripción P4 de IGF-II es una secuencia seleccionada de SECID Nº: 9 y SEC ID Nº: 13; y la secuencia P3 de IGF-II es SEC ID Nº: 17 o se selecciona de SEC ID Nº: 8 y SECID Nº: 12.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IL2008/001405.
Solicitante: YISSUM RESEARCH DEVELOPMENT COMPANY OF THE HEBREW UNIVERSITY OF JERUSALEM LTD.
Nacionalidad solicitante: Israel.
Dirección: HI-TECH PARK EDMOND J. SAFRA CAMPUS GIVAT RAM P.O.B 39135 91390 JERUSALEM ISRAEL.
Inventor/es: HOCHBERG,AVRAHAM, AMIT,DORON.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C12N15/11 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/85 C12N 15/00 […] › para células animales.
PDF original: ES-2394129_T3.pdf
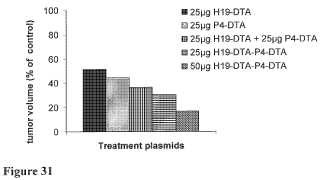
Fragmento de la descripción:
Construcciones que contienen múltiples casetes de expresión para terapia de cáncer
Campo de la invención La presente invención se refiere al campo del tratamiento de cáncer, específicamente a nuevas construcciones de ácido nucleico que son particularmente útiles para tratar tumores que expresan H19 y/o IGF-II.
Antecedentes de la invención La neoplasia es un proceso que se produce en cáncer, por el que los mecanismos de control normales que regulan el crecimiento y la diferenciación celulares se alteran, dando como resultado crecimiento progresivo. Esta alteración de los mecanismos de control permite que un tumor se amplíe y ocupe espacios en áreas vitales del cuerpo. Si el tumor invade el tejido circundante y se transporta a sitios distantes (metástasis) probablemente dé como resultado la muerte del individuo.
El objetivo deseado de la terapia de cáncer es eliminar preferentemente células cancerosas, sin tener un efecto deletéreo en células normales. Se han usado varios procedimientos en un intento de alcanzar este objetivo, incluyendo cirugía, radioterapia y quimioterapia.
Los tratamientos locales, tales como radioterapia y cirugía, ofrecen un medio para reducir la masa tumoral en regiones del cuerpo que sean accesibles a través de técnicas quirúrgicas o altas dosis de radioterapia. Sin embargo, se necesitan terapias locales más eficaces con menos efectos secundarios. Además, estos tratamientos no son aplicables a la destrucción de células tumorales ampliamente diseminadas o en circulación que se encuentran con el tiempo en la mayoría de los pacientes con cáncer. Para combatir la propagación de células tumorales, se usan terapias sistémicas.
Un tratamiento sistémico tal es la quimioterapia. La quimioterapia es el principal tratamiento para cánceres malignos diseminados. Sin embargo, los agentes quimioterapéuticos están limitados en su eficacia para tratar muchos tipos de cáncer, incluyendo muchos tumores sólidos habituales. Esta limitación se debe en parte a la resistencia a fármacos intrínseca o adquirida de muchas células tumorales. Otro inconveniente del uso de agentes quimioterapéuticos son sus graves efectos secundarios. Estos incluyen supresión de médula ósea, náuseas, vómitos, pérdida de cabello y úlceras en la boca. Claramente, se necesitan nuevos enfoques para potenciar la eficacia con la que un agente quimioterapéutico puede destruir células tumorales malignas, evitando a la vez la toxicidad sistémica.
H19 en diagnóstico y terapia El gen H19 es uno de varios genes que se sabe que están impresos en seres humanos (Hurst y col., 1996, Nature Genetics 12: 234 237) . Al comienzo de la embriogénesis, H19 se expresa a partir de ambos alelos cromosómicos (DeGroot y col., 1994, Trophoblast 8: 285 302) . Poco después, se produce el silenciamiento del alelo paterno, y solo se transcribe el alelo heredado materno.
H19 se expresa abundantemente durante la embriogénesis y se identificó en primer lugar como un gen que estaba regulado de forma coordinada con alfa-fetoproteína en el hígado por el locus de acción en trans raf (Pachnis y col., 1984, “Locus unlinked to alpha-fetoprotein under the control of the murine raf and Rif genes”, Proc Natl Acad Sci. 81: 5523 5527) . Adicionalmente, se ha clonado H19 de forma independiente por varios grupos usando exploraciones dirigidas a aislar genes expresados durante la diferenciación tisular. Por ejemplo, se identificó el homólogo de ratón de H19 en una exploración con respecto a genes que estaban activos durante la diferenciación temprana de células C3H10T1/2 (Davis y col., 1987, “Expression of a single transfected cDNA converts fibroblasts to myoblasts”, Cell
51:987 1000) . De forma similar, se mostró que H19 murino se expresaba durante la diferenciación de células madre y en el momento de la implantación (Poirier y col., 1991, “The murine H19 gene is activated during embr y onic stem cell differentiation in vitro and at the time of implantation in the developing embr y o”, Development 113: 1105 1114) . También se descubrió transcripción del gen H19 humano en la diferenciación de citotrofoblastos de placenta humana (Rachmilewitz y col., 1992, Molec. Reprod. Dev. 32: 196 202) .
Aunque se produce transcripción de ARN de H19 en muchos tejidos embrionarios diferentes durante la vida fetal y el desarrollo placentario, la expresión de H19 se regula negativamente después del nacimiento, aunque se han indicado niveles bajos de transcripción de H19, por ejemplo, en músculo e hígado adulto murino (Brunkow y Tilghman, 1991, “Ectopic expression of the H 19 gene in mice causes prenatal lethality”, Genes Dev. 5: 1092 1101) .
La transcripción de H19 puede reactivarse después del nacimiento en células cancerosas como se ha demostrado en tumores derivados de tejidos que expresan H19 antes del nacimiento (Ariel y col., 1997, “The product of the imprinted H19 gene is an oncofetal RNA”, Mol Pathol. 50: 34 44) . Adicionalmente, ARN H19 se expresa después del nacimiento en algunos tumores, en particular astrocitoma y ganglioneuroblastoma, que derivan de tejidos neurales que no se sabe que expresen H19 (Ariel y col. mencionado anteriormente) . Puesto que el ARN de H19 se expresa en muchos tipos de tumores y cánceres, Ariel y col. especularon que el ARN de H19 era un ARN oncofetal, y
propusieron investigar H19 como un marcador tumoral para neoplasia humana.
H19 se expresa de forma significativa en el 84 % de los carcinomas de vejiga humanos, reduciéndose la expresión con la diferenciación de pérdida tumoral. Independientemente del grado tumoral, el nivel de expresión de H19 se correlacionaba de forma significativa con reaparición de tumor temprana (Ayesh, B., y col, Mol Ther, 2003. 7 (4) : p. 535-41) .
La comparación de los patrones de expresión génica en dos poblaciones celulares homogéneas que difieren solamente en la presencia o ausencia de ARN de H19 ha identificado una multitud de efectores corriente abajo de ARN de H19. Entre estos están los grupos de genes que se ha indicado previamente que desempeñan papeles cruciales en algunos aspectos del proceso tumorogénico. La presencia de ARN de H19 puede potenciar la capacidad invasiva, migratoria y angiogénica de la célula regulando positivamente genes que actúen en esas rutas, y de este modo podría contribuir al menos a las etapas iniciales de la cascada metastásica. Estudios adicionales destacan el papel potencial de H19 en la promoción de la progresión de cáncer y metástasis tumoral siendo un gen sensible al factor de crecimiento/factor de dispersión de Hepatocitos (HGF/SF) .
La expresión específica del gen de H19 en células cancerosas ha impulsado su uso en aplicaciones clínicas para diagnosticar cáncer. Por ejemplo, la Patente de Estados Unidos Nº 5.955.273 enseña el uso del gen H19 como un marcador específico tumoral. El documento PCT Pub. Nº WO 2004/024957 desvela el uso de H19 para la detección, en un paciente sospechoso de tener cáncer, de la presencia de células cancerosas residuales o micrometástasis que se originan de tumores sólidos.
IGF-II
El factor de crecimiento de tipo insulina II (IGF-II) se expresa la mayoría de los carcinomas de vejiga tales como carcinomas de células transicionales (TCC; Ariel, I., y col., The imprinted H19 gene is a marker of early recurrence in human bladder carcinoma. Mol Pathol, 2000. 53 (6) : p. 320-3) . Las actividades biológicas están mediadas por la unión con los receptores de superficie celular, receptor de IGF-I (IGF-1R) , receptor de IGF-II (IGF-2R) y receptor de insulina (IR) . Los receptores de IGF están presentes en casi todos los tejidos de animales fetales y adultos. IGF-2R se une a IGF-II con la mayor afinidad, mientras que el IGF-1R e IR posen afinidad alta, pero menor por IGF-II que por sus ligandos respectivos. IGF-II es un potente factor de crecimiento embrionario y tumoral que señaliza mediante el IGF1R a través de las rutas de señalización proteína quinasa activada por mitógeno/Ras, fosfatidilinositol 3quinasa/Akt/FOXO, y diana de rapamicina de mamífero/S6K (mTOR) para modificar la proliferación celular, supervivencia celular, expresión génica y crecimiento celular.
IGF-II es otro gen impreso cuya expresión depende de su origen parental. Sin embargo a diferencia de H19, IGF-II está impreso por vía materna tanto en ratones como en seres humanos, y por lo tanto se expresa a partir del alelo heredado por vía paterna (Rainier y col., 1993, “Relaxation of imprinted genes in human cancer”, Nature 362: 747 749) . El gen IGF-II humano muestra un patrón transcripcional complejo. Hay cuatro promotores de IGF-II que se activan de una manera... [Seguir leyendo]
Reivindicaciones:
1. Una construcción de ácido nucleico, que comprende:
un primer marco abierto de lectura que codifica una toxina diftérica, estando el primer marco abierto de lectura unido operativamente a una secuencia reguladora de la transcripción específica de H19; y un segundo marco abierto de lectura que codifica una toxina diftérica, estando el segundo marco abierto de lectura unido operativamente a una secuencia reguladora de la transcripción de IGF-II seleccionada de las secuencias P4 de IGF-II y P3 de IGF-II,
o que comprende: un primer marco abierto de lectura que codifica una toxina diftérica, estando dicho primer marco abierto de lectura unido operativamente a una secuencia reguladora de la transcripción P3 de IGF-II; y un segundo marco abierto de lectura que codifica una toxina diftérica, estando dicho segundo marco abierto de lectura unido operativamente a una secuencia reguladora de la transcripción P4 de IGF-II, en la que: la secuencia reguladora de la transcripción específica de H19 es un promotor cuya secuencia es SEC ID Nº: 1 o SEC ID Nº: 2; la secuencia reguladora de la transcripción P4 de IGF-II es una secuencia seleccionada de SEC ID Nº: 9 y SEC ID Nº: 13; y la secuencia P3 de IGF-II es SEC ID Nº: 17 o se selecciona de SEC ID Nº: 8 y SEC ID Nº: 12;
2. La construcción de ácido nucleico de la reivindicación 1, en la que la toxina diftérica es toxina diftérica A (DTA) .
3. La construcción de ácido nucleico de la reivindicación 2, en la que la toxina diftérica comprende una secuencia como se expone en SEC ID Nº: 7.
4. La construcción de ácido nucleico de la reivindicación 1, en la que dicha construcción de ácido nucleico es un plásmido.
5. La construcción de ácido nucleico de la reivindicación 1, en la que el primer marco abierto de lectura está unido operativamente a una secuencia reguladora de la transcripción específica de H19 y el segundo marco abierto de lectura está unido operativamente a una secuencia reguladora de la transcripción P4 de IGF-II.
6. La construcción de ácido nucleico de la reivindicación 1, en la que el primer marco abierto de lectura está unido operativamente a una secuencia reguladora de la transcripción específica de H19 y el segundo marco abierto de lectura está unido operativamente a una secuencia reguladora de la transcripción P3 de IGF-II.
7. La construcción de ácido nucleico de la reivindicación 1, en la que dicho primer marco abierto de lectura está unido operativamente a una secuencia reguladora de la transcripción P3 de IGF-II y dicho segundo marco abierto de lectura está unido operativamente a una secuencia reguladora de la transcripción P4 de IGF-II.
8. Un vector de expresión eucariota que comprende la construcción de ácido nucleico de la reivindicación 1.
9. Una construcción de ácido nucleico de cualquiera de las reivindicaciones 1 o 4 para uso en el tratamiento de un tumor, o inhibición de la progresión tumoral o inhibición de la metástasis tumoral en un sujeto humano que lo necesite, en la que una célula de dicho tumor es capaz de expresar un transcrito dirigido por el promotor de H19, un transcrito dirigido por el promotor P3 de IGF-II o un transcrito dirigido por el promotor P4 de IGF-II.
10. La construcción de ácido nucleico para uso en el tratamiento de un tumor, o inhibición de la progresión tumoral o inhibición de metástasis tumoral de acuerdo con la reivindicación 9, en la que dicho tumor es un carcinoma.
11. La construcción de ácido nucleico para uso en el tratamiento de un tumor, o inhibición de la progresión tumoral o inhibición de metástasis tumoral de acuerdo con la reivindicación 10, en la que dicho tumor se selecciona del grupo que consiste en un carcinoma de vejiga, un carcinoma hepatocelular, un carcinoma de ovario y un carcinoma pancreático.
12. La construcción de ácido nucleico de la reivindicación 7, en la que dicha construcción de ácido nucleico comprende además un tercer marco abierto de lectura que codifica una toxina diftérica, estando dicho tercer marco abierto de lectura unido operativamente a una secuencia reguladora de la transcripción específica de H19.
13. Una construcción de ácido nucleico de acuerdo con la reivindicación 7 para uso en el tratamiento de un tumor, inhibición de la progresión tumoral o inhibición de la metástasis tumoral en un sujeto humano que lo necesite, en la que una célula de dicho tumor es capaz de expresar un transcrito dirigido por el promotor P3 de IGF-II o un transcrito dirigido por el promotor P4 de IGF-II.
14. La construcción de ácido nucleico para uso en el tratamiento de un tumor, inhibición de la progresión tumoral o inhibición de la metástasis tumoral de acuerdo con la reivindicación 13, en la que dicho tumor es un carcinoma.
15. La construcción de ácido nucleico para uso en el tratamiento de un tumor, inhibición de la progresión tumoral o inhibición de la metástasis tumoral de acuerdo con la reivindicación 14, en la que dicho tumor se selecciona del
grupo que consiste en un carcinoma de vejiga, un carcinoma hepatocelular, un carcinoma de ovario y un carcinoma pancreático.
Patentes similares o relacionadas:
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Compuestos tricíclicos como agentes antineoplásicos, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula **(Ver fórmula)** en la que: A es **(Ver fórmula)** X e Y se seleccionan independientemente entre hidrógeno, alquilo (C1-C6), […]