Procedimiento de uso en anticuerpos monoclonales que se adaptan al ser humano.
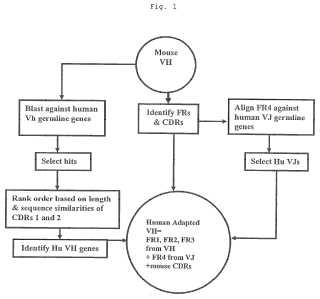
Un procedimiento para seleccionar secuencias de anticuerpo humano para su uso en la preparación de moléculasde anticuerpo adaptadas al ser humano que comprende las etapas de:
a. obtener una secuencia peptídica para una región variable de anticuerpo no humano;
b. delinear las regiones determinantes de complementariedad (CDR) y regiones marco (FR) de la secuenciapeptídica de región variable de anticuerpo no humano;
c. proporcionar una biblioteca de secuencias peptídicas de gen de anticuerpo de línea germinal humana quecomprende sub-bibliotecas de genes VH, VK, Vλ, JH, JK y Jλ;
d. seleccionar un subconjunto de secuencias peptídicas de la biblioteca de gen de línea germinal humana quetengan máximas similitudes de secuencia de CDR y FR con las cadenas pesada y ligera del anticuerpo nohumano;
e. seleccionar un subconjunto de las secuencias de cadena pesada de anticuerpo de línea germinal humanaseleccionadas en la etapa d basándose en:
e1. comparación de compatibilidades de longitud de los bucles de CDR1 y CDR2 con el anticuerpo nohumano; y
e2. similitudes de secuencia de los bucles de CDR1 y CDR2 con el anticuerpo no humano;
f. seleccionar un subconjunto de las secuencias de cadena ligera de anticuerpo de línea germinal humanaseleccionadas en la etapa d basándose en:
f1. comparación de compatibilidades de longitud de los bucles de CDR1, CDR2 y una parte de CDR3 con elanticuerpo no humano; y
f2. similitudes de secuencia de los bucles de CDR1, CDR2 y una parte de CDR3 con el anticuerpo nohumano;
g. seleccionar un subconjunto de secuencias peptídicas del gen J de cadena pesada de la sub-biblioteca delgen JH de línea germinal humana basándose en las similitudes de secuencia entre el marco 4 del anticuerpo nohumano y las regiones del gen JH;
h. seleccionar un subconjunto de secuencias peptídicas del gen J para la cadena ligera de las sub-bibliotecasdel gen JK y Jλ de línea germinal humana basándose en similitudes de secuencia entre el marco 4 delanticuerpo no humano y las regiones de gen JK y Jλ;
i. combinar una selección de FR 1, 2 y 3 de la etapa e y una selección de FR4 de la etapa g para cadenaspesadas humanas para seleccionar secuencias de cadena pesada de anticuerpo humano para su uso en lapreparación de anticuerpos adaptados al ser humano; y
j. combinar una selección de FR 1, 2 y 3 de la etapa f y una selección de FR4 de la etapa h para cadenasligeras humanas para seleccionar secuencias de cadena ligera de anticuerpo humano para su uso en lapreparación de anticuerpos adaptados al ser humano.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E08253381.
Solicitante: Janssen Biotech, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 800/850 RIDGEVIEW DRIVE HORSHAM, PA 19044 ESTADOS UNIDOS DE AMERICA.
Inventor/es: Raghunathan,Gopalan.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/10 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de virus ARN.
- C07K16/24 C07K 16/00 […] › contra citoquinas, linfoquinas o interferones.
- C07K16/46 C07K 16/00 […] › Inmoglobulinas híbridas (híbridos de una inmunoglobulina con un péptido distinto de una inmunoglobulina C07K 19/00).
PDF original: ES-2387585_T3.pdf
Fragmento de la descripción:
Procedimientos de uso en anticuerpos monoclonales que se adaptan al ser humano
Campo de la invención
La presente invención se refiere a procedimientos para seleccionar marcos de región variable humana para su uso en la adaptación al ser humano de anticuerpos monoclonales no humanos, tales como anticuerpos de roedores. Los marcos pueden ser de origen en línea germinal o somático.
Antecedentes de la invención
La adaptación al ser humano de anticuerpos es una expresión genérica que describe la modificación mediante ingeniería genética de anticuerpos monoclonales (mAb) xenogénicos frente a dianas terapéuticas humanas para sustituir al máximo las secuencias xenogénicas con secuencias de anticuerpo humano mientras que se conservan sus especificidades de unión a antígeno. El fin es reducir la inmunogenia de estos anticuerpos para mejorar sus propiedades terapéuticas. Los anticuerpos modificados mediante ingeniería genética generados también se conocen en la técnica como anticuerpos humanizados o con injerto de CDR.
Actualmente, la técnica usada más ampliamente para la adaptación al ser humano de anticuerpos se conoce como "injerto de CDR". La base científica de esta tecnología es que la especificidad de unión de un anticuerpo reside principalmente dentro de los tres bucles hipervariables conocidos como las regiones determinantes de complementariedad (CDR) de sus regiones variables (regiones V) de cadena ligera y pesada, mientras que las regiones marco más conservadas (marco, FW; región marco, FR) proporcionan función de soporte estructural. Injertando las CDR en un FW seleccionado apropiadamente se puede transferir algo o toda la actividad de unión a anticuerpo al anticuerpo recombinante resultante. La primera demostración de la transferencia de especificidad mediante injerto de CDR fue para el hapteno nitrofenol (Jones y col., Nature 321: 522-525 (1986) ) .
Ya que la metodología para definir las CDR se ha establecido bien, la clave para el injerto de CDR es la selección del aceptor de anticuerpo humano más apropiado para el injerto. Se han desarrollado diversas estrategias para seleccionar aceptores de anticuerpo humano con las mayores similitudes con las secuencias de aminoácidos de CDR donadoras o FW donador o con las estructuras donadoras. Todas estas estrategias de "mejor ajuste", aunque parecen muy racionales, de hecho están basadas en una suposición, es decir, un anticuerpo recombinante resultante que es lo más similar posible (en secuencia de aminoácidos o en estructura) al anticuerpo original conservará del mejor modo la actividad de unión a antígeno original. Aunque estas estrategias se han aplicado todas exitosamente para generar anticuerpos terapéuticos (por ejemplo, documento WO 2005/112564, Tempest y col., Biotechnology 9: 266-71 (1991) , Gorman y col., Proc. Natl. Acad. Sci. USA 88: 4181-4185 (1991) , Co y col., J. Immunol. 152: 2968-76 (1994) ) , la hipótesis subyacente nunca se ha ensayado seriamente.
Un problema potencial de las estrategias de mejor ajuste es que los criterios de los mejores ajustes son matemáticos, pero no necesariamente biológicos. La adecuación medida por el grado de homología, por ejemplo, es la suma de valores numéricos asignados a restos de aminoácidos o secuencias de ácido nucleico idénticas, homólogas y distintas. Aunque estos valores asignados se han validado en gran medida en muchos otros sistemas de evaluación de homología, las diferencias finas que pueden ser no significativas para otros sistemas podrían ser importantes para calcular los mejores ajustes en la adaptación al ser humano de anticuerpos.
Un problema relacionado es, dados dos aceptores con un grado idéntico o muy próximo de adecuación total del donador, que su adecuación local en diferentes FR puede ser diferente. Brevemente, un modelo matemático todavía no se ha validado para satisfacer el requisito de cálculo de los mejores ajustes en la relación de donador-aceptor en la modificación por ingeniería genética de anticuerpos.
Una complicación adicional se refiere a las interacciones entre las dos cadenas de un anticuerpo: un aceptor de cadena pesada de mejor ajuste y un aceptor de cadena ligera de mejor ajuste pueden no ajustarse entre sí para conservar del mejor modo la actividad de unión del donador. No existe ninguna herramienta disponible para evaluar la adecuación intercadena. Los investigadores han emparejado cadenas pesadas y ligeras de varios anticuerpos frente al mismo epítopo para intentar encontrar un mejor emparejamiento. Sin embargo, esto no se ha intentado en la adaptación al ser humano de anticuerpos.
En teoría, todas las secuencias de línea germinal humana se han secuenciado y están disponibles para la búsqueda de FW de anticuerpo. Sin embargo, en la práctica, la mayoría de las regiones V humanas que se han usado hasta ahora en la humanización de anticuerpos son de genes de anticuerpos maduros, con frecuencia los de proteínas de mieloma. Probablemente contienen mutaciones somáticas. Estas mutaciones son únicas para el individuo de los que se han obtenido los genes reordenados y, por tanto, serán vistos como extrañas por otros individuos. Las secuencias de bases de datos de línea germinal generalmente son más adecuadas para la humanización de anticuerpos desde esta perspectiva. Sin embargo, hay solamente unas pocas docenas de genes V y menos genes J disponibles. Por tanto, en algunos casos, puede ser difícil encontrar un marco de línea germinal que sea altamente compatible con la secuencia no humana. Por el contrario, el número de secuencias de genes de anticuerpos humanos maduros disponibles es unos pocos órdenes de magnitud mayor que las secuencias de línea germinal humana. Por tanto, es altamente probable que se pueda obtener una secuencia compatible en este mayor conjunto de datos.
Un problema del uso de genes de anticuerpos maduros para FW aceptor es que no están representadas todas las potenciales combinaciones de V-J para la cadena ligera o combinaciones de V-D-J para la cadena pesada en los genes maduros. Por tanto, pueden surgir situaciones en las que un gen V que coincide estrechamente esté ligado a un segmento J que coincide mal. La humanización del anticuerpo monoclonal de ratón anti-Tac descrita por Queen y col. (Proc. Natl. Acad. Sci. USA 86: 10029-10033 (1989) ) es un ejemplo. La comparación de la región VH de anti-Tac con la base de datos NBRF-PIR (http://www.psc.edu/general/software/packages/nbrf-pir/nbrf.html) indicó que la región VH de la proteína de mieloma humano Eu tenía el mayor grado de homología (57% de identidad frente a VDJH) . Sin embargo, el marco 4 de la región VH de Eu tiene varios aminoácidos, probablemente codificados por el segmento JH de Eu, que son atípicos de segmentos JH humanos. Esto dio como resultado una peor coincidencia entre el marco 4 de Eu y el de anti-Tac. La comparación separada de la región JH de anti-Tac (el marco 4 y el extremo proximal al marco 4 de CDR3) con las secuencias de aminoácidos de los segmentos JH humanos funcionales conocidos (de los que hay 6) indica que JH4 humano es una coincidencia mucho mejor que JH de Eu. Este ejemplo sugiere que las comparaciones separadas de los elementos V y J son más ventajosas que la comparación de todas las regiones variables entre secuencias de anticuerpo de roedor y de ser humano. Actualmente no está fácilmente disponible una herramienta para este tipo de comparación separada.
No todos los aminoácidos en las CDR están implicados en la unión a antígeno. Por tanto, se ha propuesto que el injerto de solamente los restos que sean críticos en la interacción antígeno-anticuerpo -el denominado injerto de restos determinantes de especificidad (injerto de SDR) -aumentará adicionalmente el contenido de secuencias de anticuerpos humanos en el anticuerpo recombinante resultante (Kashmiri y col., Methods 36: 25-34 (2005) ; Gonzales y col., Mol Immunol. 40: 337-49 (2004) ) . La aplicación de esta estrategia requiere información acerca de la estructura del anticuerpo así como de restos de contacto de anticuerpo-antígeno que con bastante frecuencia no están disponibles. Incluso cuando está disponible tal información, no existe ningún procedimiento sistemático para identificar de forma fiable las SDR y el injerto de SDR permanece hasta ahora en su mayor parte en el nivel de investigación básico.
Recientemente se ha desarrollado una estrategia novedosa denominada "barajado de marco humano" (Dall'Acqua y col., Methods 36: 43-60 (2005) ) . Esta técnica trabaja ligando fragmentos de ADN que codifican CDR con fragmentos... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para seleccionar secuencias de anticuerpo humano para su uso en la preparación de moléculas de anticuerpo adaptadas al ser humano que comprende las etapas de:
a. obtener una secuencia peptídica para una región variable de anticuerpo no humano;
b. delinear las regiones determinantes de complementariedad (CDR) y regiones marco (FR) de la secuencia peptídica de región variable de anticuerpo no humano;
c. proporcionar una biblioteca de secuencias peptídicas de gen de anticuerpo de línea germinal humana que comprende sub-bibliotecas de genes VH, VK, VA, JH, JK y JA;
d. seleccionar un subconjunto de secuencias peptídicas de la biblioteca de gen de línea germinal humana que tengan máximas similitudes de secuencia de CDR y FR con las cadenas pesada y ligera del anticuerpo no humano;
e. seleccionar un subconjunto de las secuencias de cadena pesada de anticuerpo de línea germinal humana seleccionadas en la etapa d basándose en:
e1. comparación de compatibilidades de longitud de los bucles de CDR1 y CDR2 con el anticuerpo no humano; y e2. similitudes de secuencia de los bucles de CDR1 y CDR2 con el anticuerpo no humano;
f. seleccionar un subconjunto de las secuencias de cadena ligera de anticuerpo de línea germinal humana seleccionadas en la etapa d basándose en:
f1. comparación de compatibilidades de longitud de los bucles de CDR1, CDR2 y una parte de CDR3 con el anticuerpo no humano; y f2. similitudes de secuencia de los bucles de CDR1, CDR2 y una parte de CDR3 con el anticuerpo no humano;
g. seleccionar un subconjunto de secuencias peptídicas del gen J de cadena pesada de la sub-biblioteca del gen JH de línea germinal humana basándose en las similitudes de secuencia entre el marco 4 del anticuerpo no humano y las regiones del gen JH;
h. seleccionar un subconjunto de secuencias peptídicas del gen J para la cadena ligera de las sub-bibliotecas del gen JK y JA de línea germinal humana basándose en similitudes de secuencia entre el marco 4 del anticuerpo no humano y las regiones de gen JK y JA;
i. combinar una selección de FR 1, 2 y 3 de la etapa e y una selección de FR4 de la etapa g para cadenas pesadas humanas para seleccionar secuencias de cadena pesada de anticuerpo humano para su uso en la preparación de anticuerpos adaptados al ser humano; y
j. combinar una selección de FR 1, 2 y 3 de la etapa f y una selección de FR4 de la etapa h para cadenas ligeras humanas para seleccionar secuencias de cadena ligera de anticuerpo humano para su uso en la preparación de anticuerpos adaptados al ser humano.
2. Un procedimiento para seleccionar secuencias de anticuerpos humanos que contienen mutaciones somáticas para su uso en la preparación de moléculas de anticuerpo adaptadas al ser humano que comprende las etapas de:
a. obtener una secuencia peptídica para una región variable de anticuerpo no humano;
b. delinear las regiones determinantes de complementariedad (CDR) y regiones marco (FR) de la secuencia peptídica de región variable de anticuerpo no humano;
c. proporcionar una biblioteca de secuencias peptídicas de gen de anticuerpo somático humano;
d. seleccionar un subconjunto de secuencias peptídicas de la biblioteca de gen somático humano que tengan las máximas similitudes de secuencia de CDR y FR con las cadenas pesada y ligera del anticuerpo no humano;
e. seleccionar un subconjunto de las secuencias de cadena pesada de anticuerpo somático humano seleccionadas en la etapa d para su uso en la preparación de anticuerpos adaptados al ser humano basándose en:
e1. comparación de compatibilidades de longitud de bucles de CDR1, CDR2 y CDR3 con el anticuerpo no humano; y e2. similitudes de secuencia de bucles de CDR1, CDR2 y CDR3 con el anticuerpo no humano; y
f. seleccionar un subconjunto de las secuencias de cadena ligera de anticuerpo somático humano seleccionadas en la etapa d para su uso en la preparación de anticuerpos adaptados al ser humano basándose en:
f1. comparación de compatibilidades de longitud de bucles de CDR1, CDR2 y CDR3 con el anticuerpo no humano; y f2. similitudes de secuencia de bucles de CDR1, CDR2 y CDR3 con el anticuerpo no humano.
3. El procedimiento de la reivindicación 1 o 2 que comprende además la etapa de construcción de una nueva molécula adaptada al ser humano que incluye cada una de las regiones CDR de la región variable y regiones marco
no humanas de al menos un miembro de los marcos representativos de cadena pesada y ligera humanos seleccionados, en el que la nueva molécula es un anticuerpo o fragmento de anticuerpo adaptado al ser humano que se une al mismo antígeno que el unido por el anticuerpo no humano.
4. El procedimiento de la reivindicación 3, en el que el anticuerpo adaptado al ser humano es un anticuerpo monoclonal de longitud completa.
5. El procedimiento de la reivindicación 4, en el que el anticuerpo monoclonal de longitud completa es del tipo IgG1, IgG2, IgG3, IgG4, IgM, IgD, IgE o IgA.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
Uso de reslizumab para tratar el asma eosinofílica moderada a grave, del 24 de Junio de 2020, de CEPHALON, INC.: Reslizumab para su uso en el tratamiento del asma eosinofílica, en donde: se proporcionan 3 mg/kg de reslizumab por vía intravenosa una […]
Anticuerpos anti-IL-23 humanos, composiciones, procedimientos y usos, del 17 de Junio de 2020, de Janssen Biotech, Inc: un anticuerpo para IL-23p19 aislado, en donde dicho anticuerpo se genera completamente humano a partir de expresión de fagos y se une a […]
Aislamiento y purificación de anticuerpos anti-IL-13 usando cromatografía de afinidad a Proteína A, del 27 de Mayo de 2020, de AbbVie Inc: Un método para producir una preparación de anticuerpo anti-IL-13 reducido en proteínas de célula hospedadora (reducido en HCP) a partir de una mezcla […]
Anticuerpos ANTI-IL-33 y usos de los mismos, del 29 de Abril de 2020, de REGENERON PHARMACEUTICALS, INC.: Un anticuerpo monoclonal humano o fragmento de unión al antígeno del mismo para usar en un método de tratamiento del asma crónica en un paciente que lo necesita, […]