Proteínas de unión específicas para factores de crecimiento de tipo insulina y usos de las mismas.
Proteína de unión específica aislada completamente humana que se une preferentemente al factor decrecimiento de tipo insulina-II (IGF-II) con reactividad cruzada por el factor de crecimiento de tipo insulina I(IGF-I) y neutraliza la actividad de IGF-I y IGF-II,
comprendiendo dicha proteína de unión, o fragmento deunión de la misma:
una región determinante de complementariedad de cadena pesada 1 (CDR1) que tiene la secuencia deaminoácidos de "Ser Tyr Asp Ile Asn" (SEQ ID NO: 33);
una región determinante de complementariedad de cadena pesada 2 (CDR2) que tiene la secuencia deaminoácidos de "Trp Met Asn Pro Asn Ser Gly Asn Thr Gly Tyr Ala Gln Lys Phe Gln Gly" (SEQ ID NO: 34);una región determinante de complementariedad de cadena pesada 3 (CDR3) que tiene la secuencia deaminoácidos de "Asp Pro Tyr Tyr Tyr Tyr Tyr Gly Met Asp Val" (SEQ ID NO: 35);
una región determinante de complementariedad de cadena ligera 1 (CDR1) que tiene la secuencia deaminoácidos de "Ser Gly Ser Ser Ser Asn Ile Glu Asn Asn His Val Ser" (SEQ ID NO: 36);
una región determinante de complementariedad de cadena ligera 2 (CDR2) que tiene la secuencia deaminoácidos de "Asp Asn Asn Lys Arg Pro Ser" (SEQ ID NO: 37); y
una región determinante de complementariedad de cadena ligera 3 (CDR3) que tiene la secuencia deaminoácidos de "Glu Thr Trp Asp Thr Ser Leu Ser Ala Gly Arg Val" (SEQ ID NO: 38).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/047059.
Solicitante: MEDIMMUNE LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: Milstein Building Granta Park Cambridge CB21 6GH REINO UNIDO.
Inventor/es: TONGE,DAVID,WILLIAM, RAEBER,Olivia, GAZIT-BORNSTEIN,Gadi, YANG,Xiaodong, CARTLIDGE,Susan Ann.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
PDF original: ES-2385054_T3.pdf
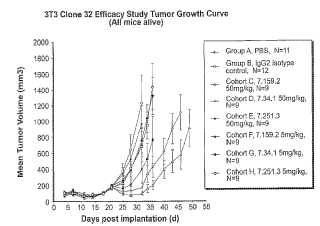
Fragmento de la descripción:
Proteínas de unión específicas para factores de crecimiento de tipo insulina y usos de las mismas.
Referencia cruzada a solicitudes relacionadas
Esta aplicación reivindica prioridad conforme a la ley 35 U.S.C. §119 con respecto a la solicitud provisional estadounidense con número de serie 60/750.085, presentada el 13 de diciembre de 2005; la solicitud provisional estadounidense con número de serie 60/750.772, presentada el 14 de diciembre de 2005; la solicitud provisional estadounidense con número de serie 60/774.747, presentada el 17 de febrero de 2005; y la solicitud provisional estadounidense con número de serie 60/808.183, presentada el 24 de mayo de 2006.
Antecedentes de la invención
Campo de la invención La invención se refiere a proteínas de unión que se unen al factor de crecimiento de tipo insulina-2 (IGF-II) con reactividad cruzada por el factor de crecimiento de tipo insulina-1 (IGF-I) y a usos de tales proteínas de unión. Más específicamente, la invención se refiere a anticuerpos monoclonales dirigidos a IGF-II con reactividad cruzada por IGF-I y a usos de estos anticuerpos. Los aspectos de la invención también se refieren a hibridomas u otras líneas celulares que expresan tales anticuerpos.
Descripción de la técnica relacionada El factor de crecimiento de tipo insulina IGF-I e IGF-II son polipéptidos pequeños implicados en la regulación de la proliferación, supervivencia, diferenciación y transformación celulares. Los IGF ejercen sus diversas acciones interaccionando principalmente con una receptor de superficie celular específico, el receptor de IGF-I (IGF-IR) y activando diversas cascadas de señalización intracelulares. Los IGF circulan en el suero principalmente unidos a proteínas de unión a IGF (IGFBP-1 a 6) . La interacción de IGF con el IGF-IR se regula mediante las IGFBP, y los IGF sólo pueden unirse al IGF-IR una vez liberados de las IGFBP (principalmente mediante proteólisis de las IGFBP) . IGF-I también puede unirse a un receptor híbrido compuesto por subunidades de IGF-IR y receptor de insulina (IR) . También se ha mostrado que IGF-II se une a la isoforma “A” del receptor de insulina.
La transformación maligna implica el desequilibrio de diversos procesos tales como crecimiento, diferenciación, apoptosis y transformación celulares. Se ha implicado a IGF-I e IGF-II en la fisiopatología de una amplia gama de estados, y se piensa que desempeñan un papel en la tumorigénesis debido a las propiedades mitogénicas y antiapoptóticas mediada por el receptor IGF-IR: LeRoith y Roberts, Cancer Lett. 195:127-137 (2003) .
Se descubrió IGF-I como un factor de crecimiento producido por el hígado bajo el control regulatorio de la hormona de crecimiento de la hipófisis y se denominó originalmente somatomedina (C. Salmon et al., J. Lab. Clin. Med. 49:825-826 (1957) . Tanto IGFI como IGF-II se expresan de manera ubicua y actúan como factores de crecimiento endocrinos, paracrinos y autocrinos, a través de su interacción con el IGF-IR, una tirosina cinasa transmembrana que está estructural y funcionalmente relacionada con el receptor de insulina (IR) . IGF-I funciona principalmente activando el IGF-IR, mientras que IGF-II puede actuar a través de o bien el IGF-IR o bien a través de la isoforma IR-
A. LeRoith y Roberts, Cancer Lett. 195:127-137 (2003) . Adicionalmente, la interacción de tanto IGF-I como IGF-II con las proteínas de unión a IGF puede afectar a la semivida y disponibilidad de los IGF, así como a su interacción directa con receptores en algunos casos. Rajaram et al., Endocr. Rev. 18:801-831 (1997) .
IGF-I tiene un impacto a largo plazo sobre la proliferación, diferenciación y apoptosis celulares. Experimentos en células de cáncer de mama y osteosarcoma cultivadas sugirieron que IGF-I es un potente mitógeno y ejerce su acción mitogénica aumentando la síntesis de ADN y estimulando la expresión de ciclina D1, que acelera la progresión del ciclo celular desde la fase G1 hasta la S. Furlanetto et al., Mol. Endocrinol. 8:510-517 (1994) ; Dufourny et al., J. Biol. Chem. 272:311663-31171 (1997) . Suppression of cyclin D1 expression in pancreatic cancer cells abolished the mitogenic effect of IGF-I. Kornmann et al., J. Clin. Invest. 101:344-352 (1998) . Además de estimular la progresión del ciclo celular, IGF-I también inhibe la apoptosis. Se mostró que IGF-I estimulaba la expresión de proteína Bcl y suprimía la expresión de Bax, lo que da como resultado un aumento en la cantidad relativa del heterodímero Bcl/Bax, bloqueando de ese modo la iniciación de la ruta apoptótica. Minshall et al., J. Immunol. 159:1225-1232 (1997) ; Parrizas et al., Endocrinology 138:1355-1358 (1997) ; Wang et al., Endocrinology 139:1354-1360 (1998) .
Como IGF-I, IGF-II tiene también acciones mitogénicas y antiapoptóticas y regula la proliferación y diferenciación celulares. En comparación con IGF-I, circulan altas concentraciones de IGF-II en el suero. Se han encontrado concentraciones de IGF-II séricas altas en pacientes con cáncer colorrectal, con una tendencia hacia concentraciones superiores en enfermedad avanzada. Renehan et al., Br. J. Cancer 83:1344-1350. Adicionalmente, la mayoría de tumores primarios y líneas celulares transformadas sobreexpresan ARNm y proteína de IGF-II. Werner y LeRoith Adv. Cancer Res. 68:183-223 (1996) . La sobreexpresión de IGF-II en cáncer de colon está asociada con un fenotipo agresivo, y la pérdida de la huella (pérdida de expresión específica de alelo) del gen de IGF-II puede ser importante en carcinogénesis colorrectal. Michell et al., Br. J. Cancer 76:60-66 (1997) ; Takano et al., Oncology 59:210-216 (2000) . Células cancerosas con una fuerte tendencia a metastatizar tienen niveles cuatro veces superiores de expresión de IGF-II que las células con una baja capacidad para metastatizar. Guerra et al., Int. J. Cancer 65:812-820 (1996) .
Estudios clínicos y de investigación han destacado el papel de los miembros de la familia de IGF en el desarrollo, el mantenimiento y la progresión del cáncer. Se ha mostrado que muchas células cancerosas sobreexpresan el IGF-IR y/o los ligandos IGF. Por ejemplo, IGF-I y IGF-II son mitógenos fuertes para una amplia variedad de líneas de células cancerosas, incluyendo sarcoma, leucemia y cánceres de la próstata, mama, pulmón, colon, estómago, esófago, hígado, páncreas, riñón, tiroides, cerebro, ovario y útero. Macaulay et al., Br. J. Cancer 65:311-320 (1992) ; Oku et al., Anticancer Res. 11:1591-1595 (1991) ; LeRoith et al., Ann. Intern. Med. 122:54-59 (1995) ; Yaginuma et al., Oncology 54:502-507 (1997) ; Singh et al., Endocrinology 137:1764-1774 (1996) ; Frostad et al., Eur. J. Haematol 62:191-198 (1999) . Cuando se administró IGF-I a células de cáncer de colon malignas, se hicieron resistentes a la apoptosis inducida por citocinas. Remacle-Bonnet et al., Cancer Res. 60:2007-2017 (2000) .
El papel de los IGF en el cáncer está apoyado por estudios epidemiológicos, que mostraron que altos niveles de IGF-I circulante y bajos niveles de IGFBP-3 están asociados con un aumento del riesgo de desarrollar varios cánceres comunes (próstata, mama, colorrectal y pulmón) . Mantzoros et al., Br. J. Cancer 76:1115-1118 (1997) ; Hankinson et al., Lancet 351:1393-1396 (1998) ; Ma et al., J. Natl. Cancer Inst. 91:620-625 (1999) ; Karasik et al., J. Clin. Endocrinol Metab. 78: 271-276 (1994) . Estos resultados sugieren que IGF-I y IGF-II actúan como señales antiapoptóticas y mitogénicas potentes, y que su sobreexpresión se correlaciona con mal pronóstico en pacientes con varios tipos de cáncer.
Usando modelos de ratones deficientes, varios estudios han establecido además el papel de los IGF en el crecimiento tumoral. Con el desarrollo de la tecnología para deleción génica condicional, específica de tejido, se desarrolló un modelo de ratón de deficiencia en IGF-I hepática (LID) . La deleción específica del hígado del gen igf1 suprimió la expresión de ARNm de IGF y provocó una reducción drástica en los niveles de IGF-I circulante. Yakar et al., Proc. Natl. Acad. Sci. USA 96:7324-7329 (1999) . Cuando se indujeron tumores mamarios en el ratón LID, la reducción de los niveles de IGF-1 circulante dio como resultado reducciones significativas en el desarrollo, el crecimiento y las metástasis del cáncer, mientras que el aumento de los niveles de IGF-1 circulante estaba asociado con crecimiento tumoral potenciado. Wu et al., Cancer Res. 63:4384-4388 (2003) .
Varios artículos han notificado que la inhibición de la expresión y/o señalización de IGF-IR conduce a una inhibición... [Seguir leyendo]
Reivindicaciones:
1. Proteína de unión específica aislada completamente humana que se une preferentemente al factor de crecimiento de tipo insulina-II (IGF-II) con reactividad cruzada por el factor de crecimiento de tipo insulina I (IGF-I) y neutraliza la actividad de IGF-I y IGF-II, comprendiendo dicha proteína de unión, o fragmento de unión de la misma:
una región determinante de complementariedad de cadena pesada 1 (CDR1) que tiene la secuencia de aminoácidos de “Ser Tyr Asp Ile Asn” (SEQ ID NO: 33) ;
una región determinante de complementariedad de cadena pesada 2 (CDR2) que tiene la secuencia de aminoácidos de “Trp Met Asn Pro Asn Ser Gly Asn Thr Gly Tyr Ala Gln Lys Phe Gln Gly” (SEQ ID NO: 34) ;
una región determinante de complementariedad de cadena pesada 3 (CDR3) que tiene la secuencia de aminoácidos de “Asp Pro Tyr Tyr Tyr Tyr Tyr Gly Met Asp Val” (SEQ ID NO: 35) ;
una región determinante de complementariedad de cadena ligera 1 (CDR1) que tiene la secuencia de aminoácidos de “Ser Gly Ser Ser Ser Asn Ile Glu Asn Asn His Val Ser” (SEQ ID NO: 36) ;
una región determinante de complementariedad de cadena ligera 2 (CDR2) que tiene la secuencia de aminoácidos de “Asp Asn Asn Lys Arg Pro Ser” (SEQ ID NO: 37) ; y una región determinante de complementariedad de cadena ligera 3 (CDR3) que tiene la secuencia de aminoácidos de “Glu Thr Trp Asp Thr Ser Leu Ser Ala Gly Arg Val” (SEQ ID NO: 38) .
2. Proteína de unión específica según la reivindicación 1, siendo dicha proteína de unión el anticuerpo monoclonal 7.159.2 (número de registro de la ATCC PTA-7424) .
3. Proteína de unión específica según la reivindicación 1, comprendiendo dicha proteína de unión un polipéptido de cadena pesada que tiene la secuencia de SEQ ID NO.: 6;
o comprendiendo dicha proteína de unión un polipéptido de cadena ligera que tiene la secuencia de SEQ ID NO.: 8.
4. Proteína de unión específica según cualquiera de las reivindicaciones 1 ó 3, comprendiendo dicha proteína de unión un polipéptido de cadena pesada que tiene la secuencia de SEQ ID NO.: 6;
y comprendiendo dicha proteína de unión un polipéptido de cadena ligera que tiene la secuencia de SEQ ID NO.: 8.
5. Proteína de unión específica según una cualquiera de las reivindicaciones anteriores, siendo dicha proteína de unión un anticuerpo monoclonal completamente humano; o
un fragmento de unión de un anticuerpo monoclonal completamente humano.
6. Proteína de unión específica según la reivindicación 5, en la que dicho fragmento de unión se selecciona del grupo que consiste en Fab, Fab’ o F (ab’) 2 y Fv.
7. Proteína de unión específica según cualquiera de las reivindicaciones 1 a 6, en una mezcla con un portador farmacéuticamente aceptable.
8. Molécula de ácido nucleico que codifica proteína de unión específica según una cualquiera de las reivindicaciones 1 a 6.
9. Vector que comprende la molécula de ácido nucleico según la reivindicación 8.
10. Célula huésped que comprende el vector según la reivindicación 9.
11. Proteína de unión específica según una cualquiera de las reivindicaciones 1 a 6, no uniéndose específicamente dicha proteína de unión específica a proteínas IGF-II o IGF-I cuando dichas proteínas están unidas a proteínas de unión a factor de crecimiento de insulina.
12. Método de determinación del nivel de factor de crecimiento de tipo insulina-II (IGF-II) y factor de crecimiento de tipo insulina I (IGF-I) en una muestra de un paciente que comprende:
poner en contacto una muestra de un paciente con la proteína de unión específica según una cualquiera de las reivindicaciones 1 a 6; y determinar el nivel de IGF-I y IGF-II en dicha muestra.
13. Uso de la proteína de unión específica según una cualquiera de las reivindicaciones 1 a 6 en la preparación de un medicamento para el tratamiento de un tumor maligno.
14. Uso según la reivindicación 13, en el que dicho tumor maligno se selecciona del grupo que consiste en: melanoma, cáncer de pulmón de células no pequeñas, glioma, carcinoma hepatocelular (hígado) , tumor de tiroides, cáncer gástrico (estómago) , cáncer de próstata, cáncer de mama, cáncer de ovarios, cáncer de vejiga, cáncer de pulmón, glioblastoma, cáncer endometrial, cáncer de riñón, cáncer de colon, cáncer pancreático y carcinoma epidermoide.
15. Uso según la reivindicación 13 ó 14, en el que dicho medicamento es para su uso en combinación con un segundo agente antineoplásico seleccionado del grupo que consiste en un anticuerpo, un agente quimioterápico y un fármaco radiactivo.
16. Uso según la reivindicación 13 ó 14, en el que dicho medicamento es para su uso conjuntamente con o tras una cirugía convencional, un trasplante de células madre de la médula ósea o un trasplante de células madre periféricas.
17. Conjugado que comprende el anticuerpo según la reivindicación 5 o un fragmento de unión del mismo y un agente terapéutico.
18. Conjugado según la reivindicación 17, en el que el agente terapéutico es una toxina;
un radioisótopo; o una composición farmacéutica.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Combinación de anticuerpo anti-CD20 e inhibidor selectivo de PI3 quinasa, del 15 de Julio de 2020, de TG Therapeutics Inc: Un metodo in vitro para inhibir la proliferacion de una poblacion celular que comprende poner en contacto la poblacion con una combinacion que comprende […]