NUEVOS HIDROXAMATOS COMO INHIBIDORES DE METALOPROTEASA DE LA MATRIZ TIPO 2 (MMP2).
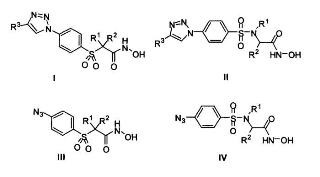
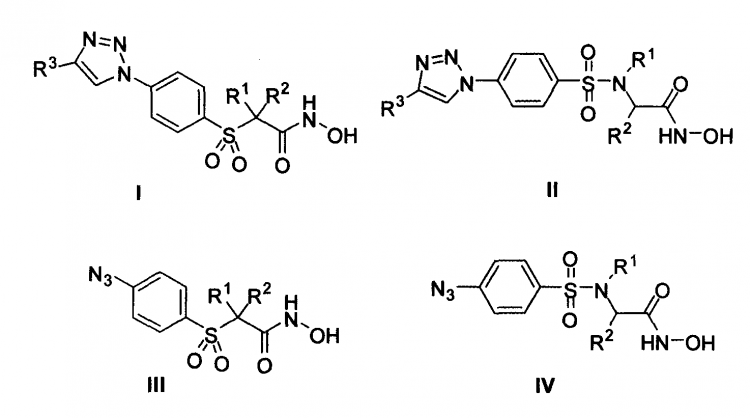
Nuevos hidroxamatos de fórmula general I, II, III y IV, donde R1,
R2, y R{sup,3 pueden ser diferentes tipos de átomos, cadenas y grupos de química orgánica, caracterizados por su alta capacidad inhibitoria de la actividad de metaloproteasa de la matriz tipo 2 (MMP2), en particular AP206 (formula II con R1 = H, R2 = C6H5CH2 y R3 = 4-C6H5C6H4) y AP210 (formula II con R1 = H, R2 = C6H5CH2 y R3 = 4-C6H5OC6H4), con respectivos valores de CI50 de 0,28 pM y 0,52 pM, y una selectividad de 1574 y 259 veces mayor frente a MMP9. Estos hidroxamatos han sido desarrollados siguiendo un diseño de la química "clic" de conexión de fragmentos, en base a técnicas computacionales de acoplamiento y modelado molecular, con resultados del modo de unión justificados por ensayos de zimografía, lo que les convierte en principios activos idóneos de medicamentos para el tratamiento de enfermedades cancerosas.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201200069.
Solicitante: FUNDACION UNIVERSITARIA SAN PABLO CEU 80%.
Nacionalidad solicitante: España.
Inventor/es: MARTINEZ, ALFREDO, MARTIN SANTAMARIA,SONSOLES, RAMOS,ANA, DE PASCUAL,TERESA BEATRIZ, ZAPICO RODRÍGUEZ,JOSÉ MARÍA, FABRE,BENJAMÍN, PUCKOWSKA,ANNA, SERRA CÁRDENAS,PILAR, BRUCZKO,MARTA, FILIPIAK,KAMILA, GARCÍA-SANMARTÍN,JOSUNE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4192 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › 1,2,3-Triazoles.
- A61K31/63 A61K 31/00 […] › Compuestos que contienen grupos para N-benceno-sulfonil-N, p. ej. sulfanilamida, p-nitrobencenosulfonhidrazida.
- A61K31/635 A61K 31/00 […] › que contienen un heterociclo, p. ej. sulfadiazina.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- A61P35/04 A61P […] › A61P 35/00 Agentes antineoplásicos. › específicos para la metástasis.
- C07C311/44 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 311/00 Amidas de ácidos sulfónicos, es decir, compuestos en los que átomos de oxígeno, unidos por enlaces sencillos, de grupos sulfónicos han sido sustituidos por átomos de nitrógeno que no forman parte de grupos nitro o nitroso. › que tienen el átomo de nitrógeno de al menos uno de los grupos sulfonamida unido a un átomo de carbono de un ciclo aromático de seis miembros.
- C07C317/38 C07C […] › C07C 317/00 Sulfonas; Sulfóxidos. › en que el átomo de nitrógeno de al menos uno de los grupos amino forma parte de uno de los grupos en que X es un heteroátomo e Y un átomo cualquiera, p. ej. N-acilaminosulfonas.
- C07D249/06 C07 […] › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 249/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen tres átomos de nitrógeno como únicos heteroátomos del ciclo. › con radicales arilos unidos directamente a los átomos del ciclo.
Fragmento de la descripción:
Nuevos hidroxamatos como inhibidores de metaloproteasa de la matriz tipo 2 (MMP2).
La presente invención se refiere a nuevos hidroxamatos de fórmula general I, II, III y IV, donde R1, R2, y R3 pueden ser diferentes tipos de átomos, cadenas y grupos habitualmente utilizados en química orgánica como más adelante se especifica, caracterizados por su alta capacidad inhibitoria de la actividad de metaloproteasa de la matriz tipo 2 (MMP2), matrixina que juega un papel importante en el cáncer por su capacidad degradante de la membrana extracelular, por lo que también es objeto de invención la utilización de los hidroxomatos más activos en la terapia anticancerosa.
Estos nuevos hidroxamatos han sido desarrollados siguiendo un diseño basado en fragmentos, ya utilizado anteriormente por el equipo inventor en el desarrollo de otros derivados que resultaron menos eficaces para el fin perseguido. Para ello se parte de un fragmento que contiene simultáneamente un grupo hidroxamato para coordinarse con el Zinc catalítico de la enzima conocido (Zinc Binding Group, ZBG) y un grupo azida. Esta subunidad se conecta mediante química "clic" con otros fragmentos lipófilos que contienen un alquino terminal y que han sido seleccionados para interaccionar de manera selectiva con el subsitio S1' de la MMP-2, en base a técnicas computacionales de acoplamiento molecular o docking y modelado molecular.
Los resultados de los estudios teóricos del modo de unión para los compuestos sintetizados han quedado justificados por los resultados biológicos obtenidos por ensayos de zimografía, con valores de CI50 del orden picomolar para la mayoría de ellos, alcanzando los 0,28 pM y 0,52 pM para los hidroxamatos más potentes, AP206 y AP210, con una selectividad frente a MMP2 de 1574 y 259 veces superior que frente a MMP9 respectivamente, lo que les convierte en compuestos idóneos en la preparación de medicamentos para el tratamiento de enfermedades en las que los cambios patológicos están mediados por MMP2, como la angiogénesis, apoptosis, metástasis y otros procesos relacionadas con el cáncer.
La invención se encuadra por tanto, en el campo de la preparación de composiciones farmacéuticas o preparaciones medicinales que contienen ingredientes orgánicos activos.
Estado de la técnica
Las Metaloproteasas de la Matriz (MMPs), también conocidas como matrixinas, son una familia de enzimas estructuralmente relacionadas que poseen zinc en su centro catalítico. Las MMPs son responsables del remodelado y la degradación de la matriz extracelular, por lo que están implicadas en una gran variedad de procesos biológicos, tales como el desarrollo embrionario, enfermedades neurológicas (European Journal of Neurology 2010, 17, 226-231; Journal of Neurochemistry 2010, 112, 134-149), artritis (Biochemical and Biophysical Research Communications 2008, 376, 352-357), enfermedades cardiovasculares (Biochemical and Biophysical Research Communications 2009, 387, 646-650; Atherosclerosis 2010, 208) y varios procesos relacionados con el cáncer, como la angiogénesis, apoptosis, proliferación celular y metástasis (Cancer Research 2008, 68, 4736-4745; British Journal of Cancer 2006, 94, 941-946; Biochemical and Biophysical Research Communications 2009, 3<79, 445-450).
En la actualidad se conocen en vertebrados al menos veintiséis MMPs (Nature Reviews Cancer 2006, 6, 227-239), veintitrés de las cuales han sido detectadas en humanos (Journal of Computational Chemistry 2009, 31, 24-42). Están clasificadas en seis grupos: colagenasas: MMP1, MMP8, MMP13 y MMP18; gelatinasas: MMP2 y MMP9; estromelisinas: MMP3, MMP10 y MMP11; matrilisinas: MMP7 y MMP26; MMPs de la membrana: MMP14 a MMP17, MMP24 y MMP25; y otras MMPs.
Se han descrito un gran número de compuestos que actúan como inhibidores de MMPs y que han permitido deducir cuáles son las características estructurales necesarias para presentar actividad y que se pueden resumir en:
Los hidroxamatos han sido los ZBGs más usados en el desarrollo de inhibidores de MMPs. Se coordinan al zinc formando un quelato a través de dos enlaces. Sin embargo, presentan serios problemas de selectividad, ya que son capaces de interaccionar con multitud de metaloenzimas.
La capacidad de unión de estos inhibidores no se debe únicamente a esta coordinación con el Zn2+ catalítico, sino que la afinidad y, sobre todo, la selectividad entre las diferentes MMPs, se debe fundamentalmente a la interacción de otros grupos de la molécula con diferentes subsitios de la enzima. Especialmente interesante es la región conocida como sitio S1', por ser una de las que más diferencias presenta entre todas las MMPs (Journal of Biomolecular Structure & Dynamics 2000, 17, 933-946; Cellular and Molecular Life Sciences: CMLS 1999, 55, 639-652).
Modificaciones realizadas sobre la parte del inhibidor que interacciona con este subsitio (P1') han llevado a un aumento (Journal of Medicinal Chemistry, 2000, 43, 4948-4963; Journal of Medicinal Chemistry 2000, 43, 1858-1865; Organic & Biomolecular Chemistry 2011, 9, 4587-4599) o disminución de la selectividad (Journal of Medicinal Chemistry 1999, 42, 4547-4562; Journal of Medicinal Chemistry 1998, 41, 3568-3571).
Por el momento, únicamente las MMPs 1, 2 y 7 han sido validadas experimentalmente como dianas contra el cáncer (Cell 2010, 141, 52-67). De ellas, la MMP2 se está erigiendo en los últimos años en la más interesante para el diseño de agentes antitumorales. La MMP1 parece ser causante del síndrome musculoesquelético observado clínicamente con inhibidores poco selectivos de MMPs (Bioorganic & Medicinal Chemistry 2006, 14, 4260-4276). Por otro lado, la inhibición de otras MMPs como la 3, 8 y 9 puede incrementar la tumorigénesis y metástasis (Cancer and Metastasis Reviews 2007, 26, 717-724; Molecular Cancer Therapeutics 2008, 7, 2758-2767). La MMP9 es una enzima muy particular, ya que su inhibición puede ser útil en el tratamiento de pacientes con cáncer en una etapa inicial, sin embargo ha de ser evitada en pacientes en etapas avanzadas de la enfermedad.
El papel de la MMP2 en cáncer está relacionado con la estimulación del crecimiento tumoral, angiogénesis y metástasis, a través de su implicación en la degradación de la matriz extracelular (International Journal of Cancer 2009, 124, 1773-1777). Además, se ha visto que en muestras de tumor humano está sobreexpresada y se ha identificado en asociación con células altamente invasivas. Por estas razones la MMP2 se ha considerado como una importante diana contra el cáncer, y el diseño de inhibidores selectivos de esta enzima puede conducir a interesantes agentes anticancerosos (Experimental Cell Research 2010, 316, 836-847).
En esta línea de investigación, el trabajo que ha dado lugar a la presente invención se ha centrado en el diseño de nuevos y más potentes inhibidores selectivos de MMP2, para poder ser utilizados como principios activos en la preparación de composiciones farmacéuticas eficaces en la terapia anticancerosa.
Considerando que algunas series de α-sulfona, como α-piperidina y α-tetrahidropiran-hidroxamatos, se han descrito como destacados inhibidores de MMP2 (Journal of Medicinal Chemistry 2010, 53, 6653-6680, y 2005, 48, 6713-6730; Bioorganic Medicinal Chemistry, 2010, 20, 3357-3560 y 3561-3564), el equipo investigador del Departamento de...
Reivindicaciones:
1. Nuevos hidroxamatos de fórmulas generales I, II, III y IV,

donde R1, R2, y R3 pueden ser diferentes tipos de átomos, cadenas y grupos habitualmente utilizados en química orgánica, como alquilos, arilos, o grupos funcionales como halógenos, éteres, tioéteres y aminas con o sin sustituyentes, debiendo destacar que en el caso de que existan centros quirales o cualquier otro tipo de isomería espacial, se contemplan todos los estereoisómeros.
2. Hidroxamatos de fórmula general I, según reivindicación 1, siendo R1 = R2 = (CH2CH2)2O, y R3 = 4-(CH3)2NC6H4 ó 4-C6H5-C6H4 ó 3-FC6H4 ó 4-C6H5OC6H4 ó 4-CH3O-C6H4 ó 4-CH3(CH2)4-C6H4 ó 4-[6-(piperid-1-il)-pirid-3-il)]C6H4 ó 4-(pirid-4-il)-C6H4 ó C6H5S2NHCONHCH2.
3. Hidroxamatos de fórmula general I, según reivindicación 1, siendo R1 = R2 = (CH2CH2)2NH, y R3 = 4-(CH3)2NC6H4 ó 4-C6H5-C6H4 ó 3-FC6H4 ó 4-C6H5OC6H4 ó 4-CH3O-C6H4 ó 4-CH3(CH2)4-C6H4 ó 4-[6-(piperid-1-il)-pirid-3-il)]C6H4 ó 4-(pirid-4-il)-C6H4 ó C6H5S2NHCONHCH2.
4. Hidroxamatos de fórmula general II, según reivindicación 1, siendo R1 = H ó CH2CH2N[(CH2CH2)2O)], R2 = C6H5CH2 ó (CH3)2CH, y R3 = 4-(CH3)2NC6H4 ó 4-C6H5-C6H4 ó 3-C6H4 ó 4-C6H5OC6H4 ó 4-CH3O-C6H4 ó 4-CH3(CH2)4-C6H4 ó 4-[6- (piperid-1-il)-pirid-3-il)]C6H4 ó 4-(pirid-4-il)-C6H4 ó C6H5SO2NHCONHCH2.
5. Hidroxamatos de fórmula general III, según reivindicación 1, siendo R1 = R2 = (CH2CH2)2O.
6. Hidroxamatos de fórmula general III, según reivindicación 1, siendo R1 = R2 = (CH2CH2)2NH.
7. Hidroxamatos de fórmula general IV, según reivindicación 1, siendo R1 = H ó CH2CH2N[(CH2CH2)2O)] y R2 = C6H5CH2 ó (CH3)2CH.
8. Hidroxamatos, según reivindicaciones 1 a 7, caracterizados por su capacidad inhibidora de metaloproteasa de la matriz tipo 2 (MMP2), manifestada en estudio de acoplamiento molecular por técnicas computacionales de docking con referencia PDB 1 hov, estructura tridimensional de la MMP2 en complejo con hidroxamato inhibidor i52, donde el modo de unión teórico a la MMP2 resulta similar al del compuesto i52, con los dos oxígenos del grupo hidroxamato coordinando el ion Zn2+ catalítico, adoptando una geometría de bipirámide trigonal distorsionada, junto con la cadena lateral P1' dentro del bolsillo de unión S1'.
9. Hidroxamato AP206 (formula II con R1 = H, R2 = C6H5CH2 y R3 = 4-C6H5C6H4), según reivindicaciones 1, 4 y 8, caracterizado por presentar una actividad inhibitoria frente a MMP2 en ensayo de zimografía con valor de CI50 de 0,28 pM, y una selectividad expresada como cociente de los valores de CI50 MMP9/MMP2 de 1574 veces más activo que frente a MMP9.
10. Hidroxamato AP210 (formula II con R1 = H, R2 = C6H5CH2 y R3 = 4-C6H5OC6H4), según reivindicaciones 1, 4 y 8, caracterizado por presentar una actividad inhibitoria frente a MMP2 en ensayo de zimografía con valor de CI50 de 0,52 pM, y una selectividad expresada como cociente de los valores de CI50 MMP9/MMP2 de 259 veces más activo que frente a MMP9.
11. Sales farmacológicamente aceptables, o profármacos de sales, de hidroxamatos de formulas generales I y II, según reivindicaciones 1 a 4 y 8 a 10, tales como sulfato, metanosulfonato, clorhidrato, fosfato, nitrato, acetato, propionato, butirato, palmitato, oxalato, malonato, maleato, malato, fumarato, citrato o benzoato.
12. Uso de los hidroxamatos de formulas generales I y II, en particular AP206 y AP210, según reivindicación 11, en la preparación de medicamentos para el tratamiento de enfermedades en los que los cambios patológicos están mediados por metaloproteasa de la matriz tipo 2 (MMP2), como la angiogénesis, apoptosis, proliferación celular y metástasis.
13. Medicamentos, alguno de cuyos principios activos sean los hidroxamatos de formulas generales I y II, en particular AP206 y/o AP210, según reivindicación 12, en adición con un excipiente farmacéuticamente aceptable, diluyente, o soporte, para ser utilizados en terapia anticancerosa, bien en forma inyectable, en cápsulas, grageas o tabletas, o por cualquier otro medio disponible en clínica.
Patentes similares o relacionadas:
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Conectores autoinmolativos no lineales y conjugados de los mismos, del 22 de Julio de 2020, de Byondis B.V: Compuesto conector-farmaco con la formula (I) **(Ver fórmula)** o sal, hidrato o solvato farmaceuticamente aceptables del mismo, donde […]