PROCEDIMIENTO PARA LA PREPARACIÓN DE ZOLMITRIPTAN.
Procedimiento para la preparación de (S)-4-[(3-[2-(dimetilamino)etil]-1H-indol-5-il}metil]-2oxazolidinone (zolmitriptán) de fórmula III según el siguiente esquema caracterizado porque la reducción de la sal de diazonio a (S)-4-(4-hidracinobencil)-l,
3-oxazolidin-2-ona de fórmula IV se lleva a cabo mediante el efecto de un disulfito de metal alcalino, preferentemente disulfito de sodio
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CZ2008/000021.
Solicitante: ZENTIVA, K.S.
Nacionalidad solicitante: República Checa.
Dirección: U KABELOVNY 130 102 37 PRAHA 10 REPUBLICA CHECA.
Inventor/es: VOSLAR Michal , ZATOPKOVA Monika , RIDVAN Ludek, PEKAREK Tomas.
Fecha de Publicación: .
Fecha Solicitud PCT: 25 de Febrero de 2008.
Clasificación Internacional de Patentes:
- C07D413/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 413/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y oxígeno como únicos heteroátomos del ciclo. › unidos por una cadena de carbono que contiene solamente átomos de carbono alifáticos.
Clasificación PCT:
- C07D413/06 C07D 413/00 […] › unidos por una cadena de carbono que contiene solamente átomos de carbono alifáticos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2356501_T3.pdf
Fragmento de la descripción:
Sector técnico
La presente invención se refiere a un procedimiento de preparación de (S)-4-[{3-[2-(dimetilamino)etil]-1H-indol-5-il}metil]-2-oxazolidinona (zolmitriptán), que pertenece al grupo de los triptanos utilizados para el tratamiento de la migraña. 5
Técnica anterior
La síntesis de zolmitriptán consiste en tres reacciones generalmente conocidas (WO97/06162): diazotación de (S)-4-(4-aminobencil)-l,3-oxazolidin-2-ona de fórmula I con un nitrito en un ambiente de ácido clorhídrico diluido, reducción posterior de la sal de diazonio resultante a clorhidrato de (S)-4-(4-hidracinobencil)-l,3-oxazolidin-2-ona de fórmula IV y finalmente su condensación con 4,4-dietoxi-N,N-dimetilbutilamina de fórmula II, que, en un ambiente 10 ácido, según Fischer, proporciona un esqueleto de indol -en este caso zolmitriptán de fórmula III- en un mecanismo análogo a la transposición de bencidina. Toda la síntesis se lleva a cabo en un ambiente acuoso y no requiere el aislamiento de intermediarios.
**(Ver fórmula)**
Como reactivo de reducción en la etapa de reducción de la síntesis se utiliza cloruro de estaño o un 15 sulfito alcalino, por ejemplo Na2SO3 (WO97/06162). Sin embargo, el uso de cloruro de estaño causa problemas con la purificación del producto y aguas residuales de sales de estaño ambientalmente indeseables y es por ello que no es adecuado a escala de producción. Por otra parte, el Na2SO3 es relativamente poco soluble, lo que resulta en la necesidad de una dilución más fuerte de la mezcla de reducción o en un sistema de reacción heterogéneo (suspensión). Las reacciones heterogéneas pueden provocar problemas con la agitación, especialmente en una escala mayor, 20 mientras que la dilución de la mezcla de reacción requiere un aumento sustancial del tiempo de reacción. La segunda etapa de la reducción que se lleva a cabo en un ambiente ácido a 60 oC en esta solución homogénea diluida, requiere generalmente de hasta 18 horas (WO 97/06162), que, además de los costes de la energía y del personal, también aumenta la carga de calor indeseable del producto intermedio y reduce el rendimiento de la síntesis.
Generalmente, el producto sin purificar se recupera de la mezcla de reacción después de su 25 alcalinización (NaOH/agua) mediante la extracción repetida con un disolvente orgánico, generalmente acetato de etilo (WO 97/06162). Después de la concentración de los extractos hasta una fracción del volumen inicial se obtiene zolmitriptán cristalino no purificado en forma de solvato con acetato de etilo, que se purifica mediante la recristalización a partir de la mezcla de etanol-acetato de etilo y posteriormente se elimina el solvato mediante agitación en acetona acuosa. Finalmente, el producto –base de zolmitriptán- se elimina mediante filtración y se lava con acetato de etilo. 30
Sin embargo, con respecto a la relativamente baja solubilidad del zolmitriptán en acetato de etilo, el procedimiento de aislamiento por extracción mencionado anteriormente requiere considerables volúmenes del agente de extracción (aproximadamente 25 veces el del producto final) y su evaporación posterior. Sin mencionar las demandas de energía y tiempo de dicho procedimiento, durante la concentración a una escala mayor el producto está también sometido a una carga de calor considerable que, con respecto al aumento de la temperatura y al carácter del 35 disolvente, incluso se multiplica por la reactividad mutua del producto (amina básica) con el disolvente (éster) y también por la hidrólisis del producto y del disolvente provocada por el ambiente acuoso alcalino durante las extracciones.
Por esta razón, han sido buscados las condiciones en las que se podrían eliminar o minimizar los aspectos negativos mencionados anteriormente de los procedimientos de síntesis zolmitriptán conocidos hasta ahora.
Características de la invención 40
La presente invención consiste en un procedimiento mejorado de preparación de (S)-4-[{3-[2-(dimetilamino)etil]-1H-indol-5-il}metil]-2-oxazolidinona (zolmitriptán), que se basa, por un lado, en la optimización de las condiciones de reacción en la etapa de reducción cuando se reduce una sal, por ejemplo cloruro, de (S)-4-(4-bencildiazonio)-l,3-oxazolidin-2-ona en una solución acuosa a (S)-4-(4-hidracinobencil)-l,3-oxazolidin-2-ona mediante el efecto de un disulfito de metal alcalino, y, por otra parte, en un procedimiento nuevo de aislamiento del producto final 45 (zolmitriptán de fórmula III), que consiste en el aislamiento del solvato de tolueno de zolmitriptán impuro como un producto intermedio, su purificación y desolvatación.
También se describe la preparación del solvato de zolmitriptán con tolueno, que puede utilizarse preferentemente para el aislamiento de zolmitriptán impuro a partir de la mezcla de reacción y su purificación posterior.
Descripción de la invención
Se ha encontrado de forma experimental que un disulfito de metal alcalino, el más preferente Na2S2O5, es un agente de reducción adecuado para la reducción de la sal de diazonio a (S)-4-(4-hidracinobencil)-l,3-5 oxazolidin-2-ona ya que es sustancialmente más soluble en agua y al mismo tiempo más barato que el Na2SO3. Es adecuado al mismo tiempo ajustar el pH de la solución del agente de reducción con una cantidad menor de un hidróxido de metal alcalino (por ejemplo, NaOH) - a del Na2S2O5 utilizado en base molar. La cantidad de agua requerida para la formación de una solución homogénea estable a temperaturas alrededor de 0 oC es sólo de 2,5 – 3 veces del Na2S2O5 utilizado y el tiempo requerido para la etapa ácida de la reacción a 60 oC y pH ≈ 0 (HCl) es solamente de 5 - 6 10 horas, es decir, solo un tercio del tiempo requerido con una dilución normal mayor. Además, la composición de las muestras tomadas de la mezcla durante la reacción medida mediante HPLC y LC-MS muestran que con el uso de un disulfito el mecanismo de reacción de la reducción es diferente del esperado en el caso de la reducción con un sulfito.
Antes de la síntesis final de Fischer, la mezcla de reacción se diluye en agua (aproximadamente la mitad del volumen con respecto a la mezcla de reacción), se añade 4,4-dietoxi-N,N-dimetilbutilamina de fórmula II y la 15 mezcla se mantiene en reflujo a pH = 0,6 - 1 y temperatura de aproximadamente 98 oC durante 2,5 horas. Esto significa que toda la secuencia de la reacción se puede llevar a cabo en un funcionamiento de tres turnos en un mismo día.
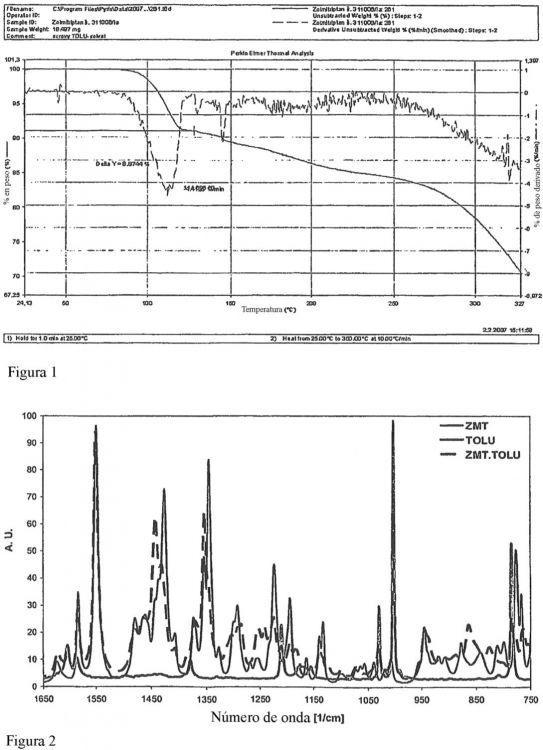
También se describe un procedimiento totalmente nuevo de aislamiento de zolmitriptán en forma de solvato de tolueno. Está basado en la observación que de la mezcla de la reacción acuosa después de la reacción de Fischer, a la cual se añade una pequeña cantidad de tolueno y se emulsiona, el zolmitriptán sólido cristaliza durante la 20 alcalinización lenta con una solución acuosa de un carbonato de metal alcalino o de un hidróxido, por ejemplo NaOH o K2CO3. El producto cristalino impuro obtenido de este modo contiene de 9 - 14% en peso de tolueno según la cromatografía de gases. Este resultado está de acuerdo con el registro obtenido mediante el análisis termogravimétrico (figura 1), que muestra una pérdida rápida de aproximadamente el 10% de la masa alrededor de 111 oC correspondiente al punto de ebullición del tolueno a presión normal. El contenido de tolueno establecido de esta manera 25 corresponde a la representación molar probable de tolueno en la red cristalina de 1:2 (13,8% en peso).
La nueva forma cristalina de zolmitriptán con tolueno incorporado en su red cristalina está claramente caracterizada por fuertes bandas de Raman en 1354 y 1443 cm-1 junto con bandas de tolueno características (a 786 y 1014 cm-1) en el espectro de Raman del solvato (figura 2). Para mayor claridad, el espectro de Raman del solvato de zolmitriptán impuro (línea discontinua en negro) se compara aquí con el espectro del zolmitriptán puro (línea continua 30 negra) y tolueno libre (línea continua gris).
El solvato de tolueno de zolmitriptán impuro se puede purificar mediante recristalización de disolventes comunes, por ejemplo alcoholes, acetona, acetato de etilo y similares, o sus mezclas o mezclas con tolueno. La recristalización de disolventes que no contienen tolueno también se puede utilizar para la desolvatación del producto. La desolvatación también se puede conseguir con el uso del secado a largo plazo a presión reducida a temperaturas de 35 60 a 100 oC.
La desolvatación y al mismo tiempo la purificación nuevamente del... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la preparación de (S)-4-[(3-[2-(dimetilamino)etil]-1H-indol-5-il}metil]-2-oxazolidinone (zolmitriptán) de fórmula III
5
según el siguiente esquema
**(Ver fórmula)**
caracterizado porque la reducción de la sal de diazonio a (S)-4-(4-hidracinobencil)-l,3-oxazolidin-2-ona de fórmula IV se lleva a cabo mediante el efecto de un disulfito de metal alcalino, preferentemente disulfito de sodio. 10
2. Procedimiento, según la reivindicación 1, caracterizado porque el producto de fórmula III se aísla primero en forma de solvato de tolueno, que se transforma posteriormente en la forma no solvatada.
3. Procedimiento, según la reivindicación 2, caracterizado porque después de que se completa la reacción, se añaden a la mezcla de reacción tolueno y una base del grupo de carbonatos o hidróxidos de metales alcalinos, por ejemplo NaOH o K2CO3, o sus soluciones acuosas. 15
4. Procedimiento, según la reivindicación 2, caracterizado porque el solvato de tolueno se transforma a la sustancia no solvatada mediante secado a una temperatura de 60 a 100 oC.
5. Procedimiento, según la reivindicación 2, que comprende además la desolvatación y purificación del solvato de tolueno de zolmitriptán para formar la base de zolmitriptán, caracterizado porque el solvato de tolueno se disuelve en un ácido diluido, por ejemplo HCl, la fase superior inmiscible del tolueno se separa de la mezcla 20 y, a continuación, el zolmitriptán se libera de la solución acuosa ácida restante mediante la adición de una base del grupo de carbonatos o hidróxidos de metales alcalinos, por ejemplo NaOH o K2CO3, o sus soluciones, por ejemplo soluciones acuosas o alcohólicas.
Patentes similares o relacionadas:
Análogos de indolina y usos de los mismos, del 8 de Julio de 2020, de Oncternal Therapeutics, Inc: Un compuesto que tiene la fórmula (I): **(Ver fórmula)** o un estereoisómero, una sal farmacéuticamente aceptable, o solvato del mismo, donde A se […]
Derivado de amina cíclica y uso farmacéutico del mismo, del 1 de Julio de 2020, de TORAY INDUSTRIES, INC.: Un derivado de amina cíclica representado por la siguiente fórmula general (I): **(Ver fórmula)** donde R1 representa un grupo alquiloxi que tiene de 1 a 3 átomos […]
Lactamas fusionadas con arilo y heteroarilo, del 24 de Junio de 2020, de PFIZER INC.: Un compuesto de fórmula (II-A): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: R1 es alquilo C1-C8, alcoxi C1-C8, halo, […]
Derivados de 4-carboxamido-isoindolinona como inhibidores selectivos de PARP-1, del 27 de Mayo de 2020, de NERVIANO MEDICAL SCIENCES S.R.L.: Un compuesto de fórmula (I): **(Ver fórmula)** en el que: R es hidrógeno o flúor; y n, m, R1 y R2 tienen los significados siguientes: a) n es 0 y m es 0, 1, […]
Derivados de N-piperidinil acetamida como bloqueadores de canales de calcio, del 20 de Mayo de 2020, de Praxis Precision Medicines, Inc: Una composición farmacéutica que comprende un compuesto que tiene la estructura: **(Ver fórmula)** o una sal o conjugado farmacéuticamente […]
Compuesto heterocíclico, del 13 de Mayo de 2020, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un compuesto **(Ver fórmula)** en donde el Anillo A es un anillo opcionalmente sustituido adicionalmente, el Anillo D es un anillo opcionalmente sustituido […]
Procedimiento para compuesto antifúngico, del 6 de Mayo de 2020, de Mycovia Pharmaceuticals, Inc: Un procedimiento para preparar la morfolin amida 2b: **(Ver fórmula)** que comprende la amidación del éster 2: **(Ver fórmula)** […]
Compuestos heterocíclicos y métodos para su uso, del 25 de Marzo de 2020, de NOVARTIS AG: Un compuesto de formula (I): **(Ver fórmula)** donde X es -CHR4-, -CH2CHR4- o -C(=O)-; R1 es -C(=O)CH(fenil)(fenilo), -C(=O)CH(fenil)(ciclohexilo), […]