USOS DEL ANTICUERPO MONOCLONAL 8H9.
Un anticuerpo aislado, en el que la región determinante de la complementariedad es NYDIN para CDR1,
WIFPGDGSTQYNE para CDR2, QTTATWFAY para CDR3 para la cadena pesada y RASQSISDYLH para la CDR1, YASQSIS para CDR2, QNGHSFPLT para CDR3 para la cadena ligera
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/007004.
Solicitante: SLOAN-KETTERING INSTITUTE FOR CANCER RESEARCH.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1275 YORK AVENUE NEW YORK NEW YORK 10021 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CHEUNG,Nai-Kong,V.
Fecha de Publicación: .
Fecha Solicitud PCT: 6 de Marzo de 2003.
Clasificación Internacional de Patentes:
- A61K49/00H4
- A61K51/10B30
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/30 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de células tumorales.
- C07K16/30L
- C07K16/30S10
- C07K16/42K
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K49/00 A61K […] › Preparaciones para examen in vivo.
- C07K16/00 C07K […] › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/30 C07K 16/00 […] › de células tumorales.
- C12N15/11 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/85 C12N 15/00 […] › para células animales.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- C12Q1/70 C12Q 1/00 […] › en los que intervienen virus o bacteriófagos.
- G01N33/00 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00.
- G01N33/53 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
Clasificación antigua:
- A61K6/00 A61K […] › Preparaciones para técnica dental.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357425_T3.pdf



Fragmento de la descripción:
Usos del anticuerpo monoclonal 8H9.
Antecedentes de la invención
Los antígenos de superficie limitados a tumor pueden ser dianas para terapias de diagnóstico e inmunitarias. El anticuerpo monoclonal 8H9 es un hibridoma IgG1 murino derivado de la fusión de células SP2/0 de mieloma de ratón y linfocitos esplénicos de ratones BALB/c inmunizados con neuroblastoma humano. Por inmunohistoquímica, el 8H9 era altamente reactivo con tumores cerebrales humanos, sarcomas infantiles, neuroblastomas y menos con adenocarcinomas. Entre los tumores cerebrales primarios, 15/17 glioblastomas, 3/4 gliomas mixtos, 4/11 oligodendrogliomas, 6/8 astrocitomas, 2/2 meningiomas, 3/3 schwannomas, 2/2 meduloblastomas, 1/1 neurofibroma, 1/2 tumores neurogliales, 2/3 ependimomas y 1/1 pineoblastoma dieron positivo. Entre los sarcomas, 21/21 Ewing/PNET, 28/29 rabdomiosarcomas, 28/29 osteosarcomas, 35/37 tumores desmoplásicos de células redondas pequeñas, 2/3 sarcomas sinoviales, 4/4 leiomiosarcomas, 1/1 histiocitoma fibroso maligno y 2/2 sarcomas no diferenciados dieron positivo con 8H9. 87/90 neuroblastomas, 12/16 melanomas, 3/4 hepatoblastomas, 7/8 tumores de Wilm, 3/3 tumores rabdoides y 12/27 adenocarcinomas también dieron positivo. A diferencia, el 8H9 no fue reactivo con tejidos humanos normales que incluyen médula ósea, colon, estómago, corazón, pulmón, músculo, tiroides, testículos, páncreas y cerebro humano (lóbulo frontal, cerebelo, protuberancia y médula espinal). La reactividad con tejido de mono cinomolgo normal fue similarmente limitada. La inmunofluorescencia indirecta localizó el antígeno reconocido por 8H9 en la membrana celular. El antígeno es sensible a proteinasa y no está fácilmente modulado por la superficie celular. El 8H9 inmunoprecipitó una banda de 58 kD tras el tratamiento con N-glucanasa, lo más probable una proteína con grado heterogéneo de glucosilación. Este novedoso sistema anticuerpo-antígeno puede tener posibilidades de elegir como diana tumores.
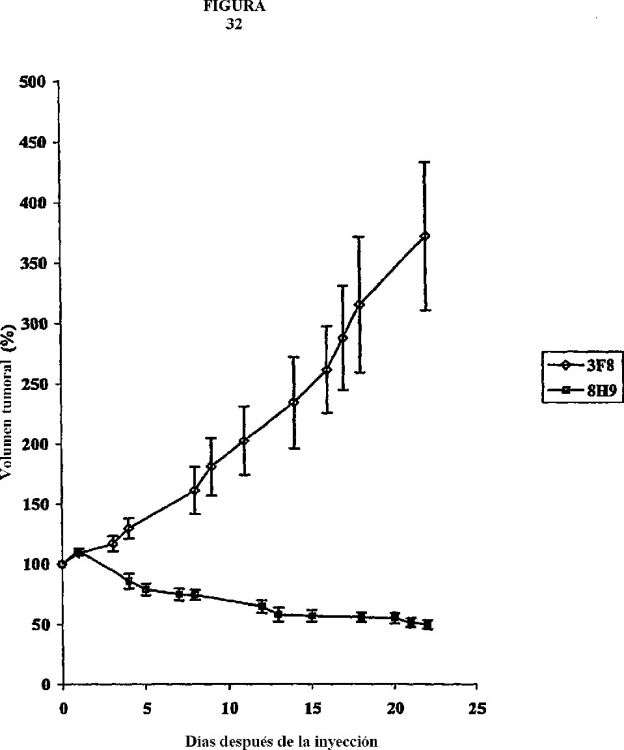
Los anticuerpos monoclonales tales como 3F8 (1) y 14.18 (2) contra GD2 en neuroblastoma, M195 contra CD33 en leucemia aguda (3), anticuerpos dirigidos contra HER2 en cáncer de mama (4) y anticuerpos dirigidos contra CD20 en linfoma (5) han mostrado eficacia en ensayos clínicos recientes. El pronóstico en tumores cerebrales de la glía y tumores metastásicos, mesenquimatosos y neuroectodérmicos sigue siendo pésimo a pesar de las innovaciones en quimioterapia y radioterapia. La inmunoterapia puede ofrecer nuevas posibilidades para mejorar el resultado en estos pacientes.
Los antígenos tumorales expresados en la membrana celular son posibles dianas en inmunoterapia. Ejemplos de antígenos tumorales expresados en tumores de la glía incluyen moléculas de adhesión de células neurales (6), gangliósidos tales como GD2 y GM2 (7) y antígenos neurohematopoyéticos (8). Las recientes investigaciones se han centrado en receptores de factores de crecimiento como inmunodianas, en particular el receptor del factor de crecimiento epidérmico mutante de tipo III (EGFRvIII) que se ha mostrado que se expresa en el 50% de los tumores cerebrales de la glía (9). A pesar de la expresión universal de NCAM por células neuronales, dos estudios clínicos han utilizado anticuerpos dirigidos contra NCAM en pacientes. Se mostró que el mAb UJ13A se acumulaba localmente en gliomas en virtud de la alteración de la barrera hematoencefálica (10) y se usó otro anticuerpo, ERIC-1, en un entorno terapéutico en cavidades de glioma reseccionadas con algún beneficio clínico (11).
Estudios recientes han elegido como diana inmunoterapia para la matriz extracelular alrededor de células tumorales. Se ha informado que la tenascina se expresa en el 50-95% de los tumores cerebrales de la glía, además de en tumores mesenquimatosos, carcinomas y células de la glía, de hígado y de riñón humanas normales (12). Recientemente se ha informado que anticuerpos monoclonales dirigidos contra tenascina 81C6 (13) y BC-2 y BC-4 (14) administrados de forma intracavitaria muestran eficacia en el tratamiento de pacientes con gliomas malignos. Sin embargo, como estos antígenos también están presentes a grados variables en células neurales y no neurales humanas normales, su utilidad clínica dependería de su expresión en exceso por tumores cerebrales cuando se compara con tejidos normales. Con la excepción de EGFRvIII, los antígenos de los tumores de la glía descritos hasta la fecha se encuentran generalmente en tejido cerebral normal, o están limitados a compartimentos intracelulares, por tanto, con utilidad clínica limitada para la elección como diana de anticuerpos.
Los antígenos de membrana que han sido elegidos como diana en osteosarcoma incluyen GD2 (15), CD55 (16) y un antígeno asociado a osteosarcoma aún sin definir reconocido por los MoAb TP-1 y TP-3 (17). Sin embargo, estos antígenos están presentes a grados variables en tejidos normales.
Similarmente, la glicoproteína p 30/32 codificada por el oncogén MIC2 y reconocida por el anticuerpo monoclonal 013 en la familia de tumores de Ewing se expresa en tejidos normales (18). En rabdomiosarcoma, la familia MyoD de proteínas oncofetales es de localización nuclear (19) y, por tanto, inaccesible a inmunoterapia que elige como diana anticuerpos.
Un antígeno tumoral ideal para la inmunoterapia de elección de diana estaría ausente en tejidos normales y se expresaría abundantemente en la superficie celular de tumores. Tales antígenos específicos de tumor, por ejemplo, idiotipos en linfoma de linfocitos B, son raros (20). Además, un antígeno específico de tumor "genérico" expresado en células tumorales de linaje variable reconocidas por anticuerpos monoclonales puede tener utilidad más amplia en estrategias basadas en anticuerpos. Los inventores describen aquí un antígeno asociado a tumor novedoso reconocido por un anticuerpo monoclonal murino 8H9 expresado en membranas celulares de un amplio espectro de tumores de origen neuroectodérmico, mesenquimatoso y epitelial, con distribución limitada en tejidos normales.
Resumen de la invención
La presente invención proporciona una composición que comprende una cantidad eficaz de anticuerpo monoclonal 8H9 o un derivado del mismo y un vehículo adecuado. La presente invención proporciona una composición farmacéutica que comprende una cantidad eficaz de anticuerpo monoclonal 8H9 o un derivado del mismo y un vehículo farmacéuticamente aceptable.
La presente invención también proporciona un anticuerpo distinto del anticuerpo monoclonal 8H9 que comprende las regiones determinantes de la complementariedad del anticuerpo monoclonal 8H9 o un derivado del mismo que pueden unirse al mismo antígeno que el anticuerpo monoclonal 8H9.
La presente invención proporciona una sustancia que puede inhibir competitivamente la unión del anticuerpo monoclonal 8H9. En una realización de la sustancia es un anticuerpo.
La presente invención proporciona un anticuerpo aislado en el que la región determinante de la complementariedad es NYDIN para CDR1, WIFPGDGSTQY para CDR2, QTTATWFAY para CDR3 para la cadena pesada y RASQSISDYLH para CDR1, YASQSIS para CDR2, QNGHSFPLT para CDR3 para la cadena ligera. La presente invención proporciona además el anticuerpo anterior, en el que las otras secuencias son de origen humano.
La invención también proporciona una composición que comprende una cantidad eficaz de anticuerpo monoclonal 8H9 o un derivado del mismo y un vehículo adecuado que incluye secuencias como se exponen en la Figura 33. En una realización, las secuencias están mutadas. La presente invención también proporciona la forma mutada de 8H9 para reducir el fondo y citotoxicidad. Podrían establecerse otras mutaciones que podrían lograr la función anteriormente descrita. En otra realización, el anticuerpo incluye secuencias como se exponen en la Figura 34.
Además, la invención proporciona una composición que comprende los anticuerpos anteriores y una molécula aislada de ácido nucleico que codifica los anticuerpos anteriores. La presente invención también proporciona la molécula aislada de ácido nucleico anterior, en la que las secuencias se exponen en la Figura 33.
Además, la presente invención proporciona un vector que comprende las moléculas de ácidos nucleicos anteriores. La invención también proporciona una célula que comprende el vector anterior.
La presente invención proporciona un scFv de anticuerpo monoclonal... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo aislado, en el que la región determinante de la complementariedad es NYDIN para CDR1, WIFPGDGSTQYNE para CDR2, QTTATWFAY para CDR3 para la cadena pesada y RASQSISDYLH para la CDR1, YASQSIS para CDR2, QNGHSFPLT para CDR3 para la cadena ligera.
2. El anticuerpo de la reivindicación 1, en el que las secuencias que no se corresponden con la región determinante de la complementariedad son de origen humano.
3. El anticuerpo de la reivindicación 1 ó 2, que incluye secuencias como se exponen en SEQ ID NO: 2 o SEQ ID NO: 3.
4. El anticuerpo de una cualquiera de las reivindicaciones 1 a 3, en el que el anticuerpo está marcado.
5. El anticuerpo de las reivindicaciones 1 a 3, en el que dicho anticuerpo es un scFv aislado.
6. El anticuerpo de las reivindicaciones 1 a 3, en el que dicho anticuerpo es un scFv-Fc aislado.
7. Un anticuerpo que puede inhibir competitivamente la unión de anticuerpo monoclonal de una cualquiera de las reivindicaciones 1 a 4, o que puede inhibir competitivamente la unión de un fragmento scFv de la reivindicación 5 ó 6.
8. Una composición que comprende el anticuerpo o el anticuerpo marcado de una cualquiera de las reivindicaciones 1 a 4, o un fragmento scFv del mismo de la reivindicación 5 ó 6 y un vehículo adecuado.
9. Una composición de la reivindicación 8, en la que el anticuerpo es una construcción de fusión de anticuerpos.
10. La composición de la reivindicación 8, en la que el scFv o un scFv-Fc está directamente o indirectamente acoplado a un agente citotóxico.
11. La composición de la reivindicación 10, en la que el agente citotóxico es un radioisótopo.
12. Una molécula de ácido nucleico aislado que codifica el anticuerpo o un fragmento scFv del mismo según una cualquiera de las reivindicaciones 1 a 6.
13. Un vector que comprende las moléculas de ácidos nucleicos de la reivindicación 12.
14. Una célula que comprende el vector de la reivindicación 13.
15. Una célula o un liposoma que comprende un anticuerpo o un anticuerpo marcado de una cualquiera de las reivindicaciones 1 a 4, o un fragmento scFv según la reivindicación 5 ó 6.
16. Una célula o liposoma modificado por scFv según la reivindicación 5.
17. Una célula de una cualquiera de las reivindicaciones 14 a 16 que es un eritrocito.
18. El anticuerpo monoclonal, el anticuerpo monoclonal marcado o el fragmento scFv según una cualquiera de las reivindicaciones 1 a 7 o la composición de una cualquiera de las reivindicaciones 8 a 11 como terapia antitumoral.
19. Uso de un anticuerpo monoclonal, un anticuerpo monoclonal marcado o un fragmento scFv del mismo según una cualquiera de las reivindicaciones 1 a 7, o la composición según una cualquiera de las reivindicaciones 8 a 11 para la preparación de un medicamento para destruir y/o reducir células tumorales y/o inhibir el crecimiento del tumor.
20. Uso del anticuerpo monoclonal o un fragmento scFv según una cualquiera de las reivindicaciones 1 a 7, o la composición según una cualquiera de las reivindicaciones 8 a 11 para la preparación de un medicamento para obtener imágenes de células tumorales que portan el antígeno reconocido por el anticuerpo monoclonal de la reivindicación 1, en el que el anticuerpo monoclonal o el scFv están marcados.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]
Proteínas y péptidos modificados, del 24 de Junio de 2020, de GLAXO GROUP LIMITED: Un dominio variable de inmunoglobulina único, que se une a TNFR1 y que se selecciona de cualquiera de las siguientes secuencias de aminoácidos: (a) DOM1h-131-206 caracterizada […]
Métodos para purificar una proteína objetivo de una o más impurezas en una muestra, del 17 de Junio de 2020, de EMD Millipore Corporation: Un metodo para purificar una proteina objetivo que contiene una region Fc de una o mas impurezas en una muestra, el metodo comprende las etapas de: a) poner en contacto […]
Dominios variables de inmunoglobulina, del 10 de Junio de 2020, de Ablynx NV: Dominio variable individual de inmunoglobulina de cadena pesada (ISVD), en que el residuo aminoacídico en la posición 89 es L y el residuo […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]