CONJUGADOS DE PEG-OXIDASA DE URATO Y SU USO.
Un conjugado compuesto por una uricasa purificada conjugada a un poli(etilenglicol) (PEG),
en la que al menos el 90% de dicha uricasa se halle en una forma tetramérica
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05011069.
Solicitante: MOUNTAIN VIEW PHARMACEUTICALS, INC.
DUKE UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3475-S EDISON WAY MENLO PARK, CA 94025-1813 ESTADOS UNIDOS DE AMERICA.
Inventor/es: HERSHFIELD, MICHAEL, S., KELLY, SUSAN, J., SAIFER, MARK, G., P., SHERMAN, MERRY, R., L. David Williams.
Fecha de Publicación: .
Fecha Solicitud PCT: 2 de Agosto de 1999.
Clasificación Internacional de Patentes:
- A61K38/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Oxidoreductasas (1).
- A61K47/48H4P
- C12N9/02P
- C12N9/06F2
- C12N9/96 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Estabilización de una enzima por formación de un aducto o de una composición; Formación de conjugaciones de enzimas.
Clasificación PCT:
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
PDF original: ES-2361190_T3.pdf
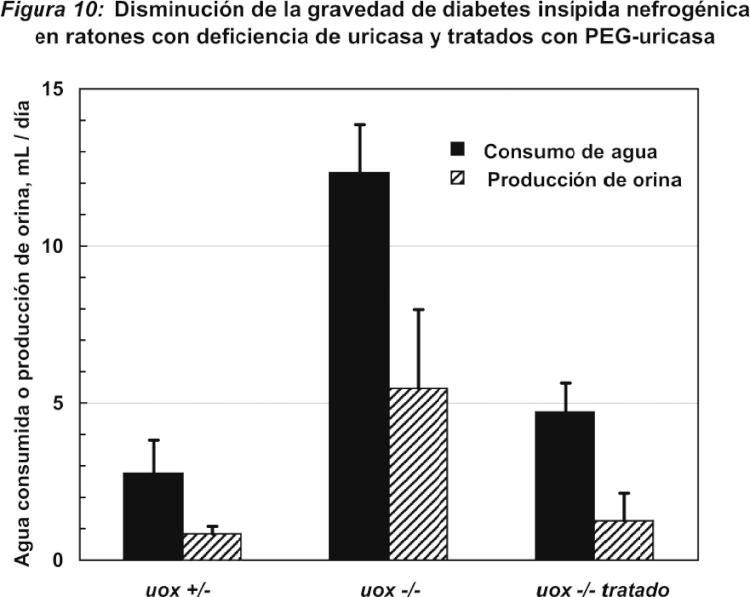
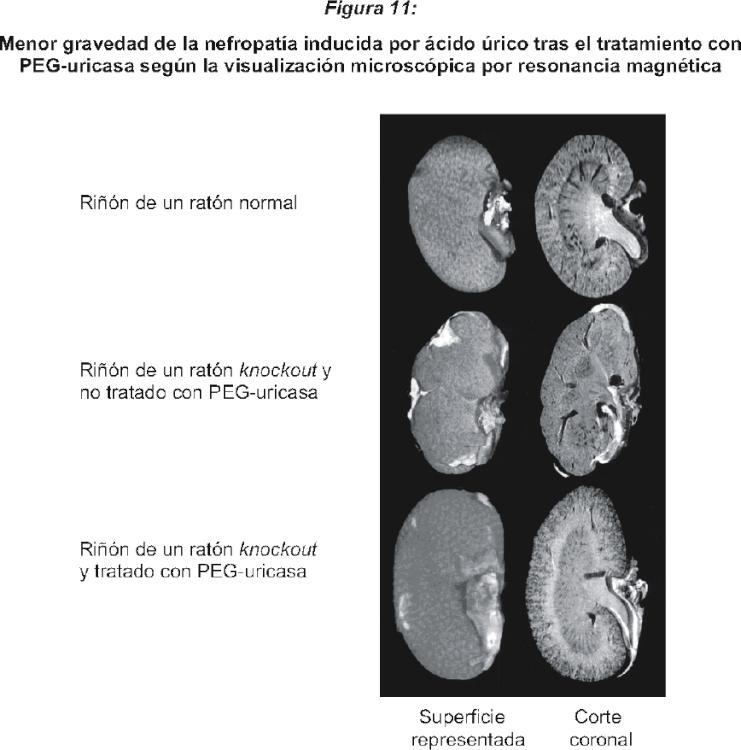
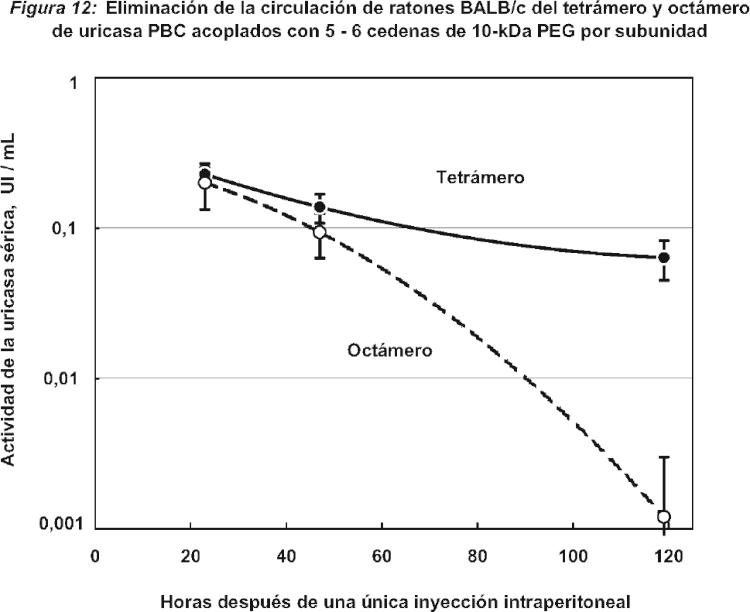
Fragmento de la descripción:
Campo de la invención
La presente invención trata sobre la modificación química de proteínas para prolongar su vida en circulación y reducir su inmunogenia. Más específicamente, la invención aborda la conjugación de polietilenglicol u óxido de polietileno con oxidasas de urato, que elimina considerablemente la inmunogenia de la oxidasa de urato sin comprometer su actividad uricolítica.
Antecedentes de la Invención
Las declaraciones que aparecen en esta sección no constituyen una admisión de la tecnología anterior, sino que reflejan los comentarios e interpretaciones subjetivas de los inventores sobre el estado que guardaba la tecnología en el momento que se llevó a cabo esta invención. Dichas interpretaciones pueden reflejar las ideas personales de los inventores, y por lo tanto no conocidas, las cuales no forman parte por sí mismas de la arte anterior.
Las oxidasas de urato (uricasas; E. C. 1.7.3.3) son enzimas que catalizan la oxidación del ácido úrico en un producto más soluble, alantaína, un metabolito que es más fácil de excretar. Los seres humanos no producen uricasas activas enzimáticamente como resultado de varias mutaciones del gen para uricasa adquirido durante la evolución de los primates superiores. Wu, X, et al., (1992) J Mol Evol 34:78-84. En consecuencia, en individuos susceptibles, una concentración excesiva de ácido úrico en sangre (hiperuricemia) y en orina (hiperuricosuria) pueden ocasionar artritis dolorosa (gota), depósitos de urato desfigurantes (tofos) e insuficiencia renal. En algunos individuos afectados, los medicamentos disponibles como el alopurinol (un inhibidor de la síntesis del ácido úrico) producen efectos secundarios limitadores del tratamiento o no alivian los síntomas de manera satisfactoria. Hande, KR, et al., (1984) Am J Med 76:4756; Fam, AG, (1990) Baillière's Clin Rheumatol 4:177-192. Las inyecciones de uricasa pueden disminuir la hiperuricemia e hiperuricosuria, por lo menos de manera transitoria. No obstante, dado que la uricasa es una proteína extraña en los seres humanos, incluso la primera inyección de proteína no alterada de Aspergillus flavus ha dado lugar a reacciones anafilácticas en diferentes porcentajes de pacientes bajo tratamiento (Pui, C-H, et al., (1997) Leukemia 11:1813-1816) y las respuestas inmunológicas restringen su utilidad para tratamientos crónicos o intermitentes. Donadio, D, et al., (1981) Nouv Presse Méd 10:711-712; Leaustic, M, et al., (1983) Rev Rhum Mal Osteoartic 50:553-554.
Durante varias décadas se ha reconocido que los resultados de los tratamientos disponibles para la hiperuricemia no alcanzan un nivel óptimo. Kissel, P, et al., (1968) Nature 217:72-74. De la misma manera, hace años que se reconoce la posibilidad de que determinados grupos de pacientes con gota severa podrían verse beneficiados por un tratamiento con uricasa inyectable en forma segura y eficaz. Davis, FF, et al., (1978) in GB Broun, et al., (Eds.) Enzyme Engineering, Vol. 4 (pp. 169-173) New York, Plenum Press; Nishimura, H, et al., (1979) Enzyme 24:261-264; Nishimura, H, et al., (1981) Enzyme 26:49-53; Davis, S, et al., (1981) Lancet 2(8241):281-283; Abuchowski, A, et al., (1981) J Pharmacol Exp Ther 219:352-354; Chen, RH-L, et al., (1981) Biochim Biophys Acta 660:293-298; Chua, CC, et al., (1988) Ann Int Med 109:114-117; Greenberg, ML, et al., (1989) Anal Biochem 176:290-293. Las uricasas derivadas de los órganos animales son prácticamente insolubles en disolventes que son compatibles con la administración segura mediante inyección. Patente estadounidense 3,616,231. Ciertas uricasas derivadas de las plantas o microorganismos son más solubles en disolventes aceptables en términos médicos. Sin embargo, la inyección de enzimas microbianas induce con rapidez respuestas inmunológicas que pueden ocasionar reacciones alérgicas potencialmente mortales o una inactivación o eliminación acelerada de la uricasa de la circulación. Donadio, et al., (1981); Leaustic, et al., (1983). Las enzimas basadas en secuencias de aminoácidos deducidas de uricasas de mamíferos, incluyendo el cerdo y el babuino, o de insectos, como Drosophila melanogaster o Drosophila pseudoobscura (Wallrath, LL, et al., (1990) Mol Cell Biol 10:51145127), no han sido candidatos aconsejables para su uso clínico, debido a los problemas de inmunogenia e insolubilidad en el pH fisiológico.
Se han utilizado las alteraciones covalentes de las proteínas con polietilenglicol u óxido de polietileno (ambos conocidos como PEG) para aumentar la hemivida de las proteínas y reducir la inmunogenia. Patentes estadounidenses 4,179,337, 4,766,106 y 4,847,325; Saifer, MGP, et al., (1994) Adv Exp Med Biol 366:377-387. La combinación de PEG de peso molecular elevado para producir conjugados con ciclos vitales de circulación prolongada o inmunogenia reducida – mientras que se conserva la actividad funcional– se demostró con anterioridad para otra enzima, la dismutasa de superóxido (Somack, R, et al., (1991) Free Rad Res Commun 12-13:553-562; Patentes estadounidenses 5,283,317 y 5,468,478) y para otros tipos de proteínas, por ejemplo citocinas (Saifer, MGP, et al., (1997) Polym Preprints 38:576-577; Sherman, MR, et al., (1997) in JM Harris, et al., (Eds.), Poly(ethylene glycol) Chemistry and Biological Applications. ACS Symposium Series 680 (pp. 155-169) Washington, DC: American Chemical Society). Asimismo, se han descrito conjugados de uricasa con polímeros distintos a PEG. Patente estadounidense 4,460,683.
Prácticamente todos los intentos registrados de PEGilar la uricasa (es decir, combinar covalentemente PEG con uricasa), el PEG se agregó predominalmente a grupos amino, incluyendo los residuos amino-terminal y los residuos disponibles de lisina. En las uricasas más utilizadas, el número total de lisinas en cada una de las cuatro subunidades idénticas se encuentra entre 25 (Aspergillus flavus (Patente estadounidense 5,382,518)) y 29 (cerdo (Wu, X, et al., (1989) Proc Natl Acad Sci USA 86:9412-9416)). Algunas lisinas no están disponibles para la PEGilación en la conformación nativa de la enzima. El método más común para reducir la inmunogenia de la uricasa ha sido combinar grandes cantidades de cadenas de PEG de bajo peso molecular. Esto ha tenido como resultado un gran descenso de la actividad enzimática de los conjugados resultantes.
Los investigadores anteriores utilizaron uricasa inyectada para catalizar la conversión del ácido úrico en alantaína in vivo. Véase Pui, et al., (1997). Ésta es la base para el uso en Francia e Italia de la uricasa derivada del hongo Aspergillus flavus (Uricozyme®) para prevenir o corregir provisionalmente la hiperuricemia asociada con la terapia citotóxica para neoplasias hematológicas y para reducir de manera transitoria la hiperuricemia grave en pacientes con gota. Potaux, L, et al., (1975) Nouv Presse Méd 4:1109-1112; Legoux, R, et al., (1992) J Biol Chem 267:8565-8570; Patentes estadounidenses 5,382,518 y 5,541,098. Debido a su corta vida de circulación, Uricozyme® requiere inyecciones diarias y, además, no es muy aconsejable para terapias de largo plazo debido a su inmunogenia.
Una sola inyección intravenosa de un preparado de uricasa derivado de Candida utilis combinado con PEG de 5 kDa redujo el urato sérico a niveles indetectables en cinco sujetos humanos cuyo promedio de concentración de urato sérico antes de la inyección era de 6,2 mg/dL, lo cual está dentro del intervalo normal (Davis, et al., (1981). A los sujetos se les administró una inyección adicional cuatro semanas después, pero no se registraron sus respuestas. Utilizando un ensayo de difusión en gel relativamente no sensible, no se detectó ningún anticuerpo a la uricasa después de la segunda (última) inyección. Esta referencia no aportó resultados sobre tratamientos crónicos o subcrónicos en humanos o en animales utilizados con fines experimentales.
Un preparado de uricasa derivado de Arthrobacter protoformiae combinado con PEG de 5 kDa se utilizó para controlar por un tiempo la hiperuricemia en un solo paciente con linfoma cuya concentración de urato sérico antes de la inyección era de 15 mg/dL, Chua, et al., (1988). Debido al estado crítico del paciente y a la corta duración del tratamiento (cuatro inyecciones en un periodo de 14 días), no fue posible evaluar la eficacia o seguridad a largo plazo del conjugado.
En esta solicitud, el término «inmunogenia» se entiende como la inducción de una respuesta inmunológica mediante la inyección de un preparado de uricasa modificada con PEG o no modificada (el antígeno), en tanto que la «antigenia» se entiende como la reacción de un antígeno... [Seguir leyendo]
Reivindicaciones:
1. Un conjugado compuesto por una uricasa purificada conjugada a un poli(etilenglicol) (PEG), en la que al menos el 90% de dicha uricasa se halle en una forma tetramérica.
2. Un fármaco adecuado para rebajar los niveles de ácido úrico en líquidos o tejidos corporales, compuesto por el conjugado de la Reivindicación 1 y un transportador apropiado desde el punto de vista farmacéutico.
Patentes similares o relacionadas:
Procesamiento para recuperación y purificación de una fosfatasa alcalina, del 1 de Julio de 2020, de AM-PHARMA B.V.: Un método para producir una composición físicamente estable que comprende una fosfatasa alcalina (AP) aislada comprendiendo el método - la disolución o dilución […]
Composiciones enzimáticas líquidas estabilizadas, del 6 de Mayo de 2020, de NOVOZYMES A/S: Aldehído peptídico con la fórmula B2-B1-B0-H, donde: H es hidrógeno; B0 es un residuo de Tyr; B1 es un residuo de aminoácido de alanina, cisteína, glicina, […]
 Método para la mejora de la estabilidad de fitasa con ácido fítico, y composiciones que comprenden fitasa y ácido fítico, del 25 de Marzo de 2020, de DANISCO US INC: Método para aumentar la estabilidad de fitasa en una composición de gránulos, comprendiendo el método la introducción de al menos 10 milimolal de ácido fítico […]
Método para la mejora de la estabilidad de fitasa con ácido fítico, y composiciones que comprenden fitasa y ácido fítico, del 25 de Marzo de 2020, de DANISCO US INC: Método para aumentar la estabilidad de fitasa en una composición de gránulos, comprendiendo el método la introducción de al menos 10 milimolal de ácido fítico […]
Método para obtener una biomasa de una microalga de la especie Tetraselmis chuii enriquecida en superóxido dismutasa (SOD), del 1 de Enero de 2020, de Fitoplancton Marino S.L: Un método para obtener una biomasa de una microalga de la especie Tetraselmis chuii enriquecida en superóxido dismutasa (SOD) que comprende cultivar dicha […]
Edición genómica usando nickasas Cas9, del 25 de Diciembre de 2019, de The Broad Institute, Inc: Una composición que no es de origen natural o que está manipulada para su uso en tratamiento, por manipulación de una primera y segunda secuencia diana en hebras […]
Composiciones líquidas estables para lavado manual de vajilla que contienen enzimas, del 31 de Mayo de 2019, de Ecolab USA Inc: Una composición enzimática líquida estabilizada que comprende: un agente estabilizador de enzimas, en donde dicho agente es un tensioactivo anfótero; y una combinación […]
Agentes de lavado o detergentes líquidos con estabilidad mejorada de las enzimas, del 17 de Abril de 2019, de HENKEL AG & CO. KGAA: Agente de lavado o detergente líquido que contienen acetato de potasio y por lo menos una enzima, caracterizado porque la cantidad de iones potasio en la totalidad de la composición […]
Conjugados de Fc-histidil-ARNt sintetasa, del 10 de Abril de 2019, de Atyr Pharma, Inc: Un polipéptido de fusión histidil-ARNt sintetasa (HRS)-Fc, que comprende una secuencia de aminoácidos al menos un 98 % idéntica a la SEQ ID NO:337, donde el […]