COMPOSICIONES FARMACÉUTICAS FÁCILES DE TRAGAR, QUE NO PROVOCAN UNA SENSACIÓN DESAGRADABLE EN LA BOCA Y QUE COMPRENDEN PARTÍCULAS CON UN INGREDIENTE ACTIVO.
Una composición farmacéutica para la administración oral, que comprende al menos una partícula que contiene un ingrediente activo,
comprendiendo dicha al menos una partícula: a) un núcleo que contiene el ingrediente activo de la partícula y, opcionalmente, adyuvantes adecuados, y b) una o más capas de revestimiento aplicadas al núcleo, de forma que una única capa de revestimiento, cuando sólo está presente una capa de revestimiento, o la capa de revestimiento más externa, cuando está presente más de una capa de revestimiento, contiene: (i) al menos un polímero capaz de formar un gel con agua, (ii) al menos un polímero que no es capaz de formar un gel con agua, (iii) al menos un compuesto capaz de liberar dióxido de carbono, y (iv) opcionalmente, otros adyuvantes
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/007243.
Solicitante: LOSAN PHARMA GMBH.
Nacionalidad solicitante: Alemania.
Dirección: OTTO-HAHN-STRASSE 13 79395 NEUENBURG ALEMANIA.
Inventor/es: GRUBER, PETER, DR., KRAAHS,PETER.
Fecha de Publicación: .
Fecha Solicitud PCT: 16 de Agosto de 2007.
Fecha Concesión Europea: 13 de Octubre de 2010.
Clasificación Internacional de Patentes:
- A61K9/00M18B
- A61K9/50K
Clasificación PCT:
- A61K9/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/28 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Grageas; Píldoras o comprimidos con revestimientos.
- A61K9/50 A61K 9/00 […] › Microcápsulas (A61K 9/52 tiene prioridad).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
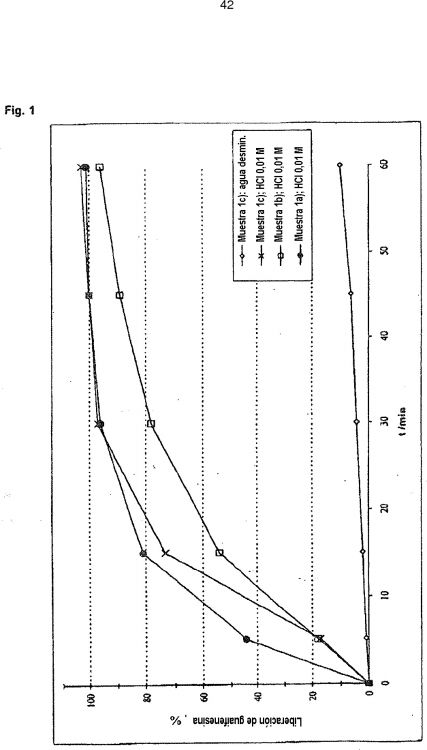
Fragmento de la descripción:
Campo de la invención
La presente invención se refiere a una composición farmacéutica para la administración oral directa que es muy fácil de tragar, en especial para niños pequeños, y que comprende al menos un compuesto farmacéuticamente activo. La composición farmacéutica está presente en forma de una o más partículas. Las partículas consisten en un núcleo que contiene el ingrediente activo al que se le ha proporcionado uno o más revestimientos. La composición farmacéutica se administra preferiblemente junto con un polvo y/o gránulos que, cuando se aplican a la lengua, generan saliva de modo espontáneo. En unos pocos segundos, las partículas revestidas forman una superficie blanda y lisa, pero mecánicamente estable, con la saliva, que se percibe como agradable en la boca de forma que pueden tragarse con facilidad y prácticamente en la cantidad adecuada. Antecedentes de la invención
La ingestión oral de formas de medicamentos sólidas (en especial comprimidos y cápsulas) presenta numerosos problemas para los niños y los ancianos. Los niños deben tener de 6 a 8 años para que puedan tragar sin peligro formas de medicamentos sólidas, existiendo limitaciones importantes para el tamaño de las formas de medicamentos. Los ancianos a menudo también padecen trastornos de deglución, que son provocados por una disminución en la formación de la saliva por la edad, de forma que las formas de medicamentos sólidas pueden tragarse pero con dificultad. Actúan con reticencia frente a la ingestión regular, que a menudo es necesario realizar a lo largo de muchos años, lo cual conduce con frecuencia a un cumplimiento irregular.
Para intentar solucionar estos problemas se han ofrecido numerosas alternativas en el mercado. Sin embargo, los comprimidos para masticar o chupar y los comprimidos orodispersables tampoco son una genuina alternativa, en especial para niños pequeños. Además, debido a problemas dentales, los ancianos a menudo tienen aversión a los comprimidos masticables, y los comprimidos para chupar o los comprimidos orodispersables tampoco les convencen debido a su menor salivación. Además, a menudo es necesaria una etapa cara y complicada para convertir primero los ingredientes activos, que a menudo tienen un sabor amargo, en partículas resistentes a la saliva antes de ser procesados para producir comprimidos masticables, comprimidos para chupar o comprimidos orodispersables, destruyéndose a menudo en mayor o menor medida el enmascaramiento del sabor por la posterior compresión necesaria para fabricar comprimidos, con el resultado de que el sabor amargo a menudo conduce a una aversión hacia esta forma de medicamento. El procesamiento de partículas con revestimiento entérico de liberación controlada o retardada para producir las anteriores formas de medicamentos es aún más problemática. De nuevo, la posterior compactación provoca la destrucción al menos parcial de la capa de revestimiento. Como resultado, los formuladores intentan proteger a las partículas resistentes a la saliva mediante una gran cantidad de adyuvantes, que pueden comprimirse con facilidad. Esto, a su vez, aumenta el coste de preparación de estos comprimidos y aumenta el tamaño del comprimido de una manera innecesaria.
Por tanto, en el mercado existen gránulos y polvos que normalmente deben convertirse en una suspensión con cierta cantidad de agua antes de la ingestión. En algunos casos, estas suspensiones requieren conservación, deben mantenerse en la nevera y, en general, acarrean altos costes de producción. A menudo se producen errores cuando se prepara la suspensión. Debido a la formación de espuma o a una agitación insuficiente antes de la aplicación pueden producirse errores de dosificación problemáticos y, en especial, los ancianos tienen problemas con esta forma de dosificación.
Con los niños pequeños o con los adultos con problemas de deglución, a menudo se elige un jarabe como alternativa. Sin embargo, en muchos casos se producen problemas porque el ingrediente activo es muy amargo. Los jarabes deben siempre protegerse con conservantes, que tienen un riesgo de alergia inherente. En muchos ingredientes activos se producen problemas de estabilidad cuando se procesan para producir un jarabe acuoso.
El documento US-A-4.882.169 propone gránulos revestidos con un diámetro de 0,2 a 3 mm que supuestamente forman una dispersión homogénea en agua. Las partículas contienen al menos una sustancia farmacéuticamente activa, opcionalmente uno o más revestimientos de liberación controlada o de enmascaramiento del sabor, y una capa externa hinchable. Esta última contiene un polímero hinchable, preferiblemente guar, y un ligante. Junto con los gránulos de guar y con agentes aromatizantes, los gránulos revestidos se envasan en sobres a partir de los cuales se extraen y se dispersan en agua.
El documento US-A-5.288.500 propone combinar una pluralidad de partículas que contienen el ingrediente activo que tienen un diámetro de 0,05 a 7 mm con un agente gelificante
o hinchable. Éste último puede estar presente mezclado con las partículas que contienen el ingrediente activo, puede estar contenido en el revestimiento, puede añadirse a las partículas que contienen el ingrediente activo antes de mezclar con un vehículo líquido, o puede dispersarse en un vehículo líquido en el que se mezclan las partículas que contienen el ingrediente activo. La formulación propuesta se dispersa en un vehículo acuoso. En particular, los polímeros hidrófilos que forman dispersiones coloidales, soles o suspensiones en un medio acuoso son indicados como agentes gelificantes o hinchables para las formulaciones propuestas en el documento USA-5.288.500. Los polímeros se emplean en una cantidad suficiente para asegurar que la dispersión en un vehículo acuoso no sea dificultosa. Si se desea, puede influirse en la viscosidad de la inmediata vecindad de las partículas dispersadas mediante la formación de una sal, quelación, cambios en la polaridad y similares. Los componentes de la formulación pueden mantenerse separados hasta que se procesen o pueden envasarse en sobres o procesarse en comprimidos o cápsulas.
Las formulaciones descritas en los documentos US-A-4.882.169 y US-A-5.288.500 se ingieren junto con un vehículo acuoso en el que deben estar dispersadas antes de la administración. En este proceso las formulaciones se desintegran en partículas individuales, de forma que, por regla general, no se garantiza una ingestión cuantitativa. Esto es debido a que, en general, beber una dispersión o suspensión de partículas es un verdadero problema, porque después de haber bebido la disolución, normalmente queda un residuo de las partículas en el fondo del recipiente y sólo puede llevarse a la boca con dificultad. Tampoco es seguro que el paciente lo vaya a hacer. La sedimentación de las partículas puede evitarse parcialmente únicamente bebiendo la suspensión de partículas con rapidez después de su agitación. Esta forma de medimento que requiere beber con rapidez resulta particularmente inadecuada para niños pequeños y pacientes ancianos.
Las formulaciones según las dos patentes citadas tienen la desventaja de que la ingestión cuantitativa en la dosis prescrita no se garantiza en general, y también que deben predispersarse primero en un vehículo líquido, es decir, agua para beber limpia, y debe estar disponible un recipiente adecuado que hace que la ingestión sea difícil, en especial si se está de viaje.
En el documento WO 98/06385 se describe un agente mejorado. La publicación impresa describe una composición farmacéutica en forma de partículas que puede ingerirse directamente incluso sin líquido. La composición farmacéutica es para la administración oral, y contiene una o más partículas de ingrediente activo revestidas que tienen un revestimiento que consiste en una
o más capas, caracterizándose la composición de revestimiento porque:
a) la capa de revestimiento o las capas de revestimiento contienen al menos un polímero hidratable que, tras ponerse en contacto con la saliva o con agua, forma un masa de partículas pegajosa, viscosa, modelable y continua, que evita que las partículas que contienen el ingrediente activo se escapen de esta masa y la liberación del ingrediente activo en la cavidad oral; y
b) la capa de revestimiento externo contiene una cantidad eficaz de al menos un agente que estimula la salivación.
Una desventaja de esa invención es que es difícil que los niños pequeños y los ancianos mantengan juntas las partículas vertidas sobre la lengua hasta...
Reivindicaciones:
1. Una composición farmacéutica para la administración oral, que comprende al menos una partícula que contiene un ingrediente activo, comprendiendo dicha al menos una partícula: a) un núcleo que contiene el ingrediente activo de la partícula y, opcionalmente, adyuvantes adecuados, y
b) una o más capas de revestimiento aplicadas al núcleo, de forma que una única capa de revestimiento, cuando sólo está presente una capa de revestimiento, o la capa de revestimiento más externa, cuando está presente más de una capa de revestimiento, contiene:
(i) al menos un polímero capaz de formar un gel con agua,
(ii) al menos un polímero que no es capaz de formar un gel con agua,
(iii) al menos un compuesto capaz de liberar dióxido de carbono, y
(iv) opcionalmente, otros adyuvantes.
2. La composición farmacéutica según la reivindicación 1, en la que el polímero capaz de formar un gel con agua indicado en b) (i) tiene una viscosidad de al menos 5000 mPa·s en una disolución o dispersión acuosa al 2% a un pH de 7,0, en la que la viscosidad se mide como se indica a continuación:
a) si la determinación de la viscosidad del polímero se describe en Ph. Eur., 5ª edición, trabajo clásico, 2005, la viscosidad del polímero se determina como se establece en ello, pero en una dispersión o disolución al 2% a un valor de pH de 7,0;
b) si a) anterior no es aplicable, la viscosidad se mide como se indica a continuación:
- una cantidad correspondiente a 2,00 g de la sustancia secada se suspende en 50 g de agua con agitación;
- la suspensión se diluye con agua y, para ajustar el valor de pH a 7,0, opcionalmente con NaOH o HCl hasta 100 g, y se agita hasta que la sustancia se dispersa o se disuelve completamente;
- la viscosidad se determina a 25 ºC con la ayuda de un viscosímetro de rotación y un gradiente de cizallamiento de 100 seg-1 para sustancias con una viscosidad esperada no mayor que 100 mPa·s, un gradiente de cizallamiento de 10 seg-1 para sustancias con una viscosidad esperada entre 100 y 20.000 mPa·s, y un gradiente de cizallamiento de 1 seg-1 para sustancias con una viscosidad esperada mayor que 20.000 mPa·s;
c) si la viscosidad no puede determinarse mediante b), se emplea el siguiente procedimiento:
- en un vaso de precipitado de 500 ml se añaden 6,0 g de la sustancia a 250 ml de una disolución de cloruro de potasio (12 g/l) con agitación en un agitador propulsor ligeramente inclinado que se hace funcionar a una velocidad de rotación de 800 rpm a lo largo de 45 a 90 seg y, si es necesario, se ajusta el valor de pH a 7,0 con NaOH o con HCl;
- cuando se añaden las sustancias no debe quedar ningún agregado;
- los residuos que se adhieren a las paredes del vaso de precipitado se enjuagan con más agua, de manera que se produce un peso de 300 g;
- la composición se agita a una temperatura de 25 ºC con una velocidad de rotación de 800 rpm durante 2 horas;
- la viscosidad entonces debe determinarse en 15 min, utilizando un viscosímetro rotacional que funcione a 60 rpm;
- este viscosímetro está equipado con un huso rotacional que tiene un diámetro de 12,7 mm y una altura de 1,6 mm;
- dicho huso rotacional está montado sobre un eje que tiene un diámetro de 3,2 mm;
- el espacio entre la parte superior del cilindro hasta la parte inferior del eje es de 25,4 mm, y la profundidad de inmersión es de 50,0 mm.
3. La composición farmacéutica según la reivindicación 1 ó 2, en la que el polímero que no es capaz de formar un gel con agua indicado en b) (ii) tiene una viscosidad no mayor que 50 mPa·s en una dispersión acuosa al 2% a un pH de 7,0, en la que la viscosidad se mide como en la reivindicación 2.
4. La composición farmacéutica según las reivindicaciones 1 a 3, en la que el polímero que no es capaz de formar un gel con agua indicado en b) (ii) es soluble en jugo gástrico.
5. La composición farmacéutica según una cualquiera de las reivindicaciones 1 a 4, en la que el polímero que no es capaz de formar un gel con agua indicado en b) (ii) es un copolímero de carácter catiónico basado en metacrilato de dimetilaminometilo y ésteres de ácido metacrílico neutros.
6. La composición farmacéutica según una cualquiera de las reivindicaciones 1 a 5, en la que el polímero capaz de formar un gel con agua indicado en b) (i) es un poli(ácido acrílico) reticulado o un poliacrilato reticulado.
7. La composición farmacéutica según una cualquiera de las reivindicaciones 1 a 6, en la que el polímero capaz de formar un gel con agua indicado en b) (i) es un carbómero.
8. La composición farmacéutica según una cualquiera de las reivindicaciones 1 a 7, en la que el compuesto capaz de liberar dióxido de carbono indicado en b) (iii) es (a) un compuesto de fórmula MHn(CO3), en la que M es un ion de metal alcalino o alcalinotérreo, y n = 0 ó 1, siendo n = 0 cuando M es un ion de metal alcalinotérreo, o b) glicincarbonato de sodio.
9. La composición farmacéutica según una cualquiera de las reivindicaciones 1 a 8, en la que al menos uno de los polímeros indicados en b) (i) y b) (ii) es un polímero ácido.
10. La composición farmacéutica según una cualquiera de las reivindicaciones 1 a 9, en
la que la única capa de revestimiento o la capa de revestimiento más externa contiene además un ácido.
11. La composición farmacéutica según la reivindicación 10, en la que el ácido se selecciona del grupo que consiste en ácido cítrico, ácido tartárico, ácido fumárico, ácido adípico, bicitrato de monosodio, tartrato de monosodio, fosfato de monosodio y sus mezclas.
12. La composición farmacéutica según una cualquiera de las reivindicaciones 1 a 11, en la que el ingrediente activo se selecciona del grupo que consiste en guaifenesina, dextrometorfano o sus sales farmacéuticamente aceptables, una mezcla de guaifenesina y dextrometorfano o sus sales farmacéuticamente aceptables, y una mezcla de guaifenesina y fenilefrina o sus sales farmacéuticamente aceptables.
13. La composición farmacéutica según una cualquiera de las reivindicaciones 1 a 12, en la que la proporción entre los polímeros indicados en b) (ii) y b) (i) varía de 10:1 a 1:5.
14. La composición farmacéutica según una cualquiera de las reivindicaciones 1 a 13, en la que la proporción entre el polímero indicado en b) (i) y el compuesto liberador de dióxido de carbono indicado en b) (iii) varía de 10:1 a 1:5.
15. Un medicamento que comprende una composición farmacéutica según una cualquiera de las reivindicaciones 1 a 14, y al menos un compuesto que estimula la salivacion que no sea un componente de la composición farmacéutica.
16. El medicamento según la reivindicación 15, en el que el compuesto que estimula la salivación se selecciona del grupo que consiste en sacarosa, glucosa, maltodextrina, sorbitol, manitol, xilitol, maltitol, malbitol, inulina, isomalta y sus mezclas.
17. El medicamento según la reivindicación 15 ó 16, en el que la composición farmacéutica según una cualquiera de las reivindicaciones 1 a 15 está presente mezclado con el compuesto que estimula la salivación.
18. Un envase de medicamento que comprende una composición farmacéutica según una cualquiera de las reivindicaciones 1 a 14, opcionalmente al menos un compuesto que estimula la salivación, y una instrucción para administrar la composición farmacéutica y el compuesto que estimula la salivación juntos.
19. El uso de una composición farmacéutica según una cualquiera de las reivindicaciones 1 a 14 para preparar un medicamento para la administración oral directa a la boca de un paciente, en el que el medicamento está adaptado para ser administrado sin poner en contacto primero el medicamento con un líquido.
20. El uso según la reivindicación 19, en el que la composición farmacéutica según una cualquiera de las reivindicaciones 1 a 14 está prevista para la administración simultánea con al menos un compuesto que estimula la salivación.
21. El uso de una composición farmacéutica según una cualquiera de las reivindicaciones 1 a 14 para preparar un medicamento en forma de una dispersión acuosa adecuada para beber.
Patentes similares o relacionadas:
COMPOSICIONES Y MÉTODOS PARA REDUCCIÓN DEL OXALATO, del 14 de Julio de 2011, de OXTHERA, INC: Una composición que comprende partículas que contienen una o más enzimas degradantes del oxalato incrustadas en un primer material polímero, en donde la enzima incrustada […]
 PRODUCTO PARA SUMINISTRO DE FÁRMACO Y MÉTODOS, del 1 de Abril de 2011, de UNIVERSITY OF MASSACHUSETTS: Sistema de suministro de partícula, caracterizado porque comprende una pared celular de levadura extraída que comprende menos del 90 por ciento en peso de beta-glucano […]
PRODUCTO PARA SUMINISTRO DE FÁRMACO Y MÉTODOS, del 1 de Abril de 2011, de UNIVERSITY OF MASSACHUSETTS: Sistema de suministro de partícula, caracterizado porque comprende una pared celular de levadura extraída que comprende menos del 90 por ciento en peso de beta-glucano […]
 RECUBRIMIENTOS TISULARES POLIMÉRICOS MULTIFUNCIONALES, del 7 de Marzo de 2011, de CALIFORNIA INSTITUTE OF TECHNOLOGY: Un implante o dispositivo médico que comprende una superficie no biológica destinada a ser colocada en contacto con un ambiente biológico, que comprende un recubrimiento superficial […]
RECUBRIMIENTOS TISULARES POLIMÉRICOS MULTIFUNCIONALES, del 7 de Marzo de 2011, de CALIFORNIA INSTITUTE OF TECHNOLOGY: Un implante o dispositivo médico que comprende una superficie no biológica destinada a ser colocada en contacto con un ambiente biológico, que comprende un recubrimiento superficial […]
PREPARACIONES GRANULARES PARA ADMINISTRACIÓN ORAL, del 20 de Enero de 2011, de MITSUBISHI TANABE PHARMA CORPORATION: Una preparación en forma de gránulos para administración oral que comprende un agente hinchable en la boca como componente activo, en la que la preparación tiene una capa de […]
 MICROCAPSULAS QUE TIENEN MULTIPLES CORTEZAS, Y METODO PARA SU PREPARACION, del 25 de Octubre de 2010, de OCEAN NUTRITION CANADA LIMITED: Una microcápsula de múltiples núcleos que comprende:
(a) una aglomeración de microcápsulas primarias, comprendiendo cada microcápsula primaria un núcleo y una primera […]
MICROCAPSULAS QUE TIENEN MULTIPLES CORTEZAS, Y METODO PARA SU PREPARACION, del 25 de Octubre de 2010, de OCEAN NUTRITION CANADA LIMITED: Una microcápsula de múltiples núcleos que comprende:
(a) una aglomeración de microcápsulas primarias, comprendiendo cada microcápsula primaria un núcleo y una primera […]
 COMPOSICION EN MICROPILDORAS CON LIBERACION CONTROLADA DE SUSTANCIAS FISIOLOGICAMENTE ACTIVAS, METODO PARA SU PREPARACION Y USO EN EL SECTOR ZOOTECNICO, del 29 de Septiembre de 2010, de VALENTINI S.R.L: Composición resistente al rumen en píldoras con liberación controlada de substancias fisiológicamente activas en la zona posruminal de rumiantes, […]
COMPOSICION EN MICROPILDORAS CON LIBERACION CONTROLADA DE SUSTANCIAS FISIOLOGICAMENTE ACTIVAS, METODO PARA SU PREPARACION Y USO EN EL SECTOR ZOOTECNICO, del 29 de Septiembre de 2010, de VALENTINI S.R.L: Composición resistente al rumen en píldoras con liberación controlada de substancias fisiológicamente activas en la zona posruminal de rumiantes, […]
 FORMA DE DOSIFICACION ORAL QUE COMPRENDE UN AGENTE TERAPEUTICO Y UN AGENTE DE EFECTO ADVERSO, del 28 de Abril de 2010, de EURO-CELTIQUE S.A.: Forma de dosificación oral que comprende una primera composición y una segunda composición, en la que la primera composición comprende una cantidad eficaz de un agente […]
FORMA DE DOSIFICACION ORAL QUE COMPRENDE UN AGENTE TERAPEUTICO Y UN AGENTE DE EFECTO ADVERSO, del 28 de Abril de 2010, de EURO-CELTIQUE S.A.: Forma de dosificación oral que comprende una primera composición y una segunda composición, en la que la primera composición comprende una cantidad eficaz de un agente […]
CÁPSULAS BLANDAS MASTICABLES QUE CONTIENEN ALMIDÓN NO GELATINIZADO, del 16 de Enero de 2012, de R.P. SCHERER TECHNOLOGIES, LLC: Una cápsula de gelatina terminada lista para empaque, que incluye una cubierta de cápsula formada de una película de cápsula; en donde la cubierta de cápsula […]