COMPOSICIÓN MEDICINAL ANTIBACTERIANA CON ABSORPTIVIDAD ORAL MEJORADA.
Composición farmacéutica que comprende cefditorén pivoxilo amorfo y un éster de ácido graso de sacarosa,
que puede obtenerse mezclando o granulando en húmedo partículas que contienen cefditorén pivoxilo amorfo con el éster de ácido graso de sacarosa mientras que el cefditorén pivoxilo amorfo mantiene su estado de partícula en la que dicha composición farmacéutica contiene de 0,1 a 5 mg del éster de ácido graso de sacarosa basándose en una cantidad equivalente a una potencia de 100 mg de cefditorén pivoxilo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2003/005461.
Solicitante: MEIJI SEIKA KAISHA, LTD..
Nacionalidad solicitante: Japón.
Dirección: 4-16, KYOBASHI 2-CHOME, CHUO-KU TOKYO 104-8002 JAPON.
Inventor/es: Yamaguchi,Hiroyuki, YOKOI,YUKIKO, CHIKASE,SHIGERU.
Fecha de Publicación: .
Fecha Solicitud PCT: 28 de Abril de 2003.
Fecha Concesión Europea: 29 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- A61K31/546 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo otros heterociclos, p. ej. cefalotina.
- A61K9/16H4B
- A61K9/20H4B
- A61K9/20H6F2
Clasificación PCT:
- A61K31/546 A61K 31/00 […] › conteniendo otros heterociclos, p. ej. cefalotina.
- A61K47/26 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Hidratos de carbono, p. ej. alcoholes de azúcares, amino azúcares, ácidos nucleicos, mono-, di- u oligo-sacáridos; Sus derivados, p. ej. polisorbatos, ésteres de ácidos grasos sorbitano o glicirricina.
- A61K47/38 A61K 47/00 […] › Celulosa; Sus derivados.
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
Clasificación antigua:
- A61K31/546 A61K 31/00 […] › conteniendo otros heterociclos, p. ej. cefalotina.
- A61K47/26 A61K 47/00 […] › Hidratos de carbono, p. ej. alcoholes de azúcares, amino azúcares, ácidos nucleicos, mono-, di- u oligo-sacáridos; Sus derivados, p. ej. polisorbatos, ésteres de ácidos grasos sorbitano o glicirricina.
- A61K47/38 A61K 47/00 […] › Celulosa; Sus derivados.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
- A61P31/04 A61P 31/00 […] › Agentes antibacterianos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358470_T3.pdf
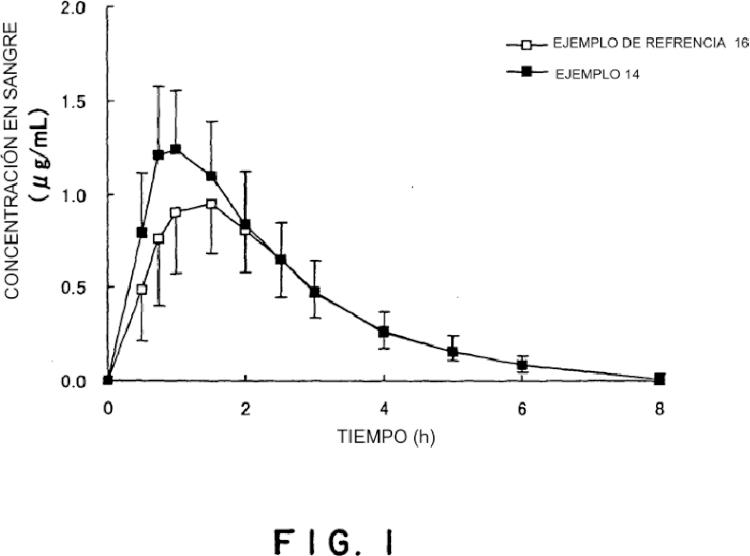
Fragmento de la descripción:
Composición medicinal antibacteriana con absorptividad oral mejorada. ANTECEDENTES DE LA INVENCIÓN Campo de la invención 5 La presente invención se refiere a composiciones farmacéuticas antibióticas con absorbabilidad oral mejorada, más específicamente a composiciones farmacéuticas antibióticas que comprenden cefditorén pivoxilo amorfo.
Técnica anterior 10 Un compuesto antibiótico de cefditorén es un compuesto cefem representado por la fórmula (A):
**(Ver fórmula)**
Su nombre químico es ácido (+)-(6R,7R)-7-[(Z)-2-(2-aminotiazol-4-il)-2-metoxiiminoacetamido]-3-[(Z)-2-(4
metiltiazol-5-il)etenil]-8-oxo-5-tia-1-azabiciclo[4.2.0]oct-2-en-2-carboxílico. Este compuesto se describe en la
publicación de patente japonesa nº 64503/1991 con el nombre químico de ácido 7-[2-metoxiimino-2-(2-aminotiazol-4il)acetamido]-3-[2-(4-metiltiazol-5-il)vinil]-3-cefem-4-carboxílico (isómero sin, isómero cis).
Un éster pivaloiloximetílico de cefditorén, en el que se esterifica un grupo ácido carboxílico en la posición 2 del compuesto cefem con un grupo pivaloiloximetilo con el fin de mejorar su absorbabilidad a través del tracto digestivo tras la administración oral (denominada en lo sucesivo en el presente documento como “absorbabilidad oral”), se denomina cefditorén pivoxilo. El compuesto profármaco se representa por la fórmula (B):
**(Ver fórmula)**
y su nombre químico es éster 2,2-dimetilpropioniloximetílico del ácido (-)-(6R,7R)-7-[(Z)-2-(2-aminotiazol-4-il)-2metoxiiminoacetamido]-3-[(Z)-2-(4-metiltiazol-5-il)etenil]-8-oxo-5-tia-1-azabiciclo[4.2.0]oct-2-en-2-carboxílico. Este compuesto de éster se considera generalmente que presenta alta absorbabilidad oral en comparación con el fármaco en forma de ácido original. Sin embargo, la esterificación del cefditorén no ha dado como resultado necesariamente la intensificación o la mejora de la absorbabilidad oral hasta un nivel satisfactorio.
Con el fin de mejorar la absorbabilidad oral del cefditorén pivoxilo, se ha propuesto una preparación farmacéutica en la que se añade ciclodextrina o hidroxipropilcelulosa que es un derivado de celulosa polimérico soluble en agua, a cefditorén pivoxilo (publicación de patente japonesa n.º 78234/1994 y publicación de patente japonesa abierta a consulta por el público n.º 17866/1995). Sin embargo, la adición de ciclodextrina a cefditorén pivoxilo intensificó extremadamente el amargor derivado del cefditorén pivoxilo y los comprimidos o gránulos farmacéuticos obtenidos con la adición de hidroxipropilcelulosa se volvieron voluminosos, lo que dificultó su administración oral.
Con el fin de resolver estos problemas, se ha propuesto recientemente una preparación farmacéutica en la que se añade caseinato soluble en agua a cefditorén pivoxilo (patente japonesa n.º 2831135). Sin embargo, esta preparación no puede administrarse a un paciente que padece de alergia a la leche dado que la caseína es una proteína derivada de la leche.
Por tanto, se ha necesitado una preparación farmacéutica en la que pueda administrarse de manera segura cefditorén pivoxilo a un paciente y en la que sea segura su absorbabilidad oral suficiente como para ejercer su efecto farmacéutico esperado.
Por otro lado, como un medio para mejorar la absorbabilidad oral de un fármaco escasamente soluble, en el documento WO 96/19239 se da a conocer una composición sólida que se obtiene transformando en amorfo el fármaco escasamente soluble en presencia de una base de polímero y un tensioactivo no iónico. Se da a conocer que la composición mencionada anteriormente mantiene su estado de amorfismo cuando se dispersa en un líquido y que la concentración máxima en la sangre (Cmax) y el área bajo la curva de la concentración en sangre (AUC) aumenta cuando se administra por vía oral a perros, es decir, puede mejorarse la absorbabilidad oral. Sin embargo, no se ha logrado el acortamiento del tiempo requerido para alcanzar la máxima concentración en sangre, que es un índice del efecto inmediato. Además, la composición sólida dada a conocer se caracteriza notablemente porque se mezclan el fármaco, la base de polímero y el tensioactivo no iónico en un estado molecular, concretamente en un estado de composición de dispersión sólida. Además, se produce una preparación farmacéutica de este tipo usando un método de secado por pulverización en el que ocasionalmente se usa un disolvente tal como diclorometano, lo que requiere una preocupación por el medio ambiente y una garantía para la seguridad.
Además, la patente japonesa nº 3290970 da a conocer, como un medio para mejorar la absorbabilidad oral de un fármaco escasamente soluble, una preparación farmacéutica sólida que contiene AINE escasamente solubles, una base de polímero soluble en agua y un tensioactivo no iónico, que se caracteriza porque los AINE escasamente solubles están en el estado cristalino.
Además, el documento WO 99/34832 da a conocer una composición que comprende una cefalosporina amorfa, cristalográficamente estable, y un procedimiento para la preparación de la misma, el cual indica que puede mejorarse la absorbabilidad oral transformando en amorfa la cefalosporina. La publicación de patente japonesa abierta a consulta por el público nº 131071/2001 da a conocer un procedimiento para la preparación de cefditorén pivoxilo amorfo, en el que puede mejorarse la absorbabilidad oral transformando en amorfo el cefditorén pivoxilo. Además, el documento WO 02/87588 da a conocer un procedimiento para producir una composición amorfa, en el que se mezcla un polímero orgánico con cristales de cefditorén pivoxilo y se muele la mezcla obtenida.
SUMARIO DE LA INVENCIÓN
Sin embargo, los presentes inventores confirmaron que una suspensión en la que los cristales de cefditorén pivoxilo estaban suficientemente suspendidos presentaba absorbabilidad oral extremadamente baja en perros en comparación con una suspensión amorfa. En otras palabras, se encontró que el procedimiento dado a conocer en la patente japonesa n.º 3290970 no era aplicable de manera práctica a cefditorén pivoxilo. Por otro lado, dado que el cefditorén pivoxilo amorfo es propenso a cambiar a un estado cristalino en una disolución, aún necesita mejorarse una composición farmacéutica antibiótica que comprende cefditorén pivoxilo amorfo.
Los presentes inventores han encontrado ahora que se inhibió la cristalización del cefditorén pivoxilo amorfo mezclando simplemente cefditorén pivoxilo amorfo con un éster de ácido graso de sacarosa. Los presentes inventores también confirmaron que una composición sólida que comprende una mezcla física de cefditorén pivoxilo amorfo y un éster de ácido graso de sacarosa era excelente en cuanto a su absorbabilidad y su efecto inmediato. Este hallazgo fue sorprendente porque, al formular fármacos transformados en amorfos en las preparaciones farmacéuticas, se sabía que una preparación farmacéutica obtenida mezclando simplemente los principios activos era insuficiente para su absorbabilidad y efecto inmediato en comparación con un compuesto de dispersión sólido o un complejo soluble con ciclodextrina o similares.
Por tanto, un objetivo de la presente invención es proporcionar una preparación farmacéutica de cefditorén pivoxilo que pueda administrase de manera segura a un paciente y que no sólo mejore la humectabilidad del cefditorén pivoxilo, sino que también mejore adicionalmente la absorbabilidad a través de los tractos intestinales manteniendo las partículas amorfas que tienen alta absorbabilidad oral en un líquido durante un largo periodo de tiempo.
Según la presente invención, se proporciona una composición farmacéutica que comprende cefditorén pivoxilo amorfo y un éster de ácido graso de sacarosa, que puede obtenerse mezclando o granulando en húmedo partículas que contienen cefditorén pivoxilo amorfo con el éster de ácido graso de sacarosa mientras que el cefditorén pivoxilo amorfo mantiene sus estado de partícula.
La composición farmacéutica según la presente invención es ventajosa porque puede mantenerse el estado amorfo del cefditorén pivoxilo amorfo durante un largo periodo de tiempo y porque la absorbabilidad oral y el efecto inmediato de cefditorén pivoxilo son excelentes. Además, se espera que la composición farmacéutica según la presente invención tenga alta dispersibilidad y capacidad de elución en una disolución acuosa debido a su excelente humectabilidad. La composición... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéutica que comprende cefditorén pivoxilo amorfo y un éster de ácido graso de sacarosa, que puede obtenerse mezclando o granulando en húmedo partículas que contienen cefditorén pivoxilo amorfo con el éster de ácido graso de sacarosa mientras que el cefditorén pivoxilo amorfo mantiene su estado de partícula en la que dicha composición farmacéutica contiene de 0,1 a 5 mg del éster de ácido
5 graso de sacarosa basándose en una cantidad equivalente a una potencia de 100 mg de cefditorén pivoxilo.
2. Composición farmacéutica según la reivindicación 1, que comprende además un polímero farmacéuticamente aceptable.
3. Composición farmacéutica según la reivindicación 2, en la que el polímero es uno o más polímeros
superiores solubles en agua seleccionados de hidroxipropilmetilcelulosa, metilcelulosa, hidroxietilcelulosa, 10 polivinilpirrolidona e hidroxipropilcelulosa.
4. Composición farmacéutica según la reivindicación 2 ó 3, que contiene de 1 a 100 mg del polímero basándose en una cantidad equivalente a una potencia 100 mg de cefditorén pivoxilo.
5. Composición farmacéutica según una cualquiera de las reivindicaciones 1 a 3, que comprende además uno
o más aditivos farmacéuticamente aceptables.
Patentes similares o relacionadas:
Compuestos para el tratamiento de enfermedades asociadas a clostridium difficile, del 15 de Abril de 2020, de Summit (Oxford) Limited: Un compuesto de la Fórmula (I): **(Ver fórmula)** en donde: R1 es: (a) un grupo piridilo; o (b) un grupo tiazol; R2 es un sistema de anillo aromático […]
Uso de glutaril histamina para tratar infecciones de las vías respiratorias, del 15 de Abril de 2020, de Ltd. "Valenta-Intellekt": Un medicamento o una composición farmacéutica para su uso en el tratamiento de una enfermedad de las vías respiratorias seleccionada del grupo que […]
Tratamiento de infecciones con ceftolozano/tazobactam en sujetos con insuficiencia renal, del 8 de Abril de 2020, de MERCK SHARP & DOHME CORP: Ceftolozano y tazobactam para su uso en un método de tratamiento de una infección intraabdominal complicada o una infección del tracto urinario complicada en un […]
Procedimiento de administración de un antibiótico inyectable en la oreja de un animal, del 11 de Diciembre de 2019, de Zoetis Services LLC: Uso de un antibiótico para la fabricación de un medicamento para uso en el tratamiento o la prevención de una infección bacteriana en un animal mediante la inyección del medicamento […]
Inhibidores de betalactamasa, del 7 de Noviembre de 2019, de Venatorx Pharmaceuticals Inc: Un compuesto de Fórmula (I) o Fórmula (Ia), una sal farmacéuticamente aceptable, polimorfo, solvato, N-óxido, estereoisómero, dímero, o trímero del mismo:**Fórmula** […]
Composiciones de cefepima orales y uso de las mismas, del 18 de Octubre de 2019, de Seachaid Pharmaceuticals, Inc: Una composición farmacéutica en forma de dosificación oral que comprende cefepima, o una sal farmacéuticamente aceptable de la misma, y un aditivo que comprende una acil carnitina […]
Composición de emulsión antipsoriásica que se compone de cefazolina, del 4 de Septiembre de 2019, de Warszawski Uniwersytet Medyczny: Una composición de emulsión antipsoriática que se compone de una dosis terapéutica eficaz de cefazolina, de los ingredientes de 5 (i) la fase oleosa y de los ingredientes […]
Composiciones y métodos para usar cuerpos laminares para propósitos terapéuticos, del 21 de Agosto de 2019, de LAMELLAR BIOMEDICAL LIMITED: Una composición que comprende una cantidad terapéuticamente eficaz de cuerpos laminares capazde interrumpir la percepción de quórum microbiano y la formación […]