SINTESIS DE ESTETROL A TRAVES DE ESTEROIDES DERIVADOS DE ESTRONA.
Proceso para la preparación de estra-1,3,5(10)-trien-3,15a,16a.17ß-tetraol (1) el cual comprende las fases de:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NL2003/000782.
Solicitante: PANTARHEI BIOSCIENCE B.V..
Nacionalidad solicitante: Países Bajos.
Dirección: P.O. BOX 464,3700 AL ZEIST.
Inventor/es: KOCH, THOMAS, VERHAAR,MARK,THEODOOR, WARMERDAM,ERWIN,GERARDUS,JACOBUS.
Fecha de Publicación: .
Fecha Concesión Europea: 26 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C07J1/00C4
Clasificación PCT:
- C07J1/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, androstano.
Clasificación antigua:
- C07J1/00 C07J […] › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, androstano.
Fragmento de la descripción:
Síntesis de estetrol a través de esteroides derivados de estrona.
Campo técnico de la invención
La presente invención se refiere a la síntesis de esteroides derivados vía estrona de estetrol [estra-1,3,5(10)-trien-3,15a,16a,17ß-tetraol; CAS Nr. 15183-37-6; por conveniencia, este compuesto se refiere en esta solicitud de patente como "estetrol"], preferiblemente a la síntesis de estetrol la cual se obtiene con un elevado rendimiento y una alta pureza.
Antecedentes de la invención
Comúnmente se usan sustancias estrogénicas en métodos de Terapia de Sustitución Hormonal (HRT) y métodos de anticoncepción femenina. Estas sustancias estrogénicas se pueden dividir en estrógenos naturales y estrógenos sintéticos. Ejemplos de estrógenos naturales que han encontrado aplicación farmacéutica incluyen estradiol, estrona, estriolo y estrógenos equinos conjugados. Ejemplos de estrógenos sintéticos, los cuales ofrecen la ventaja de una alta biodisponibilidad oral incluyen etinilestradiol y mestranol.
Recientemente, el estetrol se ha observado como eficaz en forma de una sustancia estrogénica para el uso en la HRT, descripción de la cual se da en la solicitud divisionaria del solicitante WO 02/094276. El estetrol es un estrógeno biogénico el cual se produce endógenamente por el hígado fetal durante el embarazo humano. Otras aplicaciones importantes del estetrol se encuentran en los campos de la anticoncepción, la terapia de enfermedades auto-inmunológicas, la prevención y la terapia de tumores de mama y de colon, la estimulación de la libido, los cuidados de la piel, y la curación de heridas como se describe en las solicitudes de patentes del solicitante en tramitación junto con la presente WO 02/094276, WO 02/094279, WO 02/094278, WO 02/094275, EP 1511496 A1, EP 1511498 A1, WO 03/041718, WO 03/018026, EP 1526856 A1 y WO 04/0278032.
La síntesis de estetrol y derivados del mismo en una base de escala de laboratorio se conoce en la técnica: Fishman J., Guzik H., J. Org. Chem. 33, 3133-3135 (1968); Nambara T. et al., Steroids 27, 111-121 (1976); o Suzuki E. et al., Steroids 60, 277-284(1995).
Fishman J., Guzik H., J. Org. Chem. 33, 3133-3135 (1968) expone una síntesis exitosa de estetrol a partir de un derivado de estrona (compuesto (III); cf. para una síntesis de compuesto (III) Cantrall, E.W., Littell, R., Bernstein, S. J. Org. Chem 29, 214-217 (1964)). En una primera fase, el grupo carbonilo en el CI7 del compuesto (III) se redujo con LiAlH4 a estra-1,3,5(10),15-tetraeno-3,17-diol (compuesto VIa) el cual se aisló como el diacetato (compuesto VIb). El compuesto VIb se sometió a una cis-hidroxilación del enlace doble del anillo D usando OsO4 lo cual resultó en la formación de estra-1,3,5(10)-trieno-3,15a,16a,17ß-tetraol-3,17-diacetato (compuesto Ib) que bajo calentamiento con K2CO3 en metanol produce estetrol (Esquema 1).
(Esquema pasa a página siguiente)
Esquema 1
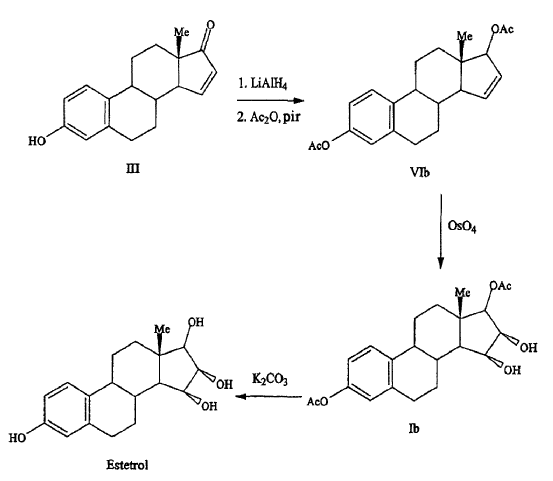
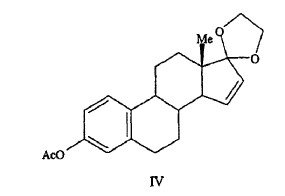
El rendimiento global de este proceso de tres etapas, empezando por derivado de estrona III, es sólo de aproximadamente el 7%. Debería tenerse en cuenta que el derivado protegido 17,17-etilenodioxiestra-1,3,5(10),15-tetraeno-3-ol-3-acetato (compuesto IV) se podría cis-hidroxilar a su derivado de 15a.16a-diol (compuesto Va), pero que después el grupo dioxolano podría no eliminarse (ácido sulfónico de p-tolueno en acetona a temperatura ambiente) o que la hidrólisis (ácido sulfúrico acuoso en dioxano a temperatura templada) del grupo dioxolano que resulta en una mezcla conteniendo una multitud de productos (Esquema 2).
Esquema 2
Nambara T. et al., Steroids 27, 111-121 (1976) expone otra síntesis de estetrol donde la estrona es la materia prima. El grupo carbonilo de estrona se protege antes mediante un tratamiento con etilenglicol e hidrocloruro de piridina seguido de la acetilación del grupo hidroxi en C3. La siguiente secuencia de etapas implicó una brominación/dehidrobrominación catalizada de base resultando en la formación de 17,17-etilenodioxiestra-1,3,5(10),15-tetraeno-3-ol (compuesto IVa). Este compuesto IVa se acetiló posteriormente lo cual produjo 17,17-etilenodioxiestra-1,3,5(10), 15-tetraen-3-ol-3-acetato (compuesto IVb). En una siguiente etapa, el grupo de dioxolano de compuesto IVb se hidrolizó usando ácido sulfónico de p-tolueno a compuesto Vb, seguido posteriormente de la reducción del grupo carbonílico en C17 (compuesto Ve) y la oxidación del enlace doble del anillo D formando de ese modo estra-1,3,5(10)-trieno-3,15a,16a,17ß-tetraol-3,17-diacetato (compuesto VIb). Véase el Esquema 3.
Suzuki E. et al., Steroids 60, 277-284 (1995) también expone la síntesis de estetrol usando compuesto Vb de Nambara T. et al. como materia prima. El grupo carbonilo en C17 de este compuesto se redujo en primer lugar y después se sometió a una acetilación produciendo estra-1,3,5(10),15-tetraeno-3,17-diol-3,17-diacetato (compuesto 2b). Éste se sometió a oxidación con OsO4 lo cual proporcionó estra-1,3,5(10)-trieno-3,15a,16a,17ß-tetraol-3,17-diacetato (compuesto 3b) en un rendimiento del 46%.
Esquema 3
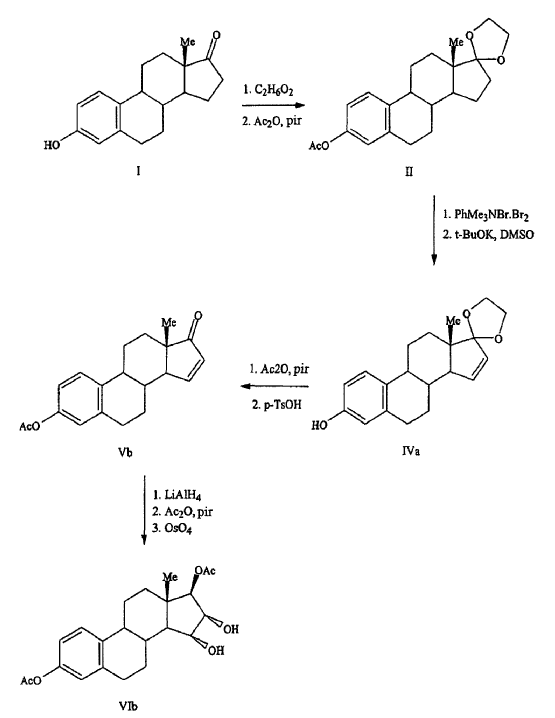
Según Nambara T. et al. y Suzuki E. et al., la síntesis de estetrol se puede realizar con un rendimiento de aproximadamente el 8%, empezando a partir de estrona.
Poirier D., et al., Tethraedron 47, 7751-7766 (1991) expone los siguiente compuestos los cuales se prepararon según métodos que se han usado para preparar compuestos similares:

Dionne, P. et al., Steriods 62, 674-681 (1997) expone el compuesto mostrado arriba donde R es o bien metilo o bien t-butildimetilsililo.
Magnus, P. et al., J. Am. Chem. Soc. 120, 12486-12499 (1998) expone que los métodos principales para la síntesis de cetonas a,ß-insaturadas a partir de cetonas saturadas son (a) halogenación seguida de dehidrohalogenación, (b) utilizar derivados de azufre o de selenio, (c) DDQ y (d) utilizar complejos de paladio(II).
Además, también se ha descubierto que siguiendo los métodos de la técnica anterior mencionados arriba, se obtuvo estetrol de alta pureza sólo en un bajo rendimiento al usar un grupo acetilo como un grupo protector para el grupo de 3-hidroxi de estra-1,3,5(10),15-tetraen-3-ol-17-ona, en particular debido a su sensibilidad a la hidrólisis y a la solvolisis. En particular, la labilidad del grupo acetilo dio como resultado no sólo una formación aumentada de subproductos durante las reacciones, sino también durante la cromatografía y la cristalización para la purificación de productos intermedios cuando se han usado solventes próticos tales como metanol. En consecuencia, es difícil aislar estetrol purificado y productos intermedios del mismo con un buen rendimiento.
Adicionalmente, la reducción del grupo carbonilo en C17 con LiAlH4 procede con una selectividad baja ya que también se obtienen diferentes cantidades de ß-estradiol (estra-1,3,5(10)-trien-3,17ß-diol). Obviamente, la formación de tal subproducto reduce el rendimiento al igual que la pureza del producto deseado el cual requiere fases de purificación adicionales.
Los métodos de la técnica anterior también emplean cantidades estequiométricas de OsO4 en la etapa de oxidación que se conoce por ser un compuesto tóxico y caro. En consecuencia, el uso de tal reactivo es indeseado en vista de la seguridad y los costes operacionales.
Por consiguiente, es un objetivo de la presente invención proporcionar una vía de síntesis para el estetrol por la cual se obtengan rendimientos altos y purezas altas del estetrol.
No obstante, por consiguiente, existe una necesidad de una síntesis de estetrol donde la producción de subproductos es limitada, es decir preferiblemente menor que su nivel de detección.
Es un objetivo preferido de la invención proporcionar una síntesis de estetrol donde se obtengan un rendimiento bueno y una pureza buena de estetrol.
Por...
Reivindicaciones:
1. Proceso para la preparación de estra-1,3,5(10)-trien-3,15a,16a.17ß-tetraol (1) el cual comprende las fases de:
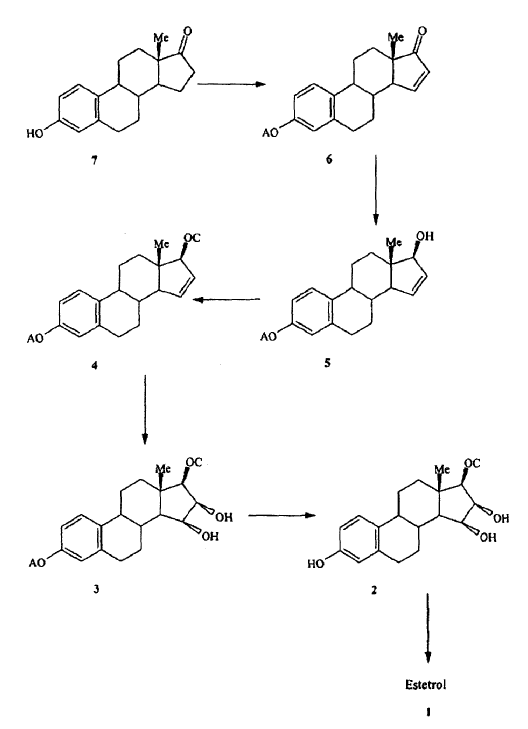
donde el grupo protector A se selecciona de un grupo alquilo en C1-C5 o un grupo bencílico en C7-C12 y el grupo protector C se selecciona de entre grupos protectores de hidróxilo monofuncionales alifáticos.
2. Proceso según la reivindicación 1, donde el grupo protector es un grupo bencílico en C7-C12.
3. Proceso según la reivindicación 2, donde el grupo protector es un grupo bencilo.
4. Proceso según cualquiera de las reivindicaciones 1-3, donde el grupo protector C se selecciona de entre grupos protectores de hidróxilo monofuncionales alifáticos.
5. Proceso según la reivindicación 4, donde el grupo protector de hidróxilo monofuncional alifático es acetilo.
6. Proceso según cualquiera de las reivindicaciones 1-5, donde la reducción del grupo carbonilo se realiza usando un agente reductor seleccionado del grupo de compuestos de hidruro de metal.
7. Proceso según la reivindicación 6, donde el compuesto de hidruro de metal se selecciona del grupo que consiste en LiAlH4, NaBH4, NaBH(OAc3, ZnBH4, y NaBH4 /CeCl3.
8. Proceso según la reivindicación 7, donde el compuesto de hidruro de metal es NaBH4 en combinación con hidrato de CeCl3.
9. Proceso según cualquiera de las reivindicaciones 1-8, donde la oxidación del enlace doble carbono-carbono en el anillo D se realiza con un agente oxidante comprendiendo tetróxido de osmio.
10. Proceso según la reivindicación 9, donde el agente oxidante es tetróxido de osmio inmovilizado sobre PVP (OsO4-PVP).
11. Proceso según cualquiera de las reivindicaciones precedentes 1-10, donde la oxidación del enlace doble carbono-carbono en el anillo D se realiza con una cantidad catalítica de (OsO4-PVP).
12. Proceso según cualquiera de las reivindicaciones 9-11, donde se usa OsO4-PVP en combinación con un cooxidante.
13. Proceso según la reivindicación 12, donde el cooxidante se selecciona del grupo que consiste en trimetilamina-N-óxido, N-metil morfolina-N-óxido o peróxido de hidrógeno.
14. Proceso según la reivindicación 13, donde el cooxidante es trimetilamina-N-óxido.
15. Proceso según cualquiera de las reivindicaciones 1 a 14, donde el grupo bencílico protector en C7-C12 se elimina por condiciones de hidrogenación catalíticas.
16. Proceso según la reivindicación 15, donde las condiciones de hidrogenación catalíticas comprenden una reacción de hidrogenación usando Pd sobre carbón activado bajo una atmósfera de hidrógeno.
17. Proceso según cualquiera de las reivindicaciones 1-16, donde el grupo alquilo protector C1-C5 se elimina usando BBr3.
18. Uso del producto obtenido por el proceso de cualquiera de las reivindicaciones 1-17 para la fabricación de una composición farmacéutica, preferiblemente para su uso en un método seleccionado de entre un método de terapia de sustitución hormonal, un método para tratar la sequedad vaginal, un método de anticoncepción, un método para aumentar la libido, un método para tratar la piel, un método para estimular la curación de heridas, y un método para tratar o prevenir un trastorno seleccionado del grupo que consiste en enfermedades autoinmunológicas, tumores de mama y tumores colorrectales.
19. Un método cosmético para tratar la piel, donde el método comprende la administración tópica del producto obtenido por el proceso de cualquiera de las reivindicaciones 1-17.
20. Compuesto según la fórmula 3,
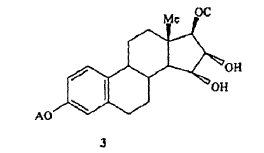
donde A se selecciona de un grupo alquilo en C1-C5 o un grupo bencílico en C7-C12 y C se selecciona de entre grupos protectores de hidróxilo monofuncionales alifáticos.
21. Un compuesto según la fórmula 2,
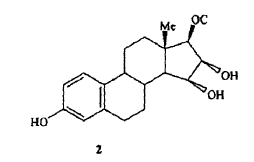
donde C se selecciona de entre grupos protectores de hidróxilo monofuncionales alifáticos.
Patentes similares o relacionadas:
Derivados de 4-pregenen-11â-17-21-triol-3,20-diona para el tratamiento de estados oculares, del 22 de Abril de 2020, de ALLERGAN, INC.: Compuesto que tiene la fórmula I, sus enantiómeros, diastereoisómeros, hidratos, solvatos, tautómeros o una sal farmacéuticamente aceptable del mismo, **(Ver […]
USO DE COMPUESTOS METAL-ORGÁNICOS PARA LA REDUCCIÓN SELECTIVA DE CETOSTEROIDES, del 8 de Octubre de 2019, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Uso de compuestos metal-orgánicos para la reducción selectiva de cetosteroides. Se describe el uso de compuestos híbridos Metal-Orgánicos (MOFs, […]
Compuestos anfifílicos con propiedades neuroprotectoras, del 2 de Octubre de 2019, de Ustav Organicke Chemie a Biochemie AV CR, v.v.i: Compuesto anfifílico, seleccionado de: 3-sulfato de piridinio(3R,5R,8S,9S,10 S,13S,14S)-10,13-dimetilhexadecahidro-1H-ciclopenta[a]fenantren-3- […]
Uso de un estrógeno en la fabricación de una composición que contiene estrógeno para el tratamiento de la vaginitis atrófica, del 27 de Septiembre de 2019, de NOVO NORDISK HEALTH CARE AG: Uso de un estrogeno en la preparacion de una composicion que contiene estrogeno para el tratamiento de la vaginitis atrofica en mujeres, donde se administra de aproximadamente […]
Procedimiento para la preparación de acetato de abiraterona y sus productos intermedios, del 24 de Julio de 2019, de OLON S.p.A: Procedimiento para la preparación de abiraterona o acetato de abiraterona **Fórmula** que comprende las siguientes etapas: a) conversión de trifluoroacetato […]
Medicamentos y usos, del 24 de Abril de 2019, de NeurMedix, Inc: Compuesto para usar en la profilaxis o el tratamiento de una enfermedad o afeccion metabolica, una afeccion de perdida osea o dolor, en el que el […]
Esteroides C21-n-pirazolilo 19-nor C3,3-disustituidos y métodos de uso de los mismos, del 16 de Abril de 2019, de Sage Therapeutics, Inc: Un compuesto de fórmula (I):**Fórmula** o una sal farmacéuticamente aceptable del mismo; donde: ----- representa un enlace simple o doble; R1 es alquilo […]
Procedimiento de preparación de abiraterona e intermedios de la misma, del 26 de Marzo de 2019, de SCINOPHARM TAIWAN, LTD.: Un procedimiento de preparación de abiraterona de fórmula (I):**Fórmula** que comprende: (a) convertir un compuesto de fórmula (II)**Fórmula** […]