SISTEMA DE ADMINISTRACION DE MEDICAMENTO COMPRENDIENDO UN ESTROGENO TETRAHIDROXILADO PARA EL USO EN LA ANTICONCEPCION HORMONAL.
Uso de un componente estrogénico seleccionado a partir del grupo que consiste en: sustancias representadas por la fórmula siguiente
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NL02/00330.
Solicitante: PANTARHEI BIOSCIENCE B.V..
Nacionalidad solicitante: Países Bajos.
Dirección: P.O. BOX 464,3700 AL ZEIST.
Inventor/es: COELINGH BENNINK, HERMAN, JAN, TIJMEN, BUNSCHOTEN, EVERT, JOHANNES, HOLINKA, CHRISTIAN, FRANZ.
Fecha de Publicación: .
Fecha Concesión Europea: 25 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K31/56 A61K […] › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos que contienen el sistema cíclico del ciclopenta[a]hidrofenantreno; Sus derivados, p. ej. esteroides.
- A61K31/565 A61K 31/00 […] › no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, estradiol.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K9/00M8
Clasificación PCT:
- A61K31/567 A61K 31/00 […] › sustituidos en posición 17 alfa, p. ej. mestranol, noretandrolona.
- A61K31/57 A61K 31/00 […] › sustituidos en posición 17 beta por una cadena con dos átomos de carbono, p. ej. pregnano, progesterona.
- A61P15/18 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 15/00 Medicamentos para el tratamiento de trastornos genitales o sexuales (para trastornos de las hormonas sexuales A61P 5/24 ); Anticonceptivos. › Anticonceptivos femeninos.
Clasificación antigua:
- A61K31/567 A61K 31/00 […] › sustituidos en posición 17 alfa, p. ej. mestranol, noretandrolona.
- A61K31/57 A61K 31/00 […] › sustituidos en posición 17 beta por una cadena con dos átomos de carbono, p. ej. pregnano, progesterona.
- A61P15/18 A61P 15/00 […] › Anticonceptivos femeninos.
Fragmento de la descripción:
Sistema de administración de medicamento comprendiendo un estrógeno tetrahidroxilado para el uso en la anticoncepción hormonal.
Campo técnico de la invención
La presente invención se refiere a un método anticonceptivo hormonal en mamíferos hembra. Más particularmente la invención se refiere a un método anticonceptivo hormonal que comprende la administración parenteral o rectal de una combinación de un componente estrogénico y un componente progestogénico a una hembra con capacidad reproductiva en una cantidad eficaz para inhibir la ovulación.
La invención también comprende un kit farmacéutico que comprende el componente estrogénico mencionado y un componente progestogénico.
Antecedentes de la invención
Los estrógenos juegan un papel importante mayor en los métodos anticonceptivos hormonales existentes. En el caso de los estrógenos anticonceptivos, estos se usan comúnmente junto con un progestógeno, p. ej. levonorgestrel, desogestrel, noretisterona, acetato de ciproterona, dienogest. Los estrógenos se necesitan para inhibir la maduración del folículo y la ovulación, pero además estos sustituyen la secreción endógena ovárica de estradiol la cual se suprime en una mayor extensión administrando un anticonceptivo hormonal. Esta sustitución es importante para prevenir la deficiencia de estrógenos y para mantener un ciclo menstrual artificial y otras funciones genitales.
Los estrógenos endógenos y exógenos cumplen funciones nerviosas y metabólicas centrales importantes en el organismo de las hembras: niveles de estrógenos normales contribuyen de forma decisiva a un bienestar de la mujer. Pese al uso difundido de estrógenos en anticonceptivos hormonales, todavía hay algunos problemas irresolutos. Los estrógenos conocidos, en particular los estrógenos biogénicos (es decir, los estrógenos que se producen naturalmente en el cuerpo humano), se eliminan del flujo sanguíneo rápidamente. Por ejemplo, para el estrógeno biogénico humano principal 17ß-estradiol la vida media es de aproximadamente 1 hora. Como resultado, entre diferentes casos de administración separada, los niveles de suero sanguíneo de estrógenos biogénicos de este tipo tienden a fluctuar considerablemente. De este modo, poco después de la administración la concentración del suero es normalmente varias veces superior a la concentración óptima. Además, si la siguiente toma se retrasa, las concentraciones de suero descenderán rápidamente hasta un nivel donde el estrógeno ya no es fisiológicamente activo. Esto es particularmente indeseable en métodos anticonceptivos.
El esferoide estrogénico alterado sintéticamente más importante es el 17a-ethinyl estradiol (EE). Este estrógeno es dominante en la anticoncepción hormonal oral. Además de EE, se ha usado mestranol en algunos casos; el mestranol es un "profármaco" que metaboliza a EE en el organismo. El hígado es un órgano objetivo para los estrógenos. La actividad de secreción que queda afectada por los estrógenos en el hígado humano incluye la síntesis aumentada de las proteínas de transporte CBG, SHBG, TBG, varios factores importantes para la fisiología de la coagulación de la sangre, y lipoproteínas. La estrogenicidad hepática fuerte de etinilestradiol y dietilstilbestrol (DES), especialmente sus efectos en factores de la hemostasis, pueden explicar por qué estos estrógenos sintéticos se han asociado al riesgo aumentado de una tromboembolia. Otros efectos secundarios indeseables que se han registrado en relación al uso de estrógenos sintéticos incluyen retención de líquidos, náuseas, hinchamiento, colelitiasis, dolor de cabeza y dolor de mamas.
Los déficits mencionados anteriormente tienen una importancia clínica considerable cuando se emplean estrógenos biogénicos o sintéticos comúnmente conocidos. Consecuentemente, existe una necesidad todavía no cubierta de estrógenos que no expongan estos déficits y que puedan emplearse adecuadamente en métodos anticonceptivos para mujeres debido a su capacidad para (a) suprimir de forma fiable la maduración del folículo y la ovulación y para (b) sustituir eficazmente la secreción endógena ovárica del 17-ßestradiol.
Resumen de la invención
Los inventores han descubierto sorprendentemente que estos objetivos se consiguen mediante sustancias estrogénicas representadas por la siguiente fórmula
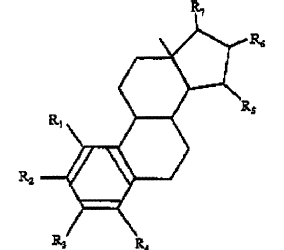
en cuya fórmula R1, R2, R3, R4 son independientemente un átomo de hidrógeno, un grupo hidróxilo o un grupo alcoxi con 1-5 átomos de carbono; cada R5, R6, R7 es un grupo hidróxilo; y no más de 3 de R1, R2, R3, R4 son átomos de hidrógeno.
Un representante conocido de este grupo de sustancias estrogénicas es 1,3,5 (10)-estratrien-3, 15a, 16a, 17ß-tetrol, también conocido por los nombres de estetrol, oestetrol y 15a-hidroxiestriol. El estetrol es un estrógeno producido por el hígado fetal durante el embarazo humano. Los niveles de estetrol no conjugado en el punto máximo del plasma materno a aproximadamente 1.2 ng/ml en el tiempo de embarazo y son aproximadamente 12 veces más altos en el plasma fetal que en el plasma materno (Tulchinski et al., 1975. J. Clin. Endocrinol. Metab., 40: 560-567).
En 1970, Fishman et al., "Fate of 15a-hydroxyestriol-3H in Adult Man" J Clin Endocrinol Metab (1970) 31: 436-438, proporcionó los resultados de un estudio donde se administró tritio marcado como 15a-hydroxyestriol (estetrol) por vía intravenosa a dos mujeres adultas. Se descubrió que el estetrol se excretaba rápidamente por completo en la orina como el glucosiduronato y que prácticamente no se producía ningún metabolismo salvo durante la copulación.
Entre 1975 y 1985 diferentes investigadores han investigado las propiedades del estetrol y han informado de su potencia estrogénica y su actividad uterotrófica. Las publicaciones más pertinentes que se hicieron durante este periodo se mencionan abajo:
Reivindicaciones:
1. Uso de un componente estrogénico seleccionado a partir del grupo que consiste en: sustancias representadas por la fórmula siguiente
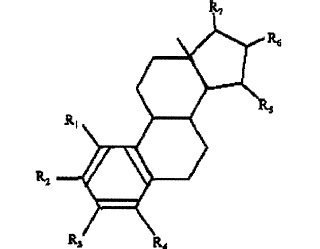
en cuya fórmula R1, R2, R3, R4 son independientemente un átomo de hidrógeno, un grupo hidróxilo o un grupo alcoxi con 1-5 átomos de carbono; cada uno de R5, R6, R7 es un grupo hidróxilo; y no más de 3 de R1, R2, R3, R4 son átomos de hidrógeno;
los precursores capaces de liberar una sustancia según la fórmula mencionada anteriormente cuando se usa en el método presente, cuyos precursores se derivan de las sustancias representadas por la fórmula, donde el átomo de hidrógeno de al menos uno de los grupos hidróxilo en dicha fórmula se ha sido sustituido por un radical de acilo de un carboxílico de hidrocarburo, ácido sulfónico o sulfámico de 1-25 átomos de carbono; tetrahidrofuranilo; tetrahidropiranal; o un residuo glicosídico de cadena recta o ramificada conteniendo 1-20 unidades glicosídicas por residuo; y
mezclas de una o más de las sustancias mencionadas anteriormente y/o precursores;
en la producción de una composición farmacéutica para su uso en un método anticonceptivo en mamíferos hembra, comprendiendo el método la administración parenteral o rectal de dicho componente estrogénico y un componente progestogénico a una hembra con capacidad reproductiva en una cantidad eficaz para inhibir la ovulación y donde el método no emplea la coadministración de una composición hormonal liberadora de la hormona luteinizante (LHRH) o una composición hormonal liberadora de la gonadotropina (gnRH).
2. Uso según la reivindicación 1, donde el método comprende la administración del componente estogénico y progestrogénico en una cantidad eficaz para inhibir la ovulación durante un periodo de al menos 20 días, preferiblemente de al menos 50 días.
3. Uso según la reivindicación 1 o 2, donde R3 representa un grupo hidróxilo o un grupo alcoxi.
4. Uso según cualquiera de las reivindicaciones 1-3, donde al menos 3 de los grupos R1, R2, R3 y R4 representan átomos de hidrógeno.
5. Uso según cualquiera de las reivindicaciones 1-4, donde el método comprende la administración ininterrumpida del componente estrogénico durante un periodo de al menos 10 días, preferiblemente de al menos 20 días.
6. Uso según la reivindicación 5, donde el método comprende la administración ininterrumpida, durante un periodo de al menos 10 días, de una combinación del componente estrogénico y un componente progestogénico.
7. Uso según la reivindicación 6, donde el método comprende la administración ininterrumpida de la combinación del componente estrogénico y el componente progestogénico durante un periodo de al menos 28 días, preferiblemente de al menos 60 días.
8. Uso según la reivindicación 6, donde el método comprende un intervalo de al menos 2 días, preferiblemente de 3-9 días, durante los cuales no se administra ningún componente progestogénico ni estrogénico y donde la reducción resultante en concentración de suero del componente progestogénico y del componente estrogénico induce a menstruaciones.
9. Uso según la reivindicación 6, donde el método comprende la administración ininterrumpida del componente estrogénico durante un periodo de al menos 28 días, preferiblemente de al menos 60 días, y donde, tras la administración combinada del componente estrogénico y del componente progestogénico, el componente estrogénico y ningún componente progestogénico se administran durante 3-18 días consecutivos y la reducción resultante en concentración de suero del componente progestogénico induce a menstruaciones.
10. Uso según cualquiera de las reivindicaciones 1-9, donde el método comprende la administración transdérmica, intranasal, intravaginal, rectal, pulmonar, bucal, subcutánea o intrauterina del componente estrogénico y el componente progestogénico.
11. Uso según cualquiera de las reivindicaciones 1-10, donde el componente estrogénico se administra en una cantidad eficaz para conseguir una concentración de suero sanguíneo de al menos 0,02 µg, preferiblemente de al menos 0,1 µg por litro.
12. Uso según cualquiera de las reivindicaciones 1-11, donde el componente estrogénico se administra en una cantidad de al menos 1 µg por kg de peso corporal al día, preferiblemente de al menos 5 µg por kg de peso corporal al día.
13. Uso según cualquiera de las reivindicaciones 1-12, donde el componente progestogénico se administra en una cantidad eficaz para conseguir una concentración de suero sanguíneo equivalente a al menos 50 pg/ml de levonorgestrel, preferiblemente a al menos 200 pg/ml de levonorgestrel.
14. Un sistema de administración de medicamentos para la administración parenteral o rectal que contiene un componente estrogénico y un componente progestogénico, estando seleccionado dicho sistema de administración de medicamentos a partir del grupo que consiste en supositorios, sistemas para la administración intravaginal, preparaciones de depósito inyectables o implantables, inhaladores, sprays nasales y sistemas de administración transdérmica, donde el sistema contiene al menos 0,01 mg, preferiblemente al menos 0,05 mg de componente estrogénico tal y como se define en la reivindicación 1 y donde el sistema no contiene una composición de LHRH o una composición de GnRH.
15. Sistema de administración de medicamentos según la reivindicación 14, donde el dispositivo contiene adicionalmente al menos 10 µg, preferiblemente al menos 30 µg de componente progestogénico.
Patentes similares o relacionadas:
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Métodos y composiciones para trastornos relacionados con la proliferación celular, del 27 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un método in vitro para diagnosticar a un sujeto que tiene un trastorno relacionado con la proliferación celular o que se sospecha que tiene un trastorno relacionado con […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]
Inhibidores de ERK y sus usos, del 8 de Abril de 2020, de Celgene CAR LLC: Un compuesto de fórmula VIII: **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: el anillo A se selecciona de **(Ver fórmula)** […]
Procedimiento de uso de inmunoconjugados anti-CD79b, del 8 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Un inmunoconjugado que comprende un anticuerpo anti-CD79b unido a un agente citotóxico para su uso en un procedimiento para tratar un trastorno proliferativo […]
IMIPRAMINA PARA USO COMO INHIBIDOR DE LA SOBREXPRESIÓN DE LA FASCINA 1, del 2 de Abril de 2020, de FUNDACION UNIVERSITARIA SAN ANTONIO: La presente invención se refiere a imipramina para su uso como inhibidor de la sobreexpresión de la fascina 1, preferiblemente dicha sobreexpresión de la fascina 1 está asociada […]
Mutación novedosa del receptor de andrógenos, del 25 de Marzo de 2020, de NOVARTIS AG: Una composicion terapeutica para su uso en el tratamiento de un paciente que padece cancer de prostata o de mama, asociado con una mutacion del receptor de […]
Composiciones y métodos para la distribución de moléculas en células vivas, del 25 de Marzo de 2020, de THE TEXAS A & M UNIVERSITY SYSTEM: Un compuesto que tiene la fórmula: **(Ver fórmula)** En donde X es un resto de unión, Y es un residuo de aminoácido acoplado de forma covalente […]