PRODUCCION DE POXVIRUS CON ESTIRPES DE CELULAS AVIARES ADHERENTES O NO ADHERENTES.
Procedimiento para multiplicar un virus de la vacuna natural o recombinante que comprende las etapas de inoculación de las células troncales procedentes de embriones aviares con partículas víricas de dicho virus de la vacuna y de cultivo de dichas células en un medio basal hasta que se produzca la lisis celular y las partículas víricas recién producidas se liberen en dicho medio,
en el que dichas células troncales procedentes de embriones aviares se obtienen por un procedimiento que consiste en:
a) cultivar las células embrionarias aviares en un medio de cultivo completo complementado en suero que contiene:
- los factores de crecimiento que comprenden los factores tróficos SCF, IGF-1 y bFGF y citocinas seleccionadas de entre el grupo de citocinas constituido por LIF, interleucina 11, interleucina 6, receptor de interleucina 6, CNTF, oncostatina y cardiotrofina; y
- una capa alimentadora,
b) atenuar mediante la modificación del medio de cultivo con el fin de obtener la retirada progresiva o total de dichos factores, del suero y/o de la capa alimentadora,
c) establecer las estirpes celulares aviares adherentes o no adherentes que pueden proliferar en un medio basal en ausencia de factores de crecimiento exógenos, de suero y/o de la capa alimentadora inactivada
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2004/002621.
Solicitante: VIVALIS.
Nacionalidad solicitante: Francia.
Dirección: LIEUDIT LA CORBIERE,49450 ROUSSAY.
Inventor/es: PAIN, BERTRAND, GUEHENNEUX,FABIENNE.
Fecha de Publicación: .
Fecha Concesión Europea: 12 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C12N15/863A
- C12N15/863V
- C12N7/02C
Clasificación PCT:
- C12N5/07 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos animales.
- C12N7/00 C12N […] › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
Clasificación antigua:
- C12N5/06
- C12N7/00 C12N […] › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
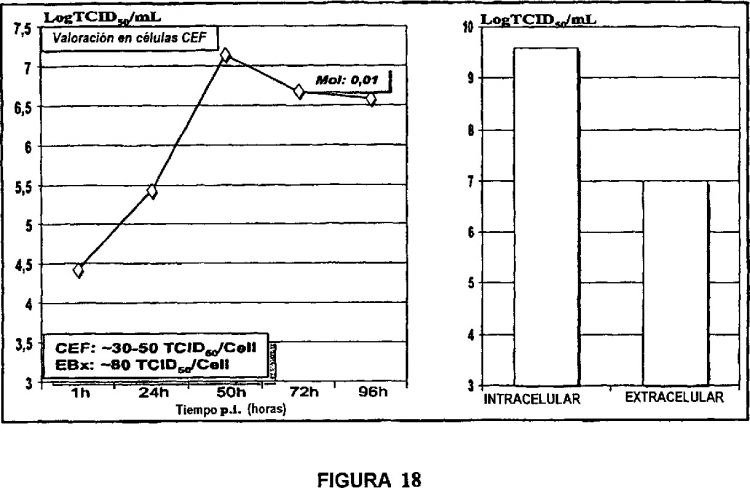
Fragmento de la descripción:
Producción de poxvirus con estirpes de células aviares adherentes o no adherentes.
La presente invención se refiere a un procedimiento para producir virus de la vacuna vivos o atenuados, naturales o modificados, con células troncales embrionarias aviares, que comprende infectar dichas células con partículas de virus.
Históricamente, el virus de la vacuna es conocido por haber sido utilizado con éxito para inmunizar contra la viruela, permitiendo su erradicación en 1980 según la OMS. Desde entonces, se ha interrumpido la vacunación. Hoy, el resurgimiento de este virus se considera una amenaza potencial que podría ser devastadora para la población desprotegida. El problema es que solamente 15 millones de dosis de vacuna de viruela están disponibles en los EE.UU. y la FDA ha facilitado instrucciones y contratos para producir grandes cantidades de dosis unitarias de la vacuna contra la viruela. Informaciones adicionales están accesibles en: http://www.bt.cdc.gov/Agent/Smallpox/SmallpoxConsensus.pdf.
Sin embargo, la aceleración de la producción requiere nuevos procedimientos de producción y estirpes celulares adecuadas. En la presente invención, se describen nuevas estirpes celulares (adherentes y no adherentes) de especies aviares que podrían ser utilizadas como sustrato por las compañías farmacéuticas para la producción de vacunas. Estas nuevas células proceden de embriones de aves y podrían reemplazar a óvulos o fibroblastos de embriones primarios que se utilizan actualmente.
Tradicionalmente, las vacunas producen inmunidad contra las enfermedades utilizando una versión debilitada o inactivada del agente infeccioso. Las propiedades de los poxvirus atenuados actualmente como la ausencia de multiplicación en las células humanas y la provocación útil de la respuesta inmunitaria permiten el desarrollo de nuevas estrategias para vacunas utilizando como ejemplo MVA (virus de Ankara modificado) como vector. El MVA es una cepa muy atenuada del virus de la vacuna (VV) que se desarrolló inicialmente como vacuna segura para la viruela antes de la erradicación de esta enfermedad. El MVA procedía de la cepa Ankara mediante más de 570 atenuaciones en serie a través de fibroblastos de embriones de pollo (CEF) primarios y, como consecuencia de esta adaptación contiene varias eliminaciones genómicas grandes en comparación con la cepa original. El MVA puede no multiplicarse ya en la mayoría de las estirpes celulares de mamíferos y es apatógeno en animales. Más significativamente, no se informó de complicaciones graves cuando se administraba MVA como vacuna contra la viruela en más de 100.000 personas, incluyendo personas inmunodeprimidas. Mediante técnicas clásicas de biología molecular, es posible obtener MVA recombinante que contiene ADN extraño que codifica péptidos o proteínas específicas de interés terapéutico. Estos virus recombinantes después de la inyección, in vivo, pueden estimular el sistema inmunitario contra antígenos específicos como los antígenos tumorales. Actualmente, estas nuevas generaciones de vectores de la vacuna se desarrollan o podrían desarrollarse para luchar contra enfermedades infecciosas humanas o animales y contra una amplia variedad de tipos de tumores (melanoma, cáncer de próstata, cáncer de mama, cáncer de pulmón, cáncer de ovario, cáncer de hígado...).
Drexler l. et al. (1998 J. Gen Virol. 79:347-352) han observado que el virus Ankara de la vacuna modificado (MVA) muy atenuado se multiplica en las células de riñón de crías de hámster (potencial hospedador para la propagación del virus, pero no en varias células humanas transformadas y primarias; por consiguiente, la diversidad de hospedador de MVA está limitada. Además esta cepa de poxvirus muy atenuada no crea infecciones productivas (Moss B., Dev. Biol. Stand. 1994:55-63. Por ejemplo, Blanchard TJ. et al. (1998 J. Gen Virol. 79:1159-1167) han publicado que el virus Ankara de la vacuna modificado, experimenta multiplicación limitada en las células humanas y carece de varias proteínas inmunomoduladoras. Además, los rendimientos de la producción deben ser proporcionados a la viabilidad económica de la producción en masa de la vacuna contra la viruela.
El certificado de seguridad fehaciente del MVA y la potente respuesta inmunitaria celular y humoral, provocada en las personas vacunadas ha generado considerable interés científico e industrial en la utilización del MVA como vector recombinante para inmunizar contra las enfermedades infecciosas humanas y animales, en particular contra el VIH y el cáncer. Dada su adaptación a CEF, el MVA puede desarrollarse hasta valores elevados en dichas células y los lotes clínicos corrientes de candidatos para la vacuna con el MVA recombinante se producen en CEF primarios. Sin embargo, la creación de los CEF requiere experiencia en la preparación del cultivo de tejido primario y depende de los huevos de pollo mantenidos en condiciones especiales exentas de patógenos. Además, el procedimiento de producción es enormemente laborioso y difícil de normalizar, ya que las células primarias sobreviven solamente unas pocas atenuaciones y por lo tanto han de prepararse continuamente a partir de óvulos fecundados. Aunque los productores de la vacuna pueden tratar con dichas limitaciones para la producción de lotes de material de MVA durante las pruebas clínicas en fase I y II, la aceleración del procedimiento de producción a base de CEF para las pruebas clínicas en fase III y opcionalmente para la comercialización posterior del producto continúa siendo un obstáculo serio.
El problema que debe ser resuelto por la presente invención consiste en proporcionar estirpes celulares para multiplicar el virus de la vacuna que evitaría los problemas mencionados anteriores y que satisfaría los requisitos de la agencia reguladora. Éste es el objetivo de la presente invención.
Teóricamente, dicha estirpe celular debería cumplir todas las normativas; la célula estará caracterizará totalmente por unos antecedentes conocidos. Además, la estirpe celular será benigna, genéticamente inalterada y estable en el cultivo de larga duración. La estirpe celular podría multiplicar virus y adaptarse a un desarrollo adherente, estable y en suspensión en el medio exento de suero. A este respecto, se investiga la utilización de las células aviares para virus reproduciéndose. Se comunica que las estirpes de células troncales creadas procedentes de nuevos embriones aviares detalladas en la solicitud pendiente de trámite PCT/FR03/00735 (WO 03/076601) de los inventores son particularmente adecuadas para los poxvirus reproduciéndose, en particular los ortopoxvirus de la viruela tales como el virus de la vacuna.
Debido a que se requiere proliferación celular ilimitada para el procedimiento de la producción en masa de la vacuna, se seleccionó examinar la capacidad de la célula troncal procedente de embriones aviares para los virus reproduciéndose. Sin embargo, para mantener las células troncales derivadas de embriones aviares in vitro durante largos períodos, es necesario observar las condiciones de cultivo específico y de mantenimiento tal como se describe en Pain et al.,(1996, Development 122:2339-2348); la patente US nº 6.114.168 y el documento EP 787 180 y estas condiciones de cultivo son costosas. El problema consistió en poder mantener las células troncales procedentes de embriones aviares en cultivo en un medio económico evitando obstáculos tales como la diferenciación celular y la senescencia. En el contexto de la invención, se ha descubierto que la retirada de los factores de crecimiento, del suero y/o de la capa alimentadora conduce al aislamiento de las poblaciones de células troncales procedentes de los embriones de las aves, que pueden crecer en medio de cultivo basal.
Además, aparte de las células troncales hematopoyéticas que son en su mayor parte células no adherentes, las células obtenidas según el estado de la técnica anterior presentan un fenotipo adherente. Sin embargo, resultan preferidas células no adherentes para la producción industrial de las vacunas víricas. Este fenotipo presenta ventajas tanto debido a la facilidad de manipulación que impide la utilización de una enzima proteolítica para la disociación como por las altas densidades celulares alcanzadas por las células no adherentes cultivadas in vitro. La presente invención describe la producción de estirpes de células troncales procedentes de embriones aviares que pueden convertirse espontáneamente en no adherentes o para las que se obtiene falta de adherencia por retirada de la capa alimentadora....
Reivindicaciones:
1. Procedimiento para multiplicar un virus de la vacuna natural o recombinante que comprende las etapas de inoculación de las células troncales procedentes de embriones aviares con partículas víricas de dicho virus de la vacuna y de cultivo de dichas células en un medio basal hasta que se produzca la lisis celular y las partículas víricas recién producidas se liberen en dicho medio, en el que dichas células troncales procedentes de embriones aviares se obtienen por un procedimiento que consiste en:
2. Procedimiento según la reivindicación 1, en el que en la etapa a), dichas células embrionarias de ave cultivadas son células embrionarias de pollo o de pato.
3. Procedimiento según la reivindicación 1 ó 2, en el que la capa alimentadora está inactivada.
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, en el que dicho virus de la vacuna es el virus Ankara de la vacuna modificado (MVA), el virus de la vacuna de Lister-Elstree, el virus NYVAC, el virus LC16m8 o el virus CV178.
5. Procedimiento según las reivindicaciones 1 a 4, en el que dichas estirpes de células aviares obtenidas en la etapa c) pueden proliferar durante por lo menos 600 días.
6. Procedimiento según cualquiera de las reivindicaciones 1 a 5, en el que dichas estirpes de células aviares obtenidas en la etapa c) son células troncales no adherentes que proliferan en suspensión en un medio exento de factores de crecimiento exógenos.
7. Procedimiento según cualquiera de las reivindicaciones 1 a 5, en el que dichas estirpes de células aviares son células troncales no adherentes que proliferan en suspensión en un medio exento de suero (medio exento de suero).
8. Procedimiento según cualquiera de las reivindicaciones 1 a 5, en el que dichas estirpes de células aviares son células troncales no adherentes que proliferan en suspensión en un medio exento de factores de crecimiento exógenos y suero.
9. Procedimiento según cualquiera de las reivindicaciones 1 a 5, en el que dichas estirpes de células aviares obtenidas en la etapa c) son células troncales no adherentes que proliferan en suspensión en un medio exento de factores de crecimiento exógenos, suero y células alimentadoras.
10. Procedimiento según cualquiera de las reivindicaciones 1 a 9, en el que dichas estirpes de células aviares obtenidas en la etapa c) presentan por lo menos una de las características siguientes:
11. Procedimiento según cualquiera de las reivindicaciones 1 a 10, en el que dichas estirpes de células aviares obtenidas en la etapa c) se cultivan en medio basal.
12. Procedimiento según la reivindicación 11, en el que dichas estirpes de células aviares obtenidas en la etapa c) se cultivan en un medio basal seleccionado de entre el grupo constituido por DMEM, GMEM, HamF12 o McCoy complementado con aditivos seleccionado de entre el grupo constituido por aminoácidos no esenciales, vitaminas y piruvato de sodio.
13. Procedimiento para producir vacunas de microbios vivos o atenuadas que comprende cultivar las estirpes celulares adherentes o no adherentes establecidas en la etapa c) según el procedimiento de las reivindicaciones 1 a 12.
14. Procedimiento según la reivindicación 13, para producir vacunas contra la viruela de microbios vivos o atenuadas.
15. Procedimiento según la reivindicación 13, para producir vacunas contra el cáncer de microbios vivos o atenuadas.
16. Procedimiento según la reivindicación 13, para producir vacunas contra enfermedades infecciosas de microbios vivos o atenuadas.
Patentes similares o relacionadas:
VECTORES BASADOS EN EL VIRUS DE LA ANEMIA INFECCIOSA EQUINA (VAIE), del 3 de Febrero de 2012, de OXFORD BIOMEDICA (UK) LIMITED: Genoma de vector de VAIE que puede estar empaquetado y que puede expresar genes heterólogos, caracterizado porque comprende un gen gag truncado pero […]
 PROCEDIMIENTOS NOVEDOSOS PARA RESCATAR VIRUS DE ARN, del 9 de Mayo de 2011, de WYETH HOLDINGS CORPORATION: Un procedimiento para producir un virus Mononegavirales recombinante que comprende; a) en al menos una célula huésped, realizar la transfección, en medio, de […]
PROCEDIMIENTOS NOVEDOSOS PARA RESCATAR VIRUS DE ARN, del 9 de Mayo de 2011, de WYETH HOLDINGS CORPORATION: Un procedimiento para producir un virus Mononegavirales recombinante que comprende; a) en al menos una célula huésped, realizar la transfección, en medio, de […]
 CEPAS DE MVA RECOMBINANTES COMO VACUNAS POTENCIALES CONTRA LA MALARIA POR P. FALCIPARUM, del 25 de Mayo de 2010, de RUPRECHT-KARLS-UNIVERSITAT HEIDELBERG
HELMHOLTZ ZENTRUM MUNCHEN DEUTSCHES FORSCHUNGSZENTRUM FUR GESUNDHEIT UND UMWELT (GMBH): Vacuna que comprende
a) un virus MVA recombinante, que comprende un fragmento o fragmentos del ácido nucleico que codifica la proteína MSP-1 de Plasmodium falciparum; y
b) […]
CEPAS DE MVA RECOMBINANTES COMO VACUNAS POTENCIALES CONTRA LA MALARIA POR P. FALCIPARUM, del 25 de Mayo de 2010, de RUPRECHT-KARLS-UNIVERSITAT HEIDELBERG
HELMHOLTZ ZENTRUM MUNCHEN DEUTSCHES FORSCHUNGSZENTRUM FUR GESUNDHEIT UND UMWELT (GMBH): Vacuna que comprende
a) un virus MVA recombinante, que comprende un fragmento o fragmentos del ácido nucleico que codifica la proteína MSP-1 de Plasmodium falciparum; y
b) […]
MVA QUE EXPRESA GENES DE ENVOLTURA, GAG Y POL DE VIH MODIFICADOS, del 9 de Marzo de 2010, de THE GOVERNMENT OF THE UNITED STATES OF AMERICA, AS REPRESENTED BY THE SECRETARY, DEPARTMENT OF HEAL EMORY UNIVERSITY: Una composición farmacéutica que comprende un virus MVA recombinante que codifica Gag/Pol de HXB2 de MVA 48 (SEQ ID NO: 5) y la envoltura de ADA truncada […]
 VECTORES RECOMBINANTES BASADOS EN EL VIRUS VACCINIA MODIFICADO DE ANKARA (MVA) COMO VACUNAS CONTRA LA LEISHMANIASIS, del 23 de Diciembre de 2009, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Vectores recombinantes basados en el virus vaccinia modificado de Ankara (MVA) como vacunas contra la leishmaniasis. Los vectores de la invención contienen […]
VECTORES RECOMBINANTES BASADOS EN EL VIRUS VACCINIA MODIFICADO DE ANKARA (MVA) COMO VACUNAS CONTRA LA LEISHMANIASIS, del 23 de Diciembre de 2009, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Vectores recombinantes basados en el virus vaccinia modificado de Ankara (MVA) como vacunas contra la leishmaniasis. Los vectores de la invención contienen […]
 VECTORES RECOMBINANTES BASADOS EN EL VIRUS MODIFICADO DE ANKARA (MVA) COMO VACUNAS PREVENTIVAS Y TERAPEUTICAS CONTRA EL SIDA, del 16 de Febrero de 2009, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Vectores recombinantes basados en el virus modificado de Ankara (MVA) como vacunas preventivas y terapéuticas contra el SIDA. Los virus recombinantes […]
VECTORES RECOMBINANTES BASADOS EN EL VIRUS MODIFICADO DE ANKARA (MVA) COMO VACUNAS PREVENTIVAS Y TERAPEUTICAS CONTRA EL SIDA, del 16 de Febrero de 2009, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Vectores recombinantes basados en el virus modificado de Ankara (MVA) como vacunas preventivas y terapéuticas contra el SIDA. Los virus recombinantes […]
MODULACIÓN DE LA PRODUCCIÓN DE RETROVIRUS POR APOBEC4, del 23 de Diciembre de 2011, de Bundesrepublik Deutschland, letztvertreten durch den Präsidenten des Paul-Ehrlich-Instituts Prof. Dr. Johannes Löwer: Una proteína APOBEC4 humana modificada caracterizada porque el extremo N está modificado para estabilizar la proteína APOBEC4 o el extremo C […]
 VECTORES DE EIAV CON CODONES OPTIMIZADOS, del 4 de Agosto de 2010, de OXFORD BIOMEDICA (UK) LIMITED: Uso de una secuencia nucleotídica que codifica proteínas retrovíricas gag y pol capaces de ensamblar un genoma de vector retrovírico en una partícula […]
VECTORES DE EIAV CON CODONES OPTIMIZADOS, del 4 de Agosto de 2010, de OXFORD BIOMEDICA (UK) LIMITED: Uso de una secuencia nucleotídica que codifica proteínas retrovíricas gag y pol capaces de ensamblar un genoma de vector retrovírico en una partícula […]