PROCEDIMIENTO PARA OBTENER ANTICUERPOS.
Un método para la preparación de moléculas de anticuerpos recombinantes que comprende cultivar una muestra de célula hospedadora transformada con un vector de expresión que codifica una molécula de anticuerpo recombinante y someter dicha muestra de célula hospedadora a una etapa de tratamiento térmico,
caracterizada porque dicha muestra se somete a una etapa de tratamiento no lisante a presión antes de someterse a un aumento de temperatura dentro del intervalo de 30ºC a 70ºC durante un periodo de hasta 24 horas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2005/004397.
Solicitante: UCB PHARMA, S.A..
Nacionalidad solicitante: Bélgica.
Dirección: ALLEE DE LA RECHERCHE 60,1070 BRUXELLES.
Inventor/es: SEHDEV,MUKESH UCB CELLTECH, SPITALI,MARIANGELA UCB CELLTECH.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Junio de 2010.
Clasificación Internacional de Patentes:
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
Clasificación PCT:
- B01D15/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01D SEPARACION (separación de sólidos por vía húmeda B03B, B03D, mesas o cribas neumáticas B03B, por vía seca B07; separación magnética o electrostática de materiales sólidos a partir de materiales sólidos o de fluidos, separación mediante campos eléctricos de alta tensión B03C; aparatos centrifugadores B04B; aparato de vórtice B04C; prensas en sí para exprimir los líquidos de las sustancias que los contienen B30B 9/02). › Procedimientos de separación que implican el tratamientos de líquidos con absorbentes sólidos; Aparatos para ello.
- C07K16/00 C07K […] › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12N1/00 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo.
- C12P21/00 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00).
Fragmento de la descripción:
Procedimiento para obtener anticuerpos.
La presente invención se refiere a métodos para aumentar los rendimientos en la producción y aislamiento de anticuerpos funcionales recombinantes, y en particular de anticuerpos terapéuticos. Los métodos se particularmente adecuados para la fabricación industrial a gran escala de anticuerpos terapéuticos.
Se han desarrollado rápidamente técnicas de ADN recombinante y son particularmente útiles en la producción de anticuerpo, en particular de anticuerpos terapéuticos. Los sistemas para la expresión de genes recombinantes son bien conocidos por los expertos en este campo en cuestión. Estos incluyen la expresión en células de mamífero, células de insecto, células micóticas, células bacterianas y animales y plantas transgénicos. La elección del sistema de expresión depende de las características de la proteína codificada, por ejemplo las modificaciones tras la traducción. Otras consideraciones incluyen el tiempo y, en particular, el coste implicado en la producción de la cantidad deseada de material de la calidad requerida. Estas últimas consideraciones son particularmente importantes en la producción de anticuerpos terapéuticos de la calidad requerida para la aprobación reglamentaria y en las cantidades necesarias para el tratamiento de un gran número de pacientes.
El sistema más ampliamente utilizado para la producción de proteínas recombinantes se basa en la expresión en Escherichia coli (E. coli). Un problema específico encontrado con la utilización de E. coli es la dificultad de producir material de la calidad requerida en cantidades necesarias para la terapia. En particular, el tiempo y los costes implicados pueden ser prohibitivos. Un problema específico a destacar es la pérdida incurrida en el rendimiento de anticuerpos durante la extracción de los anticuerpos de E. coli. Un método que estudia parcialmente este último problema y que permite la producción de anticuerpo aceptable para uso terapéutico se describe en el documento US 5.665.866. Este método implica la utilización del tratamiento térmico para facilitar el aislamiento posterior de fragmentos Fab funcionales de anticuerpos a partir de anticuerpos no funcionales,realizándose el tratamiento térmico en cualquier momento durante la fermentación o el cultivo, o en cualquier etapa durante la extracción y purificación de los anticuerpos. A elevadas temperaturas superiores a la temperatura ambiente, los anticuerpos funcionales son extraordinariamente estables, mientras que muchas otras proteínas incluyendo las proteínas de la célula hospedadora y especies exentas de cadenas ligera y pesada y fragmentos no funcionales de anticuerpo, forman precipitados y/o aglomerados que se separan fácilmente del anticuerpo funcional durante los procedimientos de purificación primaria tales como filtración o centrifugación o cromatografía en lecho fluidizado. Aunque, proporcionalmente, los costes de purificación son una fracción del coste total de un producto de anticuerpo terapéutico, la proporción del coste de purificación aumentará más a medida que los costes de producción aguas arriba sean más económicos. Así, las mejoras en la recuperación y purificación de anticuerpos conducirán a costes de producción más hacia abajo con independencia de los medios de producción (Humphreys & Glover, Curr. Opin. Drug Discovery & Development, 2001,4:172-185). Por consiguiente, hay necesidad de métodos que introduzcan ahorros de tiempo y/o de costes en la producción de anticuerpos terapéuticos y, en particular, en la purificación, por ejemplo aumentando la recuperación de productos y/o mejorando la calidad de la corriente del producto.
Bajo rendimiento en el producto por fermentación o cultivo es con frecuencia un problema específico observado en la etapa de extracción primaria; la expresión de anticuerpos es alta dentro de las células pero un alto porcentaje de recuperación en la etapa de extracción primaria es extraordinariamente difícil de conseguir. El documento US 5.665.866 describe el aumento de rendimientos de la purificación inicial por inclusión de una etapa de tratamiento térmico que ayuda al proceso de purificación eliminando el anticuerpo no funcional.
El documento WO 2005019466 (publicado después de la fecha de prioridad de esta solicitud) describe un aumento en el rendimiento de proteínas recombinantes por la inclusión de una etapa de interrupción después de la fermentación pero antes del tratamiento aguas abajo.
El documento US 5.380.826 se refiere a la destrucción de células microbianas y a la extracción de componentes extracelulares sometiendo las células a tratamiento con un disolvente a una presión crítica y manteniendo una temperatura crítica en el intervalo 0 a 100ºC, seguida de un repentino alivio de la presión produciendo de este modo una caída de presión, que permite la recogida de algunas proteínas o ácidos nucleicos liberados.
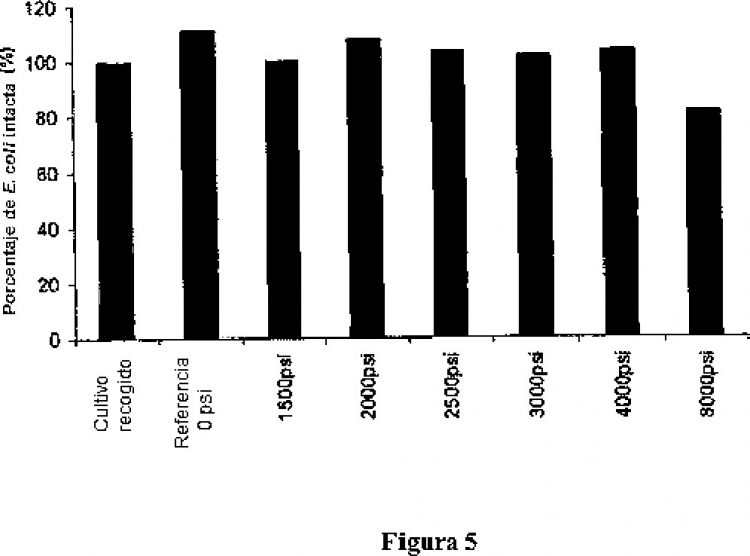
Esta invención descrita en la presente memoria se basa en la sorprendente e inesperada observación de que el tratamiento no lisante en combinación con el tratamiento térmico, produce un aumento en el rendimiento del anticuerpo funcional en la etapa de extracción primaria de hasta 50%; es decir, el rendimiento del anticuerpo funcional aumenta por encima del tratamiento térmico solo. Esto permite ahorros enormemente beneficiosos en tiempo y costes de producción de cantidades de anticuerpos funcionales de calidad terapéutica.
Por consiguiente, se proporciona un método para la preparación de moléculas de anticuerpos recombinantes que comprende cultivar una muestra de célula hospedadora transformada con un vector de expresión que codifica una molécula de anticuerpo recombinante y someter dicha muestra de célula hospedadora a una etapa de tratamiento térmico, caracterizada porque dicha muestra se somete a una etapa de tratamiento no lisante a presión antes de someterse a un aumento de temperatura dentro del intervalo de 30ºC a 70ºC durante un periodo de hasta 24 horas.
En un ejemplo preferido, la molécula de anticuerpo recombinante es parte al menos de una cadena ligera de anticuerpos y es parte al menos de una cadena pesada de anticuerpos de modo que al menos alguna de las moléculas de anticuerpo de la cadena ligera y pesada expresadas son capaces de combinarse para formar un anticuerpo funcional.
La invención también proporciona un método para aumentar el rendimiento de moléculas de anticuerpos funcionales aisladas de una muestra que comprende moléculas de anticuerpos funcionales y moléculas de anticuerpos no funcionales, cuyo método comprende someter la muestra a un aumento de temperatura dentro del intervalo de 30ºC a 70ºC durante un periodo de hasta 24 horas, en el que la muestra se somete a una etapa de tratamiento no lisante antes de someterse al aumento de temperatura. Utilizando los métodos de la invención se consigue, por consiguiente, un aumento de rendimiento de los anticuerpos funcionales aislados u obtenidos.
En particular, el método permite un aumento en los rendimientos en el anticuerpo funcional aislado en un intervalo de temperaturas y condiciones de tratamiento, que pueden variarse según se requiera, y son comprendidos por un experto en la materia, al tener en cuenta las características particulares del anticuerpo funcional producido y el sistema de expresión que se utiliza.
Tal como se utiliza en la presente memoria, "anticuerpo funcional" comprende las moléculas de anticuerpo que conservan la capacidad de reconocer o unirse específicamente al antígeno contra el que fueron producidos (antígeno afín). La producción de un anticuerpo funcional se demuestra por la presencia de una sola banda en SDS-PAGE no reductora correspondiente al peso molecular esperado del anticuerpo, o por ensayo de enlace directo utilizando BIACore u otros métodos conocidos por el experto en la materia, por ejemplo pero sin limitarse a, ELISA. Los anticuerpos no funcionales comprenden fragmentos que no reconocen su antígeno afín, e incluyen anticuerpos incorrectamente plegados o incorrectamente ensamblados, cadenas pesadas y ligeras libres, y fragmentos de los mismos, incluyendo fragmentos parcialmente degradados de anticuerpos que no reconocen ni se unen a su antígeno afín.
En los métodos de la invención una muestra puede ser el producto de una fermentación (o cultivo), por ejemplo pero sin limitación, una fermentación que comprende bacterias, especialmente bacterias gram-negativas, o levadura, un cultivo celular, por ejemplo pero sin limitación, un cultivo celular de mamífero o insecto. Aún más...
Reivindicaciones:
1. Un método para la preparación de moléculas de anticuerpos recombinantes que comprende cultivar una muestra de célula hospedadora transformada con un vector de expresión que codifica una molécula de anticuerpo recombinante y someter dicha muestra de célula hospedadora a una etapa de tratamiento térmico, caracterizada porque dicha muestra se somete a una etapa de tratamiento no lisante a presión antes de someterse a un aumento de temperatura dentro del intervalo de 30ºC a 70ºC durante un periodo de hasta 24 horas.
2. El método según la reivindicación 1 en el que el anticuerpo está humanizado, es híbrido o injertado con CDR.
3. El método según la reivindicación 1 o 2, en el que el anticuerpo es un fragmento Fv, Fab, Fab', F(ab')2 monocatenario o un fragmento de unión al epítopo de éste.
4. El método según una cualquiera de las reivindicaciones 1-3, en el que el tratamiento a presión se realiza entre 51,7 bar (750 psi) y 344,7 bar (5000 psi).
5. El método según la reivindicación 4, en el que el tratamiento a presión se realiza entre 68,9 bar (1000 psi) y 275,8 bar (4000 psi).
6. El método según la reivindicación 5, en el que el tratamiento a presión se realiza a 137,9 bar (2000 psi).
7. El método según una cualquiera de las reivindicaciones anteriores, que además comprende al menos una etapa de purificación, realizándose dicha etapa de purificación después de la etapa de tratamiento térmico.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Proteínas y péptidos modificados, del 24 de Junio de 2020, de GLAXO GROUP LIMITED: Un dominio variable de inmunoglobulina único, que se une a TNFR1 y que se selecciona de cualquiera de las siguientes secuencias de aminoácidos: (a) DOM1h-131-206 caracterizada […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]
Métodos para purificar una proteína objetivo de una o más impurezas en una muestra, del 17 de Junio de 2020, de EMD Millipore Corporation: Un metodo para purificar una proteina objetivo que contiene una region Fc de una o mas impurezas en una muestra, el metodo comprende las etapas de: a) poner en contacto […]
Dominios variables de inmunoglobulina, del 10 de Junio de 2020, de Ablynx NV: Dominio variable individual de inmunoglobulina de cadena pesada (ISVD), en que el residuo aminoacídico en la posición 89 es L y el residuo […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]