NUEVA FORMA CRISTALINA DE MOXIFLOXACINO CLORHIDRATO ANHIDRO FORMA IV.
Nueva forma cristalina de moxifloxacino clorhidrato anhidro forma IV.
La presente invención se refiere a una nueva forma polimórfica estable de moxifloxacino clorhidrato anhidro, a un procedimiento para la preparación de dicha forma polimórfica, y a composiciones farmacéuticas que comprenden dicha forma polimórfica
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200700368.
Solicitante: QUIMICA SINTETICA, S.A..
Nacionalidad solicitante: España.
Provincia: BARCELONA.
Inventor/es: VILLASANTE PRIETO,JAVIER, PALOMO NICOLAU,FRANCISCO.
Fecha de Solicitud: 7 de Febrero de 2007.
Fecha de Publicación: .
Fecha de Concesión: 19 de Enero de 2010.
Clasificación Internacional de Patentes:
- A61K31/4709 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Quinoleínas no condensadas conteniendo otros heterociclos.
- C07D471/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 471/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del sistema condensado, teniendo al menos un ciclo de seis miembros con un átomo de nitrógeno, no previstos en los grupos C07D 451/00 - C07D 463/00. › Sistemas condensados en orto.
Clasificación PCT:
- A61K31/4709 A61K 31/00 […] › Quinoleínas no condensadas conteniendo otros heterociclos.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- C07D471/04 C07D 471/00 […] › Sistemas condensados en orto.
Fragmento de la descripción:
Nueva forma cristalina de moxifloxacino clorhidrato anhidro forma IV.
Campo de la invención
La presente invención se refiere a una nueva forma cristalina estable de moxifloxacino clorhidrato anhidro, denominada aquí como Forma IV, al procedimiento de su preparación y a su uso en la preparación de composiciones farmacéuticas.
Antecedentes de la invención
El moxifloxacino clorhidrato es la denominación común internacional del ácido 1-ciclopropil-6-fluoro-1,4-dihidro-8-metoxi-7-[(4aS,7aS)-octahidro-6H-pirrol[3,4-b]piridin-6-il]-4-oxo-3-quinolin carboxílico clorhidrato de Fórmula (I), de aplicación en medicina y utilizado como agente antibacteriano.
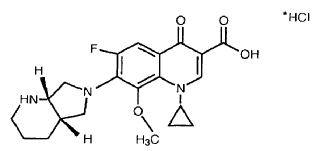
El moxifloxacino racémico fue descrito por primera vez en la patente europea EP 350.733-B y en la solicitud europea EP-A-550.903 se describe específicamente moxifloxacino, producto de configuración (S,S).
Se ha encontrado que moxifloxacino clorhidrato existe en varias formas polimórficas.
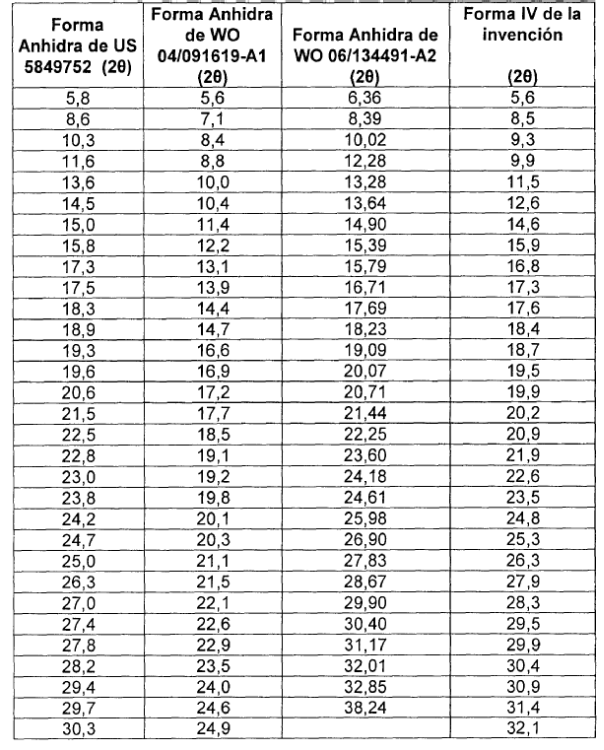
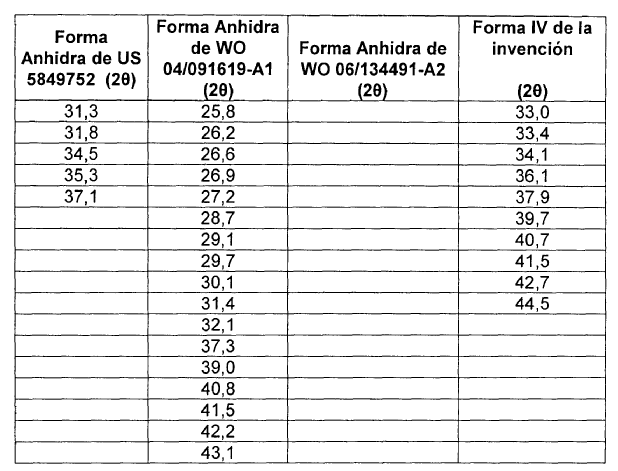
La patente americana US 5,849,752 describe un polimorfo de moxifloxacino clorhidrato monohidrato con un diagrama de difracción de Rayos X característico. Posteriormente, la solicitud internacional WO 04/091619-A1 se refiere una forma cristalina de moxifloxacino clorhidrato anhidro, en la solicitud internacional WO 05/054240-A1 se describen otras dos nuevas formas cristalinas de moxifloxacino clorhidrato y la solicitud de WO 06/134491-A2 otra forma cristalina anhidra de moxifloxacino clorhidrato.
En la memoria de la patente US 5,849,752, los autores manifiestan que la forma conocida en la literatura antes de la solicitud de esta patente es una forma anhidra de moxifloxacino clorhidrato. En esta patente dicha forma anhidra está caracteriza por métodos espectroscópicos (Rayos X en polvo, 13CRMN e IR). También manifiestan que esta forma anhidra de moxifloxacino clorhidrato es inestable y no adecuada para la preparación de composiciones farmacéuticas.
Según los autores de la solicitud WO 04/091619-A1, la forma cristalina de moxifloxacino clorhidrato anhidro que han descubierto tiene un contenido de agua menor que 0.2% medido por método Karl Fisher. Asimismo, manifiestan que su forma cristalina anhidra puede contener humedad residual sin pérdida del carácter anhidro y/o cristalino. Esta forma anhidra está caracteriza por métodos espectroscópicos (Rayos X en polvo, 13CRMN e IR), DSC y TGA.
En la solicitud WO 06/134491-A2, la forma cristalina de moxifloxacino clorhidrato anhidro que se describe tiene un contenido de agua menor que 0.2% medido por método Karl Fisher. La forma anhidra descrita en esta solicitud de patentes está caracteriza por métodos espectroscópicos (Rayos X en polvo e IR) y DSC.
El polimorfismo se refiere a las diversas formas cristalinas de un solo compuesto que presentan propiedades físicas diferentes tales como la estabilidad, solubilidad, puntos de fusión, picos de difracción de RX, etc. Por ello, es importante investigar todas las posibles formas polimórficas de un compuesto y determinar sus propiedades físicas para encontrar la forma más adecuada en función de las distintas dosis farmacéuticas.
De este modo, la finalidad de la invención es proporcionar una nueva forma cristalina del compuesto moxifloxacino clorhidrato que sea lo suficientemente estable para poder ser utilizada en la preparación de composiciones farmacéuticas.
Los autores de la presente invención han descubierto una nueva forma cristalina anhidra de moxifloxacino clorhidrato estable.
Descripción resumida de la invención
La presente invención tiene por objeto proporcionar una nueva forma polimórfica estable de moxifloxacino clorhidrato anhidro Forma IV.
Otro objeto de la presente invención es proporcionar un procedimiento para la preparación de dicha forma polimórfica.
Es también objeto de la presente invención proporcionar composiciones farmacéuticas que comprenda la nueva forma polimórfica objeto de la invención.
Breve descripción de las figuras
La Figura 1 muestra el diagrama de difracción de Rayos X sobre polvo para la nueva forma cristalina objeto de la invención. En ordenadas se presenta el nº de cuentas, y en abscisas la posición de los picos a ángulos 2?.
La figura 2 muestra el espectro de RMN del 13C en estado sólido de la nueva forma cristalina objeto de la invención.
La Figura 3 muestra el espectro de infrarrojo de la nueva forma cristalina objeto de la invención. En ordenadas se presenta la transmitancia y en abscisas la longitud de onda.
Descripción detallada de la invención
De acuerdo a uno de los objetos de la presente invención, se ha descubierto sorprendentemente una nueva forma cristalina de moxifloxacino clorhidrato anhidra, estable, adecuada para su utilización como principio activo en composiciones farmacéuticas.
El contenido en humedad de la nueva forma cristalina anhidra de moxifloxacino clorhidrato es inferior a 0,3% medido por método Karl Fisher.
La nueva forma cristalina de moxifloxacino clorhidrato forma IV, objeto de la invención, se caracteriza por un diagrama de difracción de Rayos X en polvo que es diferente del diagrama de difracción de Rayos X en polvo de otras formas conocidas de moxifloxacino (ver Tabla 2). El diagrama de difracción de Rayos X de la nueva forma cristalina se muestra en la figura 1 teniendo picos característicos a los ángulos 28 mostrados en la tabla 1.
Para el registro del difractograma de Rayos X en polvo se ha utilizado un difractómetro automático para polvo cristalino XPERT PRO de PANALYTICAL con las siguientes características:
Tubo de Cobre, a 40KV y 40 mA. Detector X CELERATOR
Barrido angular de 2-45º
Monocromador de grafito. Rendija automática
Interpretación automática con el software HIGH SCORE
En la Tabla 1 se exponen los espacios d interplanares y las intensidades relativas que caracterizan la nueva forma cristalina de moxifloxacino clorhidrato.
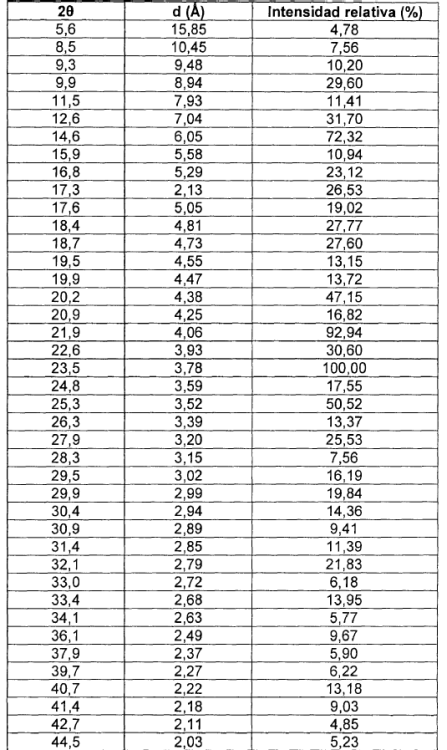
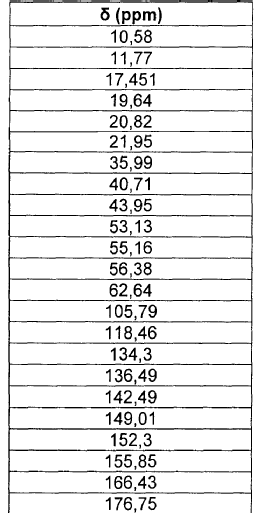
La nueva forma cristalina de moxifloxacino clorhidrato anhidro Forma IV, objeto de la invención, también se caracteriza por resonancia magnética nuclear del 13C en estado sólido.
El espectro de RMN del 13C en estado sólido de la forma IV se muestra en la figura 2 y se caracteriza por los desplazamientos químicos mostrados en la tabla 3. El espectro de la figura 2 se obtuvo en un espectrómetro Bruker Advance DSX300 a 75,488 MHz.
(Tabla pasa a página siguiente)
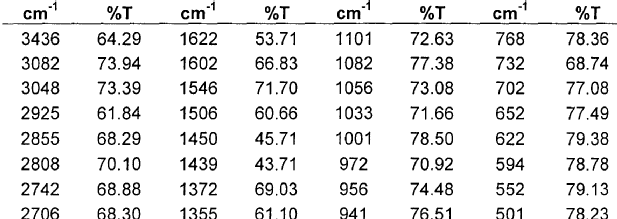
Asimismo, la nueva forma cristalina de moxifloxacino clorhidrato anhidro Forma IV, objeto de la invención, presenta un espectro infrarrojo que contiene picos mostrados en la tabla 4.
El espectro de infrarrojo se obtuvo en pastilla de bromuro potásico utilizando un espectrómetro Perkin Elmer Spectrum One FT-IR. En la tabla 4 se proporcionan las transmitancias de infrarrojo para la forma cristalina de la invención.
Otro aspecto de la presente invención es proporcionar un procedimiento para la preparación de la nueva forma cristalina de moxifloxacino clorhidrato...
Reivindicaciones:
1. Forma cristalina de moxifloxacino clorhidrato caracterizada por un diagrame de difracción de Rayos-X con picos a los ángulos 2?
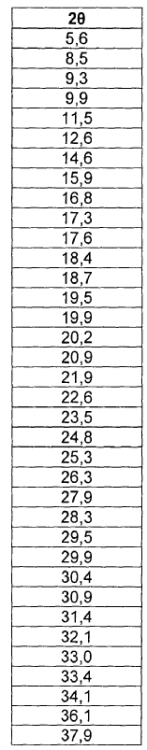

2. Forma cristalina según la reivindicación 1, caracterizada por el hecho de que presenta un diagrama de difracción de Rayos-X sustancialmente de acuerdo con la Figura 1.
3. Forma cristalina de moxifloxacino clorhidrato caracterizada sustancialmente por un espectro de RMN de 13C en estado sólido que presenta los siguientes desplazamientos químicos:
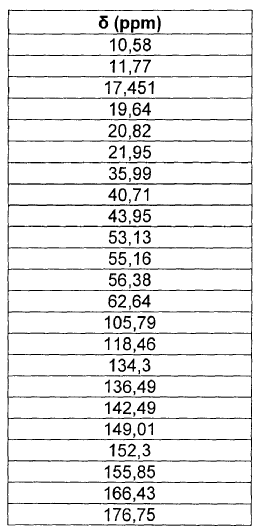
4. Forma cristalina según la reivindicación 3, caracterizada por el hecho de que presenta sustancialmente el espectro de RMN del 13C en estado sólido de acuerdo con la Figura 2.
5. Forma cristalina según la reivindicación 1 ó 2, caracterizada por un espectro de infrarrojo que presenta los picos:
IR (cm-1): 3436, 3082, 3048, 2925, 2855, 2808, 2742, 2706, 2604, 2524, 2413, 2376, 1723, 1622, 1602, 1546, 1506, 1450, 1439, 1372, 1355, 1313, 1273, 1183, 1153, 1120, 1101, 1082, 1056, 1033, 1001, 972, 956, 941, 917, 885, 861, 831, 807, 768, 732, 702, 652, 622, 594, 552, 501, 479.
6. Forma cristalina según la reivindicación 5, caracterizada por el hecho de que presenta sustancialmente un espectro de infrarrojo de acuerdo con la Figura 3.
7. Procedimiento para la obtención de la forma cristalina de moxifloxacino clorhidrato según cualquiera de las reivindicaciones 1 a 6, que comprende:
8. Procedimiento para la obtención de la forma cristalina de moxifloxacino clorhidrato según cualquiera de las reivindicaciones 1 a 6, que comprende:
9. Composición farmacéutica caracterizada porque comprende una cantidad terapéuticamente eficaz de la forma cristalina de moxifloxacino clorhidrato según cualquiera de las reivindicaciones 1 a 6 en asociación con al menos un diluyente inerte adecuado farmacéuticamente aceptable.
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Compuestos de heteroaril carboxamida como inhibidores de RIPK2, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I): **(Ver fórmula)** o sus sales farmacéuticamente aceptables, en la que: X es N y Y es CH; o X es CH y Y es N; […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Formas sólidas de un compuesto modulador de quinasas, del 22 de Julio de 2020, de PLEXXIKON, INC: Una forma cristalina del Compuesto I: **(Ver fórmula)** que es la Forma C del Compuesto I caracterizado por un difractograma de rayos […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]
Procedimiento de preparación de la forma A de grapiprant, del 22 de Julio de 2020, de Aratana Therapeutics Inc: Un procedimiento de preparación de una Forma A cristalina sustancialmente pura de grapiprant, comprendiendo el procedimiento: i. poner en contacto grapiprant a temperatura […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]