MUTANTE DE CEFALOSPORINA C ACILASA Y SU UTILIZACION PARA PREPARAR 7-ACA.
Un mutante de una CPC acilasa compuesto de una subunidad a de acuerdo con la SEQ ID NO:
4 y una subunidad ß de acuerdo la SEQ ID NO: 5, o un derivado del mismo de CPC acilasa funcionalmente equivalente, caracterizado porque al menos un aminoácido seleccionado del grupo que consiste de Val121a, Gly139a y Phe169a de la subunidad a de CPC acilasa de la SEQ ID NO: 4 y Phe58ß, His70ß, Ile75ß, Ile176ß y Ser471ß de la subunidad ß de CPC acilasa de la SEQ ID NO: 5 es reemplazado por otro aminoácido, en donde el mutante de CPC acilasa o el derivado del mismo de CPC acilasa funcionalmente equivalente cataliza la conversión de un compuesto de Fórmula I hasta un compuesto de Fórmula II:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2004/002005.
Solicitante: SANDOZ AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35,4056 BASEL.
Inventor/es: SHIN,YONG CHUL, JEON,JOHN YJ, JUNG,KYUNG HWA, PARK,MI RAN, KIM,YOUNGSOO.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C12N9/80 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre los enlaces amida de las amidas alifáticas.
- C12P35/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 35/00 Preparación de compuestos que contienen un sistema cíclico 5-tia, 1-aza biciclo [4.2.0] octano, p. ej. cefalosporina. › por desacilación del sustituyente en posición 7.
Clasificación PCT:
Clasificación antigua:
- C12N15/55 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Hidrolasas (3).
- C12N9/14 C12N 9/00 […] › Hidrolasas (3.).
Fragmento de la descripción:
Mutante de cefalosporina C acilasa y su utilización para preparar 7-ACA.
Campo de la invención
La presente invención se relaciona con un polipéptido mutante de cefalosporina C (CPC) acilasa derivado de Pseudomonas sp. SE83; con un gen que codifica dicho polipéptido; con un vector de expresión que contiene dicho gen; con un microorganismo transformado con dicho vector de expresión; con un método para preparar dicho mutante de CPC acilasa; y con un método para preparar 7-ACA utilizando dicho mutante de CPC acilasa.
Antecedentes de la invención
La cefalosporina C (de ahora en adelante denominada como "CPC") es uno de los antibióticos de la familia de la ß-lactama producido por hongos filamentosos tales como Acremonium chrysogenum. La CPC muestra actividad antibiótica contra bacterias Gram negativas obstaculizando la síntesis de la pared celular, pero no es lo suficientemente activa contra el crecimiento de bacterias Gram negativas. Por lo tanto, la CPC ha sido utilizada principalmente para preparar intermediarios para la producción de antibióticos semisintéticos de cefalosporina. En particular, se ha utilizado al ácido 7-aminoacefalosporánico (de ahora en adelante denominado como "7-ACA") preparado por remoción de la cadena lateral de D-a-aminoadipoilo de la CPC para la producción de la mayoría de los antibióticos semisintéticos de cefalosporina que representa más del 40% del mercado mundial de antibióticos.
Existen dos métodos conocidos para preparar 7-ACA a partir de CPC, el método químico y el método enzimático. El método químico para sintetizar 7-ACA a partir de CPC utiliza grupos de protección sililo tanto para grupos amina como carboxilo y produce un rendimiento superior al 90%. Sin embargo, este método es complicado, costoso y ambientalmente desfavorable. Por lo tanto, el método químico ha sido reemplazado por un método enzimático para la preparación de 7-ACA el cual es considerado como un método ambientalmente aceptable.
Un método enzimático de dos etapas ampliamente utilizado comercialmente hoy en día comprende las dos etapas de convertir la CPC en ácido glutaril-7-aminocefalosporánico (de ahora en adelante denominado como "GL-7-ACA") por medio de la D-amino ácido oxidasa (de ahora en adelante denominada como "DAO") (la primera etapa) y GL-7-ACA en 7-ACA por medio de la GL-7-ACA acilasa (la segunda etapa) (ver la Fig. 1). Sin embargo, este método produce un rendimiento más bajo de 7-ACAque el método químico, debido a la gran cantidad de subproductos generados por la reacción del peróxido de hidrógeno producido en la primera etapa con el sustrato DAO o el producto de la reacción. Por lo tanto, existe la necesidad de desarrollar un método enzimático eficiente en una etapa para convertir directamente CPC en 7-ACA utilizando una CPC acilasa modificada que es capaz de romper un enlace amida en la séptima posición de la CPC y remover la cadena lateral de aminoadipoilo.
La CPC acilasa (también llamada CPC amidasa o CPC amidohidrolasa) activa con respecto a la CPC ha sido encontrada en varios microorganismos, tales como Pseudomonas sp., Bacillus megaterium, Aeromonas sp., Arthrobacter viscous etc., y se han clonado y secuenciado algunos genes para la CPC acilasa: gen acyII derivado de Pseudomonas sp. SE83 (Matsuda y colaboradores, J. Bacteriol. 169: 5821 -5829, 1987); gen para la CPC acilasa derivado de Pseudomonas sp. N176 (patente estadounidense No. 5.192.678); gen para la CPC acilasa derivado de Pseudomonas sp. V22 (Aramori y colaboradores, J. Ferment. Bioeng. 72: 232 - 243, 1991); gen para la CPC amidohidrolasa derivado de Pseudomonas vesicularis B965 (patente estadounidense No. 6.297.032); gen para la CPC amidasa derivado de Bacillus megaterium (patente estadounidense No. 5.229.274); y gen para la CPC acilasa derivado de Pseudomonas sp. 130 (Li y colaboradores, Eur. J. Biochem. 262: 713 - 719, 1999). Sin embargo, estas CPC acilasas no son hidrolíticamente suficientemente activas para escindir el enlace amida en la séptima posición de la CPC, y por lo tanto, no son adecuadas para el proceso enzimático en una etapa para preparar 7-ACA a partir de CPC.
Varios estudios a través de ingeniería genética han intentado incrementar la actividad de la enzima de la CPC acilasa con respecto a la CPC. Por ejemplo, Fujisawa Pharmaceutical Co. (Japón) desarrolló un mutante de CPC acilasa derivada de Pseudomonas sp. N176 que muestra aproximadamente 2,5 veces mayor actividad específica con respecto a la CPC que aquella de tipo silvestre (patente estadounidense No. 5.804.429; patente estadounidense No. 5.336.613, Publicación de Patente Japonesa No. 1995-222587; Publicación de Patente Japonesa No. 1996-098686; y Publicación de Patente Japonesa No. 1996-205864). Sin embargo, tal mutante aún tiene una actividad específica insuficiente con respecto a la CPC para producir directamente 7-ACA a partir de CPC y exhibe inhibición del producto final por 7-ACA. Por lo tanto, no puede ser utilizado en forma práctica en la conversión directa de la CPC en 7-ACA.
Con el propósito de desarrollar un mutante de CPC acilasa aplicable a un método enzimático en una etapa para preparar 7-ACA, se ha investigado la estructura terciaria de la GL-7-ACA acilasa por parte de los presentes inventores, quienes han identificado por primera vez las estructuras terciarias de apoenzima (Kim, y colaboradores, Structure 8: 1059 - 1068, 2000) y el complejo CAD- GL-7-ACA (Kim, y colaboradores, Chem. Biol. 8: 1253 - 1264, 2001; Kim, y colaboradores, J. Biol. Chem. 276: 48376 - 48381, 2001) asociados con la GL-7-ACA acilasa derivada de Pseudomonas sp. KAC-1 (Kim, y colaboradores, Biotech. Lett. 23: 1067 - 1071, 2001; de ahora en adelante denominada como "CAD") (ver la Fig. 2). Las estructuras de los dos complejos binarios CAD sugieren que las interacciones más grandes entre la GL-7-ACA acilasa y un sustrato tuvieron lugar en la fracción glutarilo de GL-7-ACA. Por lo tanto, se sugiere que las interacciones hidrofílicas e hidrofóbicas entre la cadena lateral del sustrato y su bolsillo de unión son los factores dominantes en el reconocimiento del sustrato en GL-7-ACA acilasa. Cuando las estructuras químicas de la CPC tienen afinidad de enlazamiento con el sustrato extremadamente baja y se comparan GL-7-ACA, sus estructuras de ß-lactama son iguales, pero existen algunas diferencias en la cadena lateral (ver la Fig. 3). Es decir, a diferencia de la cadena lateral de GL-7-ACA que está compuesta de ácido glutárico, aquella de la CPC es un ácido D-a-aminoadípico. Por lo tanto, la modelación de la estructura del complejo CAD-CPC sugiere que la cadena lateral de ácido glutárico de GL-7-ACA y los residuos clave relacionados con el enlazamiento de CAD están estéricamente apiñados con respecto a los grupos carboxilo y amino de forma D en el extremo terminal de la cadena lateral del ácido D-a-aminoadípico (ver la Fig. 4). De este modo, si se puede garantizar suficiente espacio para acomodar la cadena lateral de CPC (que contiene un esqueleto carbonado mayor que aquel de la cadena lateral de GL-7-ACA y el grupo D-amino) en el sitio de enlazamiento del sustrato de CAD, se considera que se puede incrementar la actividad específica de GL-7-ACA para la CPC. Por lo tanto, el análisis estructural del complejo "enzima-sustrato" de CAD puede proporcionar información importante para desarrollar un mutante de CPC acilasa que tiene una mayor actividad específica con respecto a CPC por medio de la introducción de las mutaciones en el sitio activo de la GL-7-ACA acilasa derivada de Pseudomonas sp. que muestra relativamente baja afinidad de enlazamiento con el sustrato.
WO 02/072806A2 describe la conversión directa de cefalosporina C en 7-ACA por medio del uso de glutaril amidasa mutada.
Ishii, Y. y colaboradores, Eur. J. Biochem. 230, 773 - 778 (1995) describen el uso de una CPC acilasa mutada de la cepa N176 de Pseudomonas para la conversión de cefalosporina C en 7-ACA.
Los presentes inventores se han esforzado por lo tanto para desarrollar un mutante de CPC acilasa que tiene una reactividad mejorada con respecto a CPC que puede ser utilizada en un método enzimático de una etapa para preparar 7-ACA a partir de CPC.
Resumen de la invención
Por lo tanto, un objetivo de la presente invención es la de proporcionar un mutante de CPC acilasa que tiene reactividad mejorada con respecto a CPC que puede ser convenientemente utilizada para convertir CPC en 7-ACA y una CPC acilasa funcionalmente equivalente derivada de la misma.
Otro objetivo de la presente...
Reivindicaciones:
1. Un mutante de una CPC acilasa compuesto de una subunidad a de acuerdo con la SEQ ID NO: 4 y una subunidad ß de acuerdo la SEQ ID NO: 5, o un derivado del mismo de CPC acilasa funcionalmente equivalente, caracterizado porque al menos un aminoácido seleccionado del grupo que consiste de Val121a, Gly139a y Phe169a de la subunidad a de CPC acilasa de la SEQ ID NO: 4 y Phe58ß, His70ß, Ile75ß, Ile176ß y Ser471ß de la subunidad ß de CPC acilasa de la SEQ ID NO: 5 es reemplazado por otro aminoácido, en donde el mutante de CPC acilasa o el derivado del mismo de CPC acilasa funcionalmente equivalente cataliza la conversión de un compuesto de Fórmula I hasta un compuesto de Fórmula II:
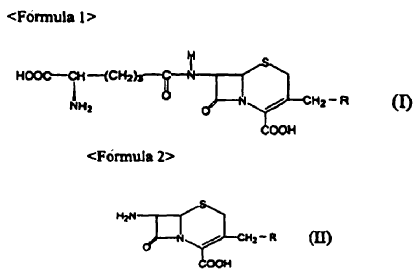
en donde, R es acetoxi (-OCOCH3), hidroxi (-OH), hidrógeno (-H) o una sal del mismo.
2. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 1, en donde el mutante de CPC acilasa o el derivado del mismo de CPC acilasa funcionalmente equivalente cataliza la conversión de CPC en 7-ACA.
3. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 1 ó 2, en donde:
4. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 3, en donde Phe58ß es reemplazado por alanina, metionina, leucina, valina, cisteína o asparagina, y además Met31ß es reemplazado por leucina.
5. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 4, en donde His70ß es reemplazado adicionalmente por serina o leucina.
6. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 5, en donde Phe169a es reemplazado adicionalmente por tirosina.
7. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 6, en donde Ile176ß es reemplazado adicionalmente por valina.
8. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 4, en donde Phe169a es reemplazado adicionalmente por tirosina e Ile176ß es reemplazado adicionalmente por valina.
9. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 8, en donde Val121a es reemplazado adicionalmente por alanina.
10. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 8, en donde Gly139a es reemplazado adicionalmente por serina.
11. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 8, en donde Val121a es reemplazado adicionalmente por alanina y Gly139a es reemplazado adicionalmente por serina.
12. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 3, en donde Val121a es reemplazado por alanina; Gly139a es reemplazado por serina; Phe58ß es reemplazado por alanina, metionina, leucina, valina, cisteína o asparagina; e Ile176ß es reemplazado por valina.
13. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 12, en donde Phe169a es reemplazado adicionalmente por tirosina.
14. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 12, en donde Ile75ß es reemplazado adicionalmente por treonina.
15. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 12, en donde Ser471ß es reemplazado adicionalmente por cisteína.
16. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 12, en donde Ile75ß es reemplazado adicionalmente por treonina y Ser471ß es reemplazado adicionalmente por cisteína.
17. El mutante de CPC acilasa o un derivado de acuerdo con la reivindicación 16, el cual tiene una secuencia de aminoácidos que comprende una subunidad a de CPC acilasa de la SEQ ID NO: 7 y una subunidad ß de CPC acilasa de la SEQ ID NO: 8.
18. Un gen que codifica al mutante de CPC acilasa o un derivado de CPC acilasa funcionalmente equivalente del mismo como se define en cualquiera de las reivindicaciones 1 a 17.
19. El gen de acuerdo con la reivindicación 18, que tiene la secuencia de nucleótidos descrita por la SEQ ID NO: 6.
20. El gen de acuerdo con la reivindicación 18, en donde el gen codifica
21. Un vector de expresión recombinante que contiene al gen de cualquiera de las reivindicaciones 18 a 20.
22. El vector de expresión recombinante de acuerdo con la reivindicación 21, que es pET29-S12.
23. Un microorganismo transformado con el vector de expresión recombinante de la reivindicación 21.
24. El microorganismo de acuerdo con la reivindicación 23, que es BL21(DE3) de E. coli (pET29-S12) (Acceso No: KCTC 10503BP).
25. Un método para preparar el mutante de CPC acilasa o un derivado de cualquiera de las reivindicaciones 1 a 17, que comprende las etapas de cultivar el microorganismo de las
reivindicaciones 23 ó 24 bajo una condición adecuada y recuperar al mutante de CPC acilasa o un derivado a partir de caldo de cultivo.
26. El método de acuerdo con la reivindicación 25, que comprende además la etapa de añadir lactosa al caldo de cultivo como un inductor en la primera etapa del cultivo.
27. El uso de una composición que comprende al mutante de CPC acilasa o un derivado de cualquiera de las reivindicaciones 1 a 17 para preparar 7-ACA por medio de un método enzimático en una etapa.
28. Un método para preparar el compuesto de Fórmula II, que comprende la etapa de poner en contacto un compuesto de Fórmula I con el mutante de CPC acilasa o un derivado de cualquiera de las reivindicaciones 1 a 17:

en donde, R es acetoxi (-OCOCH3), hidroxi (-OH), hidrógeno (-H), o una sal del mismo.
29. El método de acuerdo a la reivindicación 28, en donde el mutante de CPC acilasa o un derivado es utilizado en la forma de un caldo de cultivo del microorganismo de la reivindicación 23 ó 24, una composición que comprende al mutante de CPC acilasa o al derivado de las reivindicaciones 1 a 17, una forma libre del mutante de CPC acilasa o derivado purificado a partir de la solución del cultivo, o una forma inmovilizada del mutante de CPC acilasa o derivado.
30. El método de acuerdo a la reivindicación 28, en donde la reacción de contacto del compuesto de Fórmula I con el mutante de CPC acilasa o derivado se lleva a cabo en una solución acuosa.
31. El método de acuerdo a la reivindicación 28, en donde la concentración de compuesto de Fórmula I está en el rango entre 1 y 500 mM y la cantidad añadida del mutante de CPC acilasa o derivado está en el rango entre 0,1 y 100 U/Ml.
32. El método de acuerdo a la reivindicación 28, en donde la reacción de contacto del compuesto de Fórmula I con el mutante de CPC acilasa o derivado se lleva a cabo a pH de 7 a 10, 4 a 40ºC durante 0,1 a 24 h.
Patentes similares o relacionadas:
Uso de peptidilarginina deiminasa para solubilizar proteínas, opcionalmente también para reducir su tendencia a la formación de espuma, del 1 de Julio de 2020, de DSM IP ASSETS B.V.: Uso de peptidil arginina deiminasa (EC 3.5.3.15) para mejorar la solubilidad de una proteína vegetal a un pH de entre 5 y 8,5, en el que la proteína vegetal es guisante, […]
Procedimiento y composiciones ecológicas para la producción de productos químicos de poli(5HV) y de 5 carbonos, del 7 de Junio de 2017, de CJ Research Center LLC: Un organismo no humano recombinante modificado por ingeniería genética para convertir 5-aminopentanoato en un polímero de polihidroxialcanoato (PHA) o en un copolímero […]
Composiciones a base de Arthrospira y usos de las mismas, del 7 de Junio de 2017, de BIOVITE AUSTRALIA PTY LTD: Un método para preparar una composición biocida para uso tópico en un sujeto, comprendiendo dicho método las etapas de: 1) estresar […]
Procedimiento para la selección y la producción de entidades de objetivación, como dianas, altamente selectivas y multiespecíficas, personalizadas, las cuales contienen por lo menos dos entidades de unión diferentes, y utilización de éstas, del 14 de Septiembre de 2016, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para producir un anticuerpo biespecífico, el cual comprende la etapa de incubar (i) un fragmento de anticuerpo Fab, o un anticuerpo […]
Aumento del rendimiento de la metionina, del 3 de Agosto de 2016, de METABOLIC EXPLORER: Procedimiento para la producción de metionina y su derivado la N-acetil metionina, en un proceso fermentativo que comprende las etapas siguientes: […]
Acilasas de beta-lactama de tipo II mutantes, del 2 de Marzo de 2016, de DSM Sinochem Pharmaceuticals Netherlands B.V: Una acilasa de beta-lactama de tipo II mutante seleccionada del grupo que consiste en la acilasa SE83-acil de Pseudomonas según se representa en la SEQ ID NO: […]
Anticuerpos de esfingosina-1-fosfato para el tratamiento de enfermedades asociadas con elevadas concentraciones de esfingolípidos, del 6 de Agosto de 2014, de Lpath, Inc: El uso de un anticuerpo que se une a esfingosina-1-fosfato (S-1-P) en la fabricación de un medicamento para el tratamiento de una enfermedad o trastorno seleccionado del grupo […]
Enzimas lisantes de la pared celular estables frente a proteasas, del 23 de Octubre de 2013, de HYGLOS INVEST GMBH: Variante polipeptídica del polipéptido de acuerdo con la SEQ ID Nº: 1, seleccionándose la variante polipeptídica del grupo que consiste en: SEQ ID Nº: […]