DISPOSITIVO DE HIPERTERMIA Y SU UTILIZACION CON NANOPARTICULAS.
Dispositivo de hipertermia y su utilización con nanopartículas.
El objeto de la presente invención consiste en un dispositivo de hipertermia que comprende un generador de campos electromagnéticos de radiofrecuencia, un amplificador de dicha señal, un transmisor del campo electromagnético que se genera y un sistema de medida directa de la temperatura, que se utiliza junto con una o más nanopartículas capaces de disipar la energía del campo electromagnético aplicado en forma de calor pudiéndose controlar la temperatura de éstas de una forma directa
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200702084.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS.
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: FERNANDEZ CAMACHO,MARIA ASUNCION, MUOZ MARQUEZ,MIGUEL ANGEL, GUERRERO GARCIA,ESTEFANIA.
Fecha de Solicitud: 26 de Julio de 2007.
Fecha de Publicación: .
Fecha de Concesión: 19 de Febrero de 2010.
Clasificación Internacional de Patentes:
- A61K49/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones para examen in vivo.
Clasificación PCT:
- A61K49/00 A61K […] › Preparaciones para examen in vivo.
Fragmento de la descripción:
Dispositivo de hipertermia y su utilización con nanopartículas.
Sector de la técnica
La presente invención se enmarca dentro del campo de la nanotecnología y la modificación de sistemas nanoestructurados en cualquier aplicación en la que se necesite calentar una región determinada de forma controlada, y dentro del campo de la biomedicina en aplicaciones como la liberación controlada de fármacos, el tratamiento de tumores, o la amiloidosis entre otras.
Estado de la técnica
La terapia térmica consiste en aumentar la temperatura de los tejidos vivos hasta conseguir su muerte. Este tipo de tratamientos se puede clasificar en dos grandes grupos: por una parte la hipertermia, en la que las temperaturas llegan a los 46ºC y por otra la ablación térmica en la que la temperatura supera los 47ºC. La terapia térmica, y en particular la hipertermia, se ha utilizado para intensificar los tratamientos de radio y quimioterapia; los tejidos tumorales son más sensibles al calor que los tejidos sanos, a esto hay que sumar que el incremento de temperatura provoca que las células cancerígenas sean todavía más sensibles a los tratamientos de quimioterapia y radiación. En oncología experimental y clínica ya se han utilizado tratamientos de hipertermia para elevar la temperatura de zonas tumorales hasta los 42-46ºC. Otra posible aplicación de la hipertermia en el campo de la biomedicina consiste en controlar la agregación de proteínas que forman unos depósitos en los tejidos llamados amiloides. Si se acumulan en una cantidad suficiente, estos depósitos pueden alterar el funcionamiento normal del tejido. La amiloidosis está relacionada con enfermedades como la diabetes mellitus, tuberculosis y artritis reumatoide, también existen evidencias relacionando la amiloidosis con enfermedades neurodegenerativas como el alzheimer y el parkinson.
Las nanopartículas magnéticas se han utilizado en la diagnosis y monitorización del crecimiento de tumores. Estas partículas debido a sus propiedades magnéticas han servido para mejorar notablemente el contraste en las imágenes de resonancia magnética nuclear. Otro campo en el que se han empleado nanopartículas es en la liberación controlada de fármacos, concentrándolas en la zona afectada mediante campos magnéticos.
Actualmente existen diversos dispositivos de hipertermia por microondas aplicados al tratamiento de tejidos tumorales. Estos dispositivos no emplean nanopartículas, irradian directamente los tejidos enfermos con un campo de microondas que a nivel local tiene efectos destructores. Este método se conoce con el nombre de hipertermia intersticial.
Los sistemas de hipertermia intersticial son bastante agresivos con el organismo ya que para controlar al máximo el área irradiada se deben implantar antenas en los tejidos por métodos quirúrgicos, por ejemplo mediante un catéter (R.S. Kasevich, S.M. Selkowitz, US 006097985A), o mediante la inserción de un electrodo activo de radiofrecuencia en el tejido tumoral que libera la energía del campo electromagnético (S.D. Edwards, H.R. Sharkey, US Patent No. 005507743A).
Como alternativa a estas técnicas agresivas, se han propuesto unos tratamientos de hipertermia basados en el uso de fluidos magnéticos como medio para disipar el calor en los tejidos vivos. Estos fluidos están compuestos por partículas finas o nanopartículas magnéticas biocompatibles estabilizadas para evitar que se formen agregados. Este tipo de procedimientos tiene la ventaja de que no implica la implantación quirúrgica de antenas o electrodos en los tejidos enfermos; sino que emplea fluidos magnéticos como por ejemplo, nanopartículas de magnetita (R. Hergt, W. Andrä, C.G. d'Ambly, I. Hilger, W.A. Kaiser, U. Richter, H-G. Schmidt, IEEE Trans. Mag. 34 (1998) 3745), material que posee una biocompatibilidad aceptable, por lo que resulta un candidato ideal para la preparación de fluidos magnéticos. En este caso, los mecanismos de disipación de la energía en forma de calor están principalmente relacionados con pérdidas por histéresis, y pérdidas por relajación y fricción; no existiendo pérdidas por corrientes inducidas de Foucault. Cada uno de estos fenómenos se detalla a continuación:
Las propiedades magnéticas de las nanopartículas dependen de manera significativa de su tamaño y estructura. Sobre los fluidos ferromagnéticos se han llevado a cabo investigaciones de hipertermia inducida por radiofrecuencia en células in-vitro (N.A. Brusentsov, V.V. Gogosov, T.N. Brusentsova, A.V. Sergeev, N.Y. Jurchenko, A.A. Kuznetsov, O.A. Kuznetsov, L.I. Shumakov, J. Magn. Magn. Mater. 225 (2001) 113) y en tumores sólidos en humanos (A. Jordan, R. Scholz, K. Maier-Hauff, M. Johannsen, P. Wust, J. Nadobny, H. Schirra, H. Schhmidt, S. Deger, S. Loening, W. Lanksch, R. Felix, J. Magn. Magn. Mater. 225 (2001) 118).
Desafortunadamente, el control de la temperatura en la zona tumoral hasta el momento ha resultado ser muy complicado. Existiendo el riesgo de llegar a una situación de sobrecalentamiento que dañe también los tejidos sanos. Para solventar este problema, recientemente se ha desarrollado un tipo diferente de nanopartículas magnéticas, con una temperatura de Curie (temperatura por encima de la cual un cuerpo ferromagnético pierde su magnetismo, comportándose como un material puramente paramagnético) comprendida entre los 40 y los 46ºC para su posible aplicación en tratamientos médicos de hipertermia (Y. Haik, C-J. Chen, US Publication No. 2005/0249817 A1)....
Reivindicaciones:
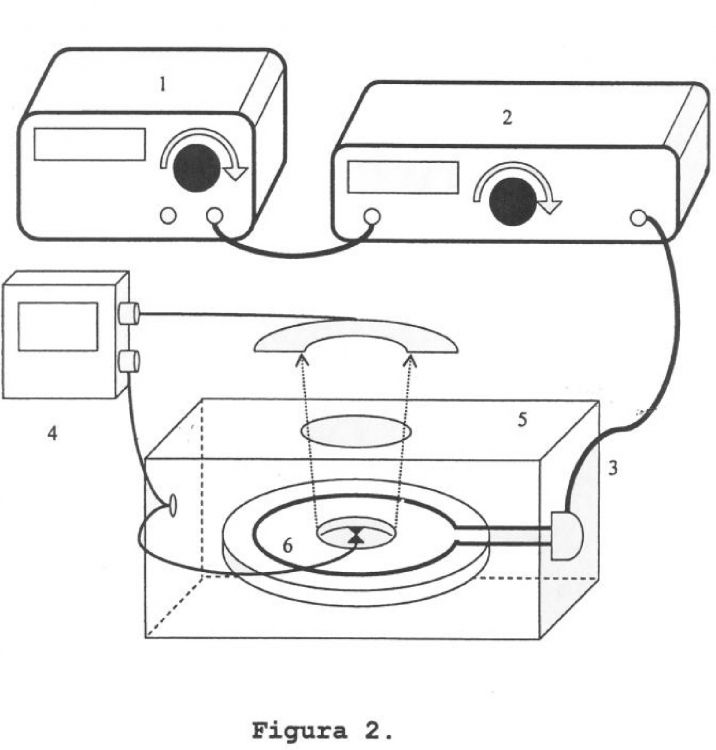
1. Dispositivo de hipertermia para calentar una o más nanopartículas que comprende los siguientes elementos:
2. Dispositivo de acuerdo con la reivindicación 1 caracterizado porque adicionalmente comprende una caja de Faraday (5) que encierra los elementos 1),2),3) y 4), para apantallar radiaciones en el caso de utilizarse frecuencias que puedan interferir con los dispositivos electrónicos y/o afectar a las personas.
3. Dispositivo según las reivindicaciones 1-2, caracterizado porque el generador del campo electromagnético de radiofrecuencia puede ser un dispositivo analizador de redes, que además de generar la señal permite determinar impedancias, coeficientes de reflexión y transmisión y pérdidas por inserción.
4. Dispositivo según las reivindicaciones 1-3, caracterizado porque el generador de campo electromagnético es capaz de generar una señal de radiofrecuencia que está en el intervalo definido entre las señales de muy baja frecuencia (VLF) y las señales de súper alta frecuencia (SHF), además de producir un campo electromagnético con una intensidad controlada.
5. Dispositivo según las reivindicaciones 1-4, caracterizado porque el transmisor del campo electromagnético es capaz de focalizar y concentrar el campo electromagnético en una región del espacio concreta.
6. Dispositivo de acuerdo con las reivindicaciones 1-5 caracterizado porque el sistema de medida de la temperatura lo hace de forma directa, preferentemente mediante infrarrojos o un sistema basado en el efecto Seebeck.
7. Dispositivo, según cualquiera de las reivindicaciones 1-6 caracterizado porque la nanopartícula o nanopartículas que se calientan son susceptibles de ser calentadas bajo la acción de campos electromagnéticos de radiofrecuencia.
8. Dispositivo según la reivindicación 7 caracterizado porque la nanopartícula o nanopartículas son de carácter metálico y/o magnético, preferentemente nanopartículas de metales nobles funcionalizadas.
9. Dispositivo según las reivindicaciones 7 y 8 caracterizado porque las nanopartículas se funcionalizan a través de enlaces metal-azufre con moléculas orgánicas o biomoléculas.
10. Dispositivo según las reivindicaciones 7 y 8 caracterizado porque las nanopartículas de metales nobles están funcionalizadas a través de enlaces metal-ligando.
11. Dispositivo según las reivindicaciones 7 y 8 caracterizado porque las nanopartículas de metales nobles están protegidas por moléculas de surfactante con estabilización a través de interacciones dipolares.
12. Dispositivo según la reivindicación 7 caracterizado porque las nanopartículas magnéticas están funcionalizadas directamente o funcionalizadas a través de una cubierta de metal noble.
13. Uso del dispositivo según las reivindicaciones 1-12, para producir calentamiento y otros efectos de hipertermia en una o varias nanopartículas capaces de ser calentadas bajo la acción de campos electromagnéticos de radiofrecuencia.
14. Uso del dispositivo según las reivindicaciones 1- 12 para calentar de forma controlada una región de un sistema preferentemente en aplicaciones relacionadas con la modificación de sistemas nanométricos y en biomedicina.
15. Uso del dispositivo según las reivindicaciones 1-12 en tratamientos de hipertermia en biomedicina aplicados preferentemente a la destrucción localizada de tumores y la destrucción de agregados proteínicos en amiloidosis.
16. Uso del dispositivo, según las reivindicaciones 1-12, en tratamientos de hipertermia para la liberación controlada de fármacos.
17. Uso del dispositivo según las reivindicaciones 1-12, para la investigación del origen del calentamiento de una o varias nanopartículas bajo la acción de campos electromagnéticos.
18. Uso del dispositivo según las reivindicaciones 1-12 para el desarrollo de nuevos transmisores del campo que concentren y direccionen el campo electromagnético de radiofrecuencia.
Patentes similares o relacionadas:
Molécula de colorante y preparados de colorante, en particular para su uso en métodos quirúrgicos de cirugía oftálmica y para teñir proteínas, del 15 de Julio de 2020, de AL.CHI.MI.A. S.R.L.: Una molécula de colorante que tiene la estructura: **(Ver fórmula)** donde: R1 está conformado por un grupo SO3- unido con un enlace […]
Sonda fluorescente para detectar dipeptidil peptidasa IV, del 3 de Junio de 2020, de The University of Tokyo: Una sonda fluorescente para detectar la dipeptidil peptidasa IV (DPP-IV) que comprende un compuesto representado por la siguiente fórmula (I) o una sal del mismo: **(Ver […]
Kit y método para detectar hidroxiapatita dental porosa, del 27 de Mayo de 2020, de Incisive Technologies Pty Ltd: Una sonda para su uso en un método de detección de una afección in vivo que implica hidroxiapatita dental porosa, que comprende: un indicador coloreado […]
Composiciones para administración por vía oral que comprende una variante de una proteína de pliegue OB, del 29 de Abril de 2020, de AFFILOGIC: Composición para la administración por vía oral para un uso terapéutico o diagnóstico, que comprende una variante de una proteína salvaje de pliegue OB, presentando […]
Marcador molecular para células madre cancerosas, del 29 de Abril de 2020, de Sapporo Medical University: Un péptido seleccionado del grupo que consiste en: DNAJB8 : AFMEAFSSF (SEQ ID NO: 71); DNAJB8 : AYRKLALRW (SEQ ID NO: 68); y DNAJB8 : […]
Cepas bacterianas que expresan genes de metilasa y sus usos, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una bacteria aislada para usar en la producción de ADN plasmídico metilado, en donde la bacteria comprende un polinucleótido exógeno que codifica una CpG metilasa […]
Composición de imagen de cartílago articular, del 8 de Abril de 2020, de Mercury Asset Management Co., Ltd: Una composición adecuada para uso en la visualización de una zona degenerativa de cartílago articular, que se caracteriza por contener una albúmina […]
Variantes de clorotoxina, conjugados y métodos para su utilización, del 8 de Abril de 2020, de FRED HUTCHINSON CANCER RESEARCH CENTER: Conjugado de clorotoxina que comprende un péptido de clorotoxina acoplado covalentemente a un marcador fluorescente seleccionado del grupo que consiste […]