CRIOPRESERVACION CELULAR POR VITRIFICACION CON BAJAS CONCENTRACIONES DE CRIOPROTECTOR.
Criopreservación celular por vitrificación con bajas concentraciones de crioprotector.
El objeto de la presente invención se refiere a un nuevo procedimiento de criopreservación celular, que consigue la vitrificación de las muestras biológicas con presencia de bajas concentraciones de crioprotecto. El procedimiento se basa en el uso de la convección forzada con el objetivo de aumentar la transferencia de calor y alcanzar muy altos ritmos de enfriamiento y recalentamiento que eviten la nucleación y el crecimiento de cristales de hielo
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200702565.
Solicitante: UNIVERSIDAD DE SEVILLA.
Nacionalidad solicitante: España.
Provincia: SEVILLA.
Inventor/es: RISCO DELGADO,RAMON, OLMO FERNANDEZ,ALBERTO, SAENZ CUESTA,JAIME LUIS.
Fecha de Solicitud: 27 de Septiembre de 2007.
Fecha de Publicación: .
Fecha de Concesión: 27 de Enero de 2010.
Clasificación Internacional de Patentes:
- A01N1/02 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 1/00 Conservación de cuerpos humanos o animales, o partes de ellos. › Conservación de partes vivas.
- C12N5/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
Clasificación PCT:
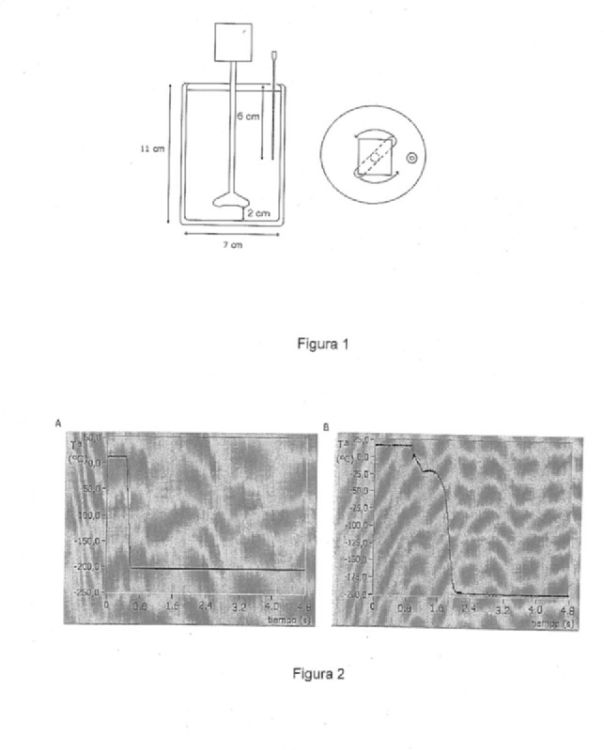
Fragmento de la descripción:
Criopreservación celular por vitrificación con bajas concentraciones de crioprotector.
Objeto de la invención
El objeto de la presente invención se refiere a un nuevo procedimiento de criopreservación celular, que consigue la vitrificación de las muestras biológicas con presencia de bajas concentraciones de crioprotector. El procedimiento se basa en el uso de la convección forzada con el objetivo de aumentar la transferencia de calor y alcanzar muy altos ritmos de enfriamiento y recalentamiento que eviten la nucleación y el crecimiento de cristales de hielo.
Estado de la técnica
Dos técnicas son las que actualmente se han desarrollado, con multitud de variantes, con el objetivo de conseguir la conservación celular: el enfriamiento lento y la vitrificación.
El enfriamiento lento es, con diferencia, el procedimiento más usado. Se basa en el control de la tasa de enfriamiento con el objetivo de crear un delicado equilibrio entre los distintos factores que causan daño celular, entre los que se encuentran la formación de hielo, fracturas y una excesiva deshidratación de la célula.
En los últimos años ha aparecido otra técnica, la vitrificación, que mejora en gran medida la técnica del enfriamiento lento, pues elimina completamente la formación de cristales de hielo, los cuales suponen el mayor obstáculo para la criopreservación de células vivas. Actualmente, se considera la vitrificación como el futuro de la criopreservación celular [Gábor Vajta, Masashige Kuwayama, Improving cryopreservation systems, Theriogenology 65 (2006), 236-244]. Sin embargo, la técnica todavía necesita ser mejorada para muchos tipos celulares, como por ejemplo oocitos, en los que su vitrificación y posterior fertilización ha resultado hasta el momento en tan sólo 16 nacimientos de niños [David K. Gardner, In vitro fertilization, a practical approach, Taylor & Francis; Edition: 1 (29 september 2006]. La vitrificación de células madre, otro de los tipos celulares más interesantes de criopreservar, de un gran potencial para la medicina regenerativa, apenas ha empezado a llevarse a la práctica [S.S. Gouk, C.K.F. Tan, M.P. Hande, A. Poonepalli, G.S. Dawe and Lilia L. Kuleshova, Protein and serum free vitrification of neural ítem cells, Criobiology, Volume 53, Sigue 3, December 2006, Page 389] y una gran experimentación será necesaria antes de que pueda ser utilizada eficientemente.
La vitrificación es un proceso mediante el cual un líquido se solidifica en una fase no cristalina (fase vítrea) con un rápido descenso de la temperatura y un aumento en la viscosidad. Varios factores afectan la probabilidad de conseguir una adecuada vitrificación: viscosidad de la muestra, ritmo de enfriamiento y calentamiento, y volumen de la muestra [S. Llavín, A. Arav, Measurement of essential physical properties of vitrification solutions, Theriogenology 2007; 67; 81-89].
Con el objetivo de incrementar la viscosidad de la muestra se utilizan los llamados agentes vitrificantes, también llamados crioprotectores, por su relación con la protección celular. Con algunos de ellos, como el dimetilsulfóxido o el etilenglicol se han conseguido buenos resultados [(Rall WF, Fahy GM: Ice-fre cryopreservation of mouse. embryos at -196 by vitrification. Nature 1985;313:573-. 575); (T. Takahashi, A. Hirsh, E. F. Erbe, J. B. Bross, R. L. Steere and R. J. Williams Vitrification of human monocytes, Cryobiology, Volume 23, Issue 2, April 1986, Pages 103-115)]. Sin embargo, las altas concentraciones necesarias de estos agentes crioprotectores para alcanzar la vitrificación resultan en una alta toxicidad que impide su viabilidad en muchos protocolos de criopreservación celular.
El incremento del ritmo de enfriamiento y calentamiento aumenta la probabilidad de una adecuada vitrificación, y hace necesario unas menores concentraciones de agentes crioprotectores. La técnica más usada para conseguir altas velocidades de enfriamiento ha sido la inmersión de la muestra en nitrógeno líquido. Es necesario conseguir una eficiente transmisión de calor entre el nitrógeno líquido y el material celular, para maximizar la velocidad de enfriamiento. Con este objetivo, diferentes contenedores han sido aplicados para introducir células en nitrógeno líquido, entre las que encontramos rejillas de cobre utilizadas en microscopia electrónica [Martino A, Songsasen N, Leibo S. P, Developement into blastocysts of bovine oocytes cryuopreserved by ultrarapid cooling, Biol Reprod 1996;54;1059-1069,], capilares OPS [Vajta, G, Booth PJ, Holm P, Greve T, Callesen H, Succesful vitrification of early stage bovine in vitro produced embryos with the open pulled straw (OPS) method, Cryo-Letters 1997;18;191-195] (Open Pulled Straws, capilares de PVC convencionales estirados hasta tener un diámetro interior de 0.800 mm y un espesor de la pared de 0.075 mm) o los llamados cryoloops [Lane M, Schoolcraft WB, Gardner DK, Vitrification of mouse and human blastocysts using a novel ctyoloop container-less technique, Fertil Steril, 1999;72;1073-1078], lazos de nylon en los que se suspende una película de solución conteniendo las células. Sin embargo, la velocidad de enfriamiento conseguida mediante estos procedimientos necesita aún una alta concentración de crioprotectores para producir la vitrificación [Gábor Vajta, Masashige Kuwayama, Improving cryopreservation systems, Theriogenology 65 (2006), 236-244]. Para conseguir unos mejores resultados en la vitrificación se puede utilizar nitrógeno líquido subenfriado, llamado "slush", el cual está a una temperatura de -210ºC, inferior al nitrógeno líquido, y en el que se consigue disminuir el efecto Leidenfrost (formación de una capa de vapor alrededor de la muestra que impide una eficiente transferencia de calor). La introducción de los contenedores celulares anteriormente nombrados en slush suponen una velocidad de enfriamiento de 10.000ºC/min o unos 20.000ºC/min (dependiendo del autor, [M.A. Nowshari and G. Bren, Effect of freezing rate and exposure time to cryoprotectant on the development of mouse pronuclear stage embryos, Human Reproduction 15 (2001), 2368-2373]; [G. Vajta, P. Holm, T. Greve and H. Callesen, Vitrification of porcine embryos using the Open Pulled Straw (OPS) method, Acta Vet. Scand. 38 (1997) 349-352]) para OPS, y similares resultados para el caso de cryoloops [T. Mukaida, S. Nakamura, T. Tomiyama, S. Wada, M. Kasai and K. Takahashi, Succesful birth alter transfer of vitrified human blastocysts with us of a cryoloop containerless technique, Fertil. Steril. 76 (2001) 618-620] o rejillas de cobre [P. L. Steponkus, S. P. Myers and D. V. Lynch, et al, Cryopreservation of Drosophila melanogaster embryos, Nature 345 (1990) 170-172], resultados que, aunque interesantes, siguen sin ser suficientes para conseguir una adecuada vitrificación para muchos tipos celulares.
El proceso de recalentamiento es incluso más conflictivo. Todos los procesos de recalentamiento se basan en el traspaso del contenedor celular desde el nitrógeno líquido (donde se ha mantenido la muestra por tiempo indefinido) hasta un recipiente contenedor de una solución de recalentamiento (normalmente a 37.5º), pasando por el aire entre ambos contenedores. Este paso por el aire supone un grave inconveniente, pues durante este paso el recalentamiento tiene lugar a una velocidad muy lenta, en la que es imposible evitar la formación y el crecimiento de cristales de hielo.
La probabilidad de una adecuada vitrificación depende, finalmente, del volumen de la muestra. Minimizando el volumen de la muestra se consigue minimizar la cantidad de líquido susceptible de nucleación, y por lo tanto se aumentan las probabilidades de una correcta vitrificación. Con esta filosofía, muy relacionada también con la maximización de la velocidad de enfriamiento comentada anteriormente, nacieron las "técnicas de mínimo volumen", como Cryotop [Kuwayama M, Vajta G, Kato O, Leibo S. P, Highly efficient vitrification method for cryopreservation of human oocytes, Reprod Biomed Online, 2005;11;300-308] o, más recientemente, CryoTip [Kuwayama M, Vajta G, lEda S, Kato O, Vitrification of human embryos using the CryoTip method, Reprod Biomed Online, in press], que han cosechado algunos éxitos en vitrificación de tipos celulares complicados de criopreservar. Sin embargo, la dificultad para manejar la muestra en dichos contenedores (en el caso de Cryotop), o la necesidad de velocidades de enfriamiento más elevadas (12.000ºC/min en el caso de CryoTip, y ligeramente mayores en el caso de Cryotop) hacen necesario la invención de nuevos procedimientos.
Descripción de las figuras
Reivindicaciones:
1. Criopreservación celular por vitrificación con bajas concentraciones de crioprotector caracterizado porque consiste en la introducción del contenedor celular a criopreservar en un fluido refrigerante para incrementar la velocidad de enfriamiento de las células y posterior recalentamiento por convección forzada.
2. Criopreservación celular por vitrificación con bajas concentraciones de crioprotector según reivindicación 1, caracterizado porque el contenedor celular es un capilar de cuarzo y el fluido refrigerante es nitrógeno líquido, slush ó slurry.
3. Criopreservación celular por vitrificación con bajas concentraciones de crioprotector según reivindicaciones anteriores, caracterizado porque la convección forzada se produce por movimiento del capilar de cuarzo respecto al fluido refrigerante.
Patentes similares o relacionadas:
 Procedimiento y dispositivo para producir un objeto multicelular tridimensional, del 29 de Julio de 2020, de TECHNISCHE UNIVERSITAT BERLIN: Procedimiento para producir un objeto multicelular tridimensional, con los pasos siguientes:
a) introducción de un primer líquido fotopolimerizable […]
Procedimiento y dispositivo para producir un objeto multicelular tridimensional, del 29 de Julio de 2020, de TECHNISCHE UNIVERSITAT BERLIN: Procedimiento para producir un objeto multicelular tridimensional, con los pasos siguientes:
a) introducción de un primer líquido fotopolimerizable […]
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Composiciones mejoradas para hidrogeles, del 22 de Julio de 2020, de Biogelx Limited: Una composición de hidrogel, que comprende una mezcla de los derivados peptídicos primero y segundo en una proporción de 1:4 a 4:1, en donde los primeros derivados […]
Sistemas de conservación y procesamiento de espermatozoides, del 17 de Junio de 2020, de XY, LLC: Un procedimiento para producir una muestra de esperma de mamífero no humano adecuada para la fertilización in vitro, que incluye la etapa de: […]
Producción de tapsigarginas por cultivo en suspensión de células de Thapsia, del 6 de Mayo de 2020, de PHYTON HOLDINGS, LLC: Método de producción de lactonas sesquiterpénicas de la familia de tapsigargina, comprendiendo el método las etapas de: (a) cultivar células vegetales […]
Composición de medio para preparar toxina botulínica, del 6 de Mayo de 2020, de Daewoong Co., Ltd: Una composición de medio libre de EET para su uso en el cultivo de Clostridium botulinum, la composición de medio comprende: peptonas de origen […]
Células virales resistentes y sus usos, del 22 de Abril de 2020, de Sigma-Aldrich Co. LLC: Una línea celular de ovario de hámster chino (CHO) modificada genéticamente en la que la entrada y/o propagación del virus diminuto del ratón (MVM) […]
Composiciones de cultivo de células con antioxidantes y procedimientos para la producción de polipéptidos, del 15 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento de producción de un anticuerpo o un fragmento del mismo producido recombinantemente que comprende la etapa de cultivar una célula que comprende […]