CONJUGADOS Y PROCEDIMIENTO PARA SU PREPARACION, ASI COMO SU USO PARA EL TRANSPORTE DE MOLECULAS A TRAVES DE MEMBRANAS BIOLOGICAS.
Uso de un radical arilo de las fórmulas F1 y F3 a F11, con
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP00/06936.
Solicitante: AVENTIS PHARMA DEUTSCHLAND GMBH.
Nacionalidad solicitante: Alemania.
Dirección: BRUNINGSTRASSE 50,65929 FRANKFURT AM MAIN.
Inventor/es: UHLMANN, EUGEN, DR., UNGER,EBERHARD, GREINER,BEATE, GOTHE,GISLINDE, SCHWERDEL,MARC.
Fecha de Publicación: .
Fecha Concesión Europea: 4 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- A61K47/48H4C
- C07H21/00G
- C12N15/87 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Introducción de material genético extraño utilizando procedimientos no previstos en otro lugar, p. ej. cotransformación.
Clasificación PCT:
- A61K47/48
- A61K49/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones para examen in vivo.
- A61P43/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para usos específicos, no previstos en los grupos A61P 1/00 - A61P 41/00.
Clasificación antigua:
- A61K47/48
- A61K49/00 A61K […] › Preparaciones para examen in vivo.
Fragmento de la descripción:
Conjugados y procedimiento para su preparación, así como su uso para el transporte de moléculas a través de membranas biológicas.
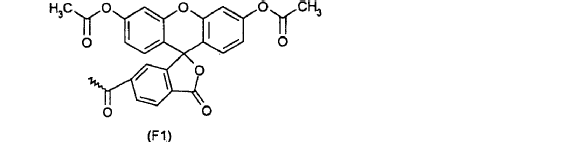
Objeto de la presente invención es el uso de radicales arilo de las fórmulas F1 y F3 a F11, que están unidos a un polinucleótido, oligonucleótido o mononucleótido (conjugado), para el transporte de esta molécula a través de una membrana biológica in vitro, pero también para la preparación de un medicamento para la prevención y/o tratamiento de enfermedades que van acompañadas de la expresión o sobre-expresión de determinados genes, y/o de un agente de diagnóstico para el diagnóstico o reconocimiento temprano de enfermedades de este tipo. Objeto de la presente invención es también un procedimiento para el transporte de una molécula en una célula in vitro, en el que un radical arilo de las fórmulas F1 y F3 a F11 que está unido con una molécula a transportar, seleccionada de un polinucleótido, oligonucleótido o mononucleótido, se incuba con la célula, tras lo cual el conjugado se transporta en la célula sin que se separe el radical arilo.
Un factor limitante para el aprovechamiento terapéutico de moléculas, cuyo punto de ataque se encuentra dentro de la célula, es, a menudo, su deficiente absorción celular y distribución intracelular desfavorable. Ejemplos típicos son macromoléculas, tales como ácidos nucleicos, que se unen de un modo específico para la secuencia al ADN o ARN celular y, con ello, determinan la inhibición de la expresión de los genes. Oligonucleótidos antisentido
son ácidos nucleicos monocatenarios cortos que se unen a un ARNm complementario a través de un apareamiento de bases de Watson-Crick, cuya traducción debe ser inhibida en la correspondiente proteína. Oligonucleótidos formadores de triplex se unen a través del denominado apareamiento de bases de Hoogsteen
en el gran surco de la doble hélice del ADN, con formación de una hélice triple, con lo cual se inhibe de manera específica para la secuencia la transcripción de los genes. Otros oligonucleótidos de acción intracelular son, por ejemplo, los denominados oligonucleótidos Decoy
, que imitan las regiones de unión para factores de transcripción. Mediante el tratamiento con oligonucleótidos Decoy se pueden captar determinados factores de transcripción de manera específica para la secuencia y, con ello, impedir una activación de la transcripción. Se recurre a otro grupo de oligonucleótidos de acción intracelular, los quimeraplastos, para la corrección génica dirigida (Cole-Strauss et al. (1996) Science 273, 1386-1389). También para esta corrección génica es esencial la absorción del oligonucleótido quimeraplasto en la célula. Ejemplos de otros ácidos nucleicos de acción intracelular son los que interactúan con enzimas celulares, en particular con telomerasas (Norton et al. Nat. Biotechn. (1996) 14, 615). Otra clase de ácidos nucleicos, de preferencia ADN bicatenario, pueden codificiar determinadas proteínas, que son expresadas de manera intracelular en el sentido de una terapia génica.
Por ejemplo, la absorción de un oligonucléotido in vitro en una célula, p. ej. mediante simple adición del oligonucleótido al medio del cultivo celular, es un proceso relativamente ineficaz, dado que, en realidad, sólo se absorbe en la célula una pequeña parte del oligonucleótido añadido. El proceso de absorción se prolonga durante muchas horas y, la mayoría de las veces, alcanza una fase de meseta sólo al cabo de 8 a 16 horas. Se supone que los oligonucleótidos son absorbidos en un proceso a modo de endocitosis. Un problema general de la absorción a través de endocitosis consiste, sin embargo, en que una gran parte de los oligonucleótidos no se presenta libre en el citoplasma, sino encerrados en determinadas estructuras celulares, los lisosomas y endosomas. Esta distribución puntiforme, en el caso de oligonucleótidos marcados por fluorescencia, se puede observar también, realmente, por microscopía de fluorescencia. Mediante esta localización vesicular, se reduce grandemente la concentración de oligonucleótido libre que se encuentra realmente disponible para la hibridación al ARNm. Además, en función del tipo de célula y de las condiciones reinantes, el oligonucleótido absorbe solamente una determinada fracción de las células. Por lo tanto, para la aplicación eficaz de oligonuclótidos antisentido pasan a emplearse, por lo general, mezclas con reforzadores de la penetración, tales como, por ejemplo, lípidos catiónicos (Bennett et al. Mol. Pharmacol. 41 (1992) 1023).
El documento WO 95/06659 describe oligonucleótidos derivatizados con aminoalquilo con una permeabilidad celular de la membrana mejorada. El documento EP 0 962 497 describe derivados de rodamina y su uso en sistemas de diagnóstico, y Whittemore, N. A. et al. (1999) Bioconjugate Chem., 10, 261-270 describen conjugados de antraquinona-oligodesoxinucleótidos.
Una misión de la presente invención consistía en mejorar la absorción celular de moléculas, en particular de macromoléculas, tales como, por ejemplo, oligonucleótidos.
La investigación de la absorción celular de oligonucleótidos tiene lugar, por lo general, con ayuda de oligonucleótidos radiactivamente marcados o marcados por fluorescencia. El marcaje por fluorescencia de un oligonucleótido tiene lugar, por ejemplo, mediante reacción de la función amino de un oligonucleótido con isotiocianato de fluoresceína (FITC - siglas en alemán). Por ejemplo, la fluoresceína puede introducirse en el extremo 3' de un oligonucleótido a través de un portador de fases sólidas derivatizado con fluoresceína, adquirible en el comercio, o en el extremo 5' a través de un reactivo de fosfitilación de fluoresceína, adquirible en el comercio. En todos los casos, la fluoresceína unida al oligonucleótido se presenta como un elemento estructural, cargado negativamente como consecuencia de la función ácido carboxílico, que es fuertemente fluorescente.
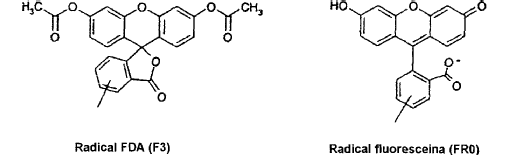
En contraposición a la fluoresceína, el diacetato de fluoresceína (FDA - siglas en alemán) es un colorante vital neutro, el cual, sólo después de la separación de los dos grupos éster y de la apertura del anillo de lactama, se transforma en la fluoresceína fluorescente, la cual, sin embargo en forma de la lactona, no muestra todavía fluorescencia alguna.
Es conocido que el FDA (en lo que sigue denominado también F3
), en calidad de molécula neutra no fluorescente, es absorbido mediante difusión pasiva por las células vivas y es separado intracelularmente por esterasas en la fluoresceína fluorescente (Breeuwer et al. Appl. Environ. Microbiol. (1995) 61, 1614; Maeda et al. Cell Struct. Funct. (1982) 7, 177). Hasta ahora se han descrito solamente derivados de FDA que contienen un grupo reactivo amina, tal como, p. ej., isotiocianato; estos derivados de FDA se emplean para la tinción de proteínas intracelulares o componentes de células. Además de ello, hasta ahora no se describieron conjugados algunos de FDA con otras moléculas; de manera correspondiente, tampoco se han descrito, hasta la fecha, oligonucleótidos marcados con FDA (conjugados a base de FDA y oligonucleótido).
En el citoplasma el FDA es separado mediante esterasas; mediante un marcaje con FDA de un oligonucleótido es, por lo tanto, posible determinar la proporción de oligonucleótido libre
, es decir qué cantidad de oligonucleótido hay presente en el citoplasma -y está disponible para la hibridación - en relación con la proporción de oligonucleótido que está presente en las vesículas (oligonucleótido capturado
) - y, por lo tanto, no está disponible para la hibridación. Condicionado por el elevado número en conjunto de cargas negativas en un oligonucleótido y por el hecho de que los oligonucleótidos marcados con FDA y marcados con fluoresceína (para el caso de que el oligonucleótido sea el mismo) sólo se diferencian para una carga neta, era de esperar que los oligonucleótidos marcados con FDA y marcados con fluoresceína mostraran una absorción y distribución celular muy similar.
Sin embargo, sorprendentemente, se encontró que los oligonucleótidos marcados con FDA y marcados con fluoresceína se diferencian claramente en relación con su absorción en las células, y tanto en relación con la duración como con la eficacia de la absorción de los oligonucleótidos y, además de ello, también en relación con la localización de los oligonucleótidos absorbidos en la célula....
Reivindicaciones:
1. Uso de un radical arilo de las fórmulas F1 y F3 a F11, con
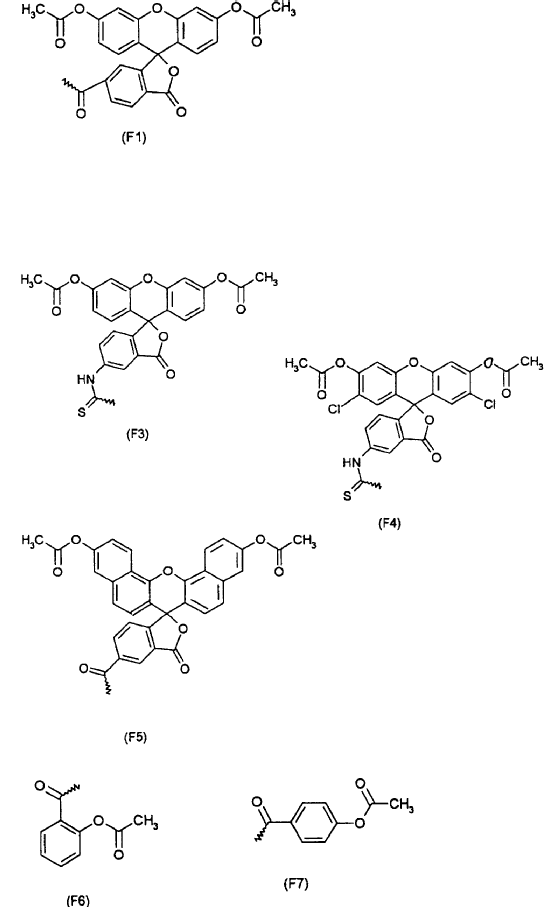
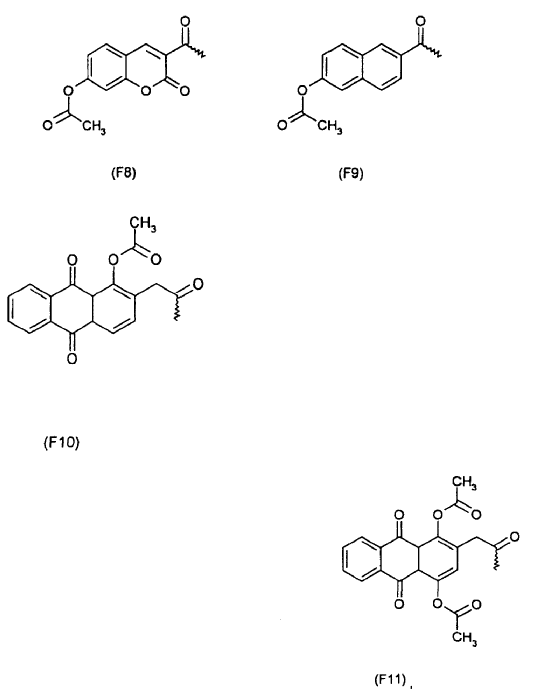
que está unido a una molécula a transportar, seleccionada de un polinucleótido, oligonucleótido o mononucleótido, para el transporte de esta molécula a través de una membrana biológica in vitro.
2. Uso de un radical arilo de las fórmulas F1 y F3 a F11, con
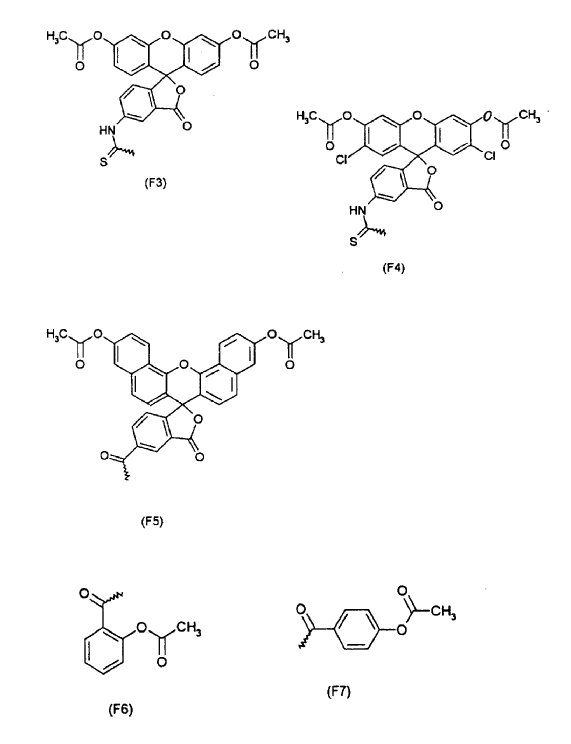
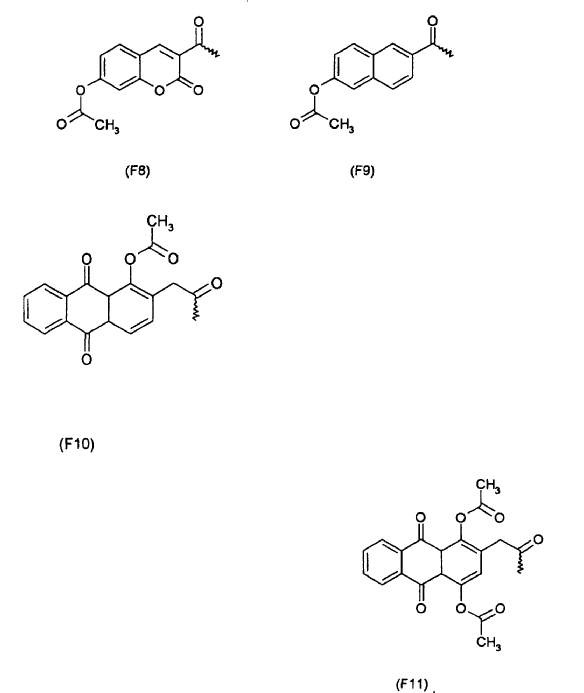
que está unido a una molécula a transportar, seleccionada de un polinucleótido, oligonucleótido o mononucleótido, para la preparación de un medicamento para la prevención y/o el tratamiento de enfermedades que van acompañadas de la expresión o sobre-expresión de determinados genes, y/o de un agente de diagnóstico para el diagnóstico o la detección precoz de enfermedades de este tipo.
3 Uso según la reivindicación 1 ó 2,
en el que el o los radicales arilo están unidos en el extremo 5', el extremo 3', la base heterocíclica, el azúcar o el puente internucleósido, pero también a través de componentes no nucleotídicos.
4. Procedimiento para el transporte de una molécula a través de una membrana in vitro, en el que se incuba con la membrana un radical arilo, tal como se ha descrito en las reivindicaciones 1-3, con una molécula a transportar, seleccionada de un polinucleótido, oligonucleótido o mononucleótido.
5. Procedimiento para el transporte de una molécula en una célula in vitro, en el que se incuba con la célula un radical arilo, tal como se ha descrito en una de las reivindicaciones 1-3, con la molécula a transportar, seleccionada de un polinucleótido, oligonucleótido o mononucleótido, tras lo cual se transporta el conjugado a la célula, sin que se separe el radical arilo.
6. Procedimiento según la reivindicación 5, en el que la célula es una célula eucariótica o una célula procariótica.
7. Procedimiento según las reivindicaciones 5 ó 6, en el que la célula es una célula bacteriana, una célula de levadura o una célula de mamífero.
8. Procedimiento según una o varias de las reivindicaciones 5 a 7, en el que la célula es una célula humana.
9. Procedimiento según una o varias de las reivindicaciones 5 a 8, en el que la célula es una célula tumoral.
Patentes similares o relacionadas:
Ratón nuligénico para Pint que muestra un fenotipo asociado a envejecimiento prematuro, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un ratón cuyo genoma comprende una inactivación de un locus del ARN no codificante largo (ARNlnc) Pint endógeno, en donde la inactivación (i) da como resultado que el […]
Terapia génica y electroporación para el tratamiento de neoplasias malignas, del 27 de Mayo de 2020, de OncoSec Medical Incorporated: Un plasmido que codifica para una forma soluble de un agonista de GITR, CD137, CD134, CD40L o CD27 para usar en un metodo de tratamiento de un sujeto con un […]
Métodos para mejorar la eficiencia de la transducción vectorial en linfocitos T, del 27 de Mayo de 2020, de CELGENE CORPORATION: Un método de transducción de un linfocito T primario, que comprende: (i) poner en contacto un linfocito T primario con un compuesto que es BX795 o 2-Aminopurina; (ii) […]
Métodos para la transducción y el procesamiento de células, del 27 de Mayo de 2020, de Juno Therapeutics, Inc: Un método de transducción, que comprende incubar, en una cavidad interna de una cámara de centrífuga, una composición de entrada que comprende células y partículas […]
Dispositivo para colocar material en célula, del 6 de Mayo de 2020, de Femtobiomed Inc: Un dispositivo para poner material en una célula, formado dentro de un sólido y comprende: un primer paso por el cual pasa la célula; un segundo paso por […]
Composiciones para introducir ARN en células, del 6 de Mayo de 2020, de ethris GmbH (100.0%): Una composición que comprende un ARN monocatenario y un componente que comprende una oligo(alquilenamina), componente que se selecciona […]
Método para transfectar células eucaróticas usando fibras de sepiolita, del 25 de Marzo de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para transfectar células eucariotas in vitro o ex vivo con uno o más ácidos nucleicos en donde dichas células se ponen en contacto con una composición […]
Organización de vectores de expresión, procedimientos de generación de células de producción novedosos y su uso para la producción recombinante de polipéptidos, del 18 de Marzo de 2020, de F. HOFFMANN-LA ROCHE AG: Un vector de expresión que comprende - un casete de expresión de la cadena ligera de anticuerpo, - un casete de expresión de la cadena pesada […]