VACUNAS VIRALES DERIVADAS DE CÉLULAS CON NIVELES REDUCIDOS DE ADN CELULAR RESIDUAL.
Un procedimiento de preparación de una vacuna contra el virus de la gripe formulada en una forma subviriónica que comprende proteínas inmunogénicas derivadas de un virus de la gripe propagado en un cultivo celular que comprende:
(i) añadir un agente alquilante para degradar el ADN de cultivo celular funcional residual y también inactivar el virus. (ii) modificar o fragmentar el virus completo con una concentración modificadora de un agente de fragmentación; y (iii) aislar las proteínas inmunogénicas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2006/003880.
Solicitante: NOVARTIS VACCINES AND DIAGNOSTICS GMBH.
Nacionalidad solicitante: Alemania.
Dirección: EMIL-VON-BEHRING-STRASSE 76 35041 MARBURG ALEMANIA.
Inventor/es: GREGERSEN,JENS-PETER, KOST,Holger.
Fecha de Publicación: .
Fecha Solicitud PCT: 1 de Noviembre de 2006.
Clasificación Internacional de Patentes:
- A61K39/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos virales.
- A61K39/145 A61K 39/00 […] › Orthomyxoviridae, p. ej. virus de la influenza.
- C12N7/02 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 7/00 Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00). › Aislamiento o purificación.
Clasificación PCT:
- A61K39/13 A61K 39/00 […] › Virus de la poliomielitis.
- A61K39/145 A61K 39/00 […] › Orthomyxoviridae, p. ej. virus de la influenza.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359214_T3.pdf
Fragmento de la descripción:
Campo técnico
La presente invención proporciona procedimientos que dan como resultado productos y procedimientos de cultivos celulares mejorados con impurezas reducidas. Específicamente, la presente invención proporciona un procedimiento mejorado para degradar cualquier ADN de cultivo celular funcional residual que permanece asociado con el producto generado en el cultivo celular. De acuerdo con la invención, el ADN de cultivo celular funcional residual se degrada por tratamiento con un agente alquilante de ADN, tal como β-propiolactona (BPL). Este proceso puede usarse para tratar una diversidad de productos de cultivos celulares que incluyen vacunas y proteínas recombinantes.
Antecedentes de la técnica
La producción comercial de vacunas virales requiere típicamente grandes cantidades de virus como fuente de antígeno. Las cantidades comerciales de virus para la producción de vacunas pueden conseguirse por cultivo y replicación de un virus de semilla en un sistema de cultivo celular. Los sistemas de cultivo celulares adecuados para la replicación viral incluyen células de mamíferos, de aves o de insectos, prefiriéndose particularmente los sistemas de cultivo celulares de mamíferos para las vacunas virales para garantizar la correcta glucosilación y plegamiento de las proteínas antigénicas virales. Por similares razones, también se prefieren los sistemas de cultivo celulares de mamíferos para la expresión de proteínas recombinantes.
Si no se modifican de su estado de origen natural, los cultivos celulares tienen una capacidad limitada para reproducirse y por consiguiente son poco prácticos e ineficaces para producir la cantidad de material necesario para una vacuna o proteína recombinante comercial. Por consiguiente, con fines de fabricación, se prefiere que las células se modifiquen para ser líneas celulares "continuas" o "inmortalizadas" para aumentar el número de veces que pueden dividirse. Muchas de estas modificaciones emplean mecanismos similares a los que están implicados en células oncogénicas. Como tal, existe una preocupación de que cualquier material residual de los procesos de cultivo celular, tal como ADN celular del huésped, pueda eliminarse de la formulación final de un producto de vacuna o de proteína recombinante fabricado en estos sistemas.
Un modo convencional para eliminar ADN celular residual del huésped es por tratamiento con DNasa. Un procedimiento conveniente de este tipo se desvela en la Patente Europea 0870508 y en la Patente de Estados Unidos 5948410, que implica un tratamiento en dos etapas, usando en primer lugar una DNasa (por ejemplo, Benzonasa) y después un detergente catiónico (por ejemplo BCTA).
Los esfuerzos actuales para reducir este riesgo se han enfocado en reducir la concentración total de ADN celular residual del huésped. Un objeto de la presente invención es reducir el riesgo eliminado adicionalmente la funcionalidad de cualquier ADN que permanezca en la célula huésped.
Sumario de la invención
La presente invención proporciona procedimientos que dan como resultado productos de cultivos celulares mejorados y procesos con impurezas reducidas. Específicamente, la presente invención proporciona un procedimiento mejorado para degradar cualquier ADN de cultivo celular funcional residual que permanece asociado con el producto generado en el cultivo celular. De acuerdo con la invención, el ADN de cultivo celular funcional residual se degrada por tratamiento con un agente alquilante de ADN, tal como β-propiolactona (BPL). Este proceso puede usarse para tratar una diversidad de productos de cultivos celulares que incluyen vacunas y proteínas recombinantes.
La divulgación incluye una vacuna que comprende proteínas inmunogénicas derivadas de un virus propagado en cultivo celular, en el que la vacuna carece sustancialmente de ADN de cultivo celular funcional residual.
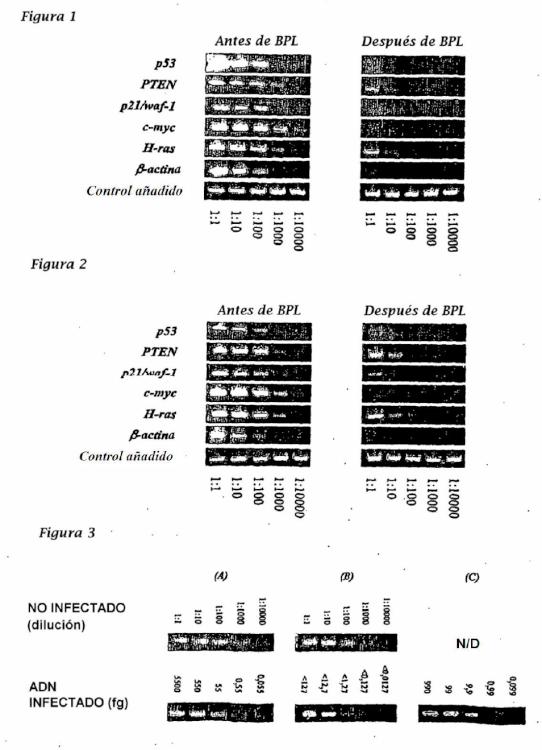
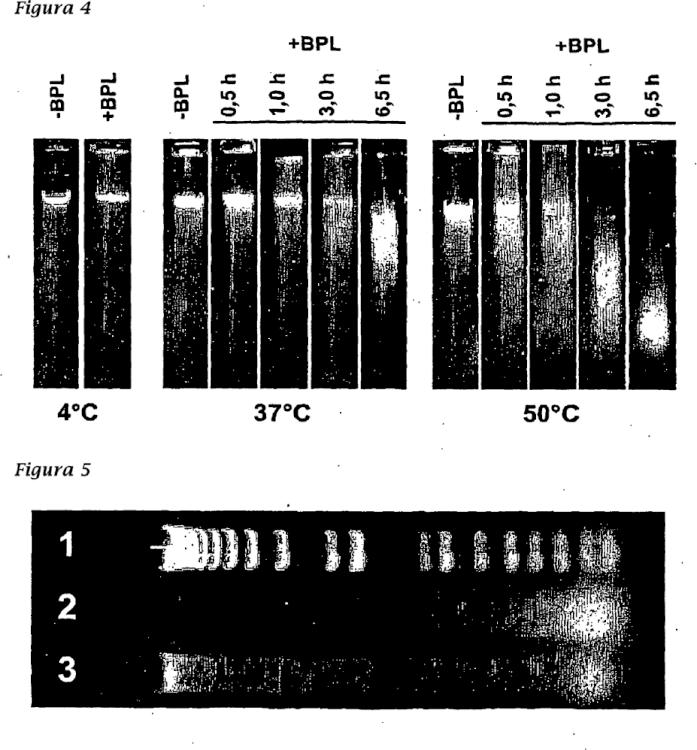
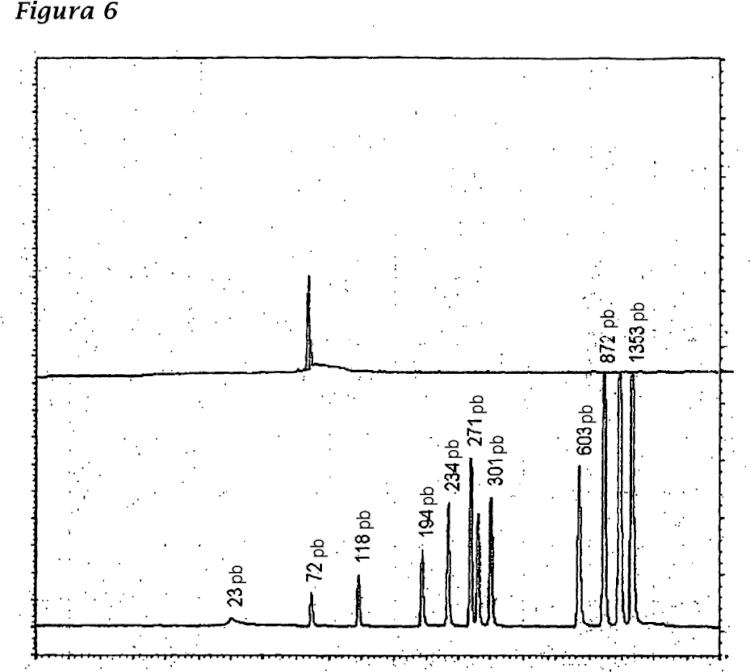
La funcionalidad de cualquier ADN celular residual del huésped puede eliminarse tratando el ADN con un agente alquilante que escinde el ADN en partes lo suficientemente pequeñas para que no pueda codificar una proteína funcional, se trasponga en un cromosoma humano receptor o de otra manera la maquinaria de replicación del ADN del receptor lo reconozca. Preferentemente, la longitud del ADN de cultivo celular residual degradado es menor de 500 pares de bases. Más preferentemente, la longitud del ADN de cultivo residual degradado es menor de 200 pares de bases.
Descripción detallada
Los procedimientos de la presente invención proporcionan productos y procesos de cultivo celular mejorados con impurezas reducidas. Específicamente, la presente invención proporciona un procedimiento mejorado para degradar cualquier ADN de cultivo celular funcional residual que permanezca asociado con el producto generado en el cultivo celular. De acuerdo con la invención, el ADN de cultivo celular funcional residual se degrada por tratamiento con un agente alquilante de ADN, tal como β-propiolactona (BPL). Este proceso puede usarse para tratar diversos productos de cultivo celular que incluyen vacunas.
La divulgación incluye una vacuna que comprende propiedades inmunogénicas derivadas de un virus propagado en un cultivo celular, en el que la vacuna carece sustancialmente de ADN de cultivo celular funcional residual.
La funcionalidad de cualquier ADN residual de la célula huésped puede eliminarse por tratamiento del ADN con un agente alquilante que escinde el ADN en partes lo suficientemente pequeñas para que no pueda codificar una proteína funcional, se trasponga en un cromosoma humano receptor o de otra manera la maquinaria de replicación del ADN del receptor lo reconozca. La longitud del ADN de cultivo celular residual degradado (no funcional) es preferentemente menor de 1000 pares de bases (por ejemplo menor de 1000, 800, 700, 600, 500, 400, 300, 200, 150, 100, 75 ó 50 pares de bases). Preferentemente, la longitud del ADN de cultivo celular residual degradado es menor de 500 pares de bases. Más preferentemente, la longitud del ADN de cultivo celular residual degradado es menor de 200 pares de bases.
Como se usa en el presente documento, la alusión "ADN funcional" o "ARN funcional" indica una secuencia de nucleótidos que puede traducirse en una proteína funcional o transponerse en un cromosoma de mamífero. Generalmente, las secuencias de nucleótidos que pueden traducirse en una proteína funcional requiere regiones promotoras, codones de inicio, codones de terminación y secuencias codificantes internas para proteínas funcionales. Cuando se produce lesión del ADN, como a partir de la adición de un agente alquilante, muchas de estas regiones se modifican o se destruyen, de manera que la traducción puede continuar durante más tiempo o continuar solo para formar una subunidad oligopeptídica de la proteína deseada.
El "ADN de cultivo celular funcional residual degradado" se refiere a un ADN funcional que no puede traducirse en una proteína funcional o transponerse en un cromosoma de mamífero. Preferentemente, "el ADN funcional residual degradado" tiene una longitud menor de 1000 pares de bases, más preferentemente menor de 500 pares de bases, incluso más preferentemente menor de 250 pares de bases y más preferentemente menor de 100 pares de bases. La longitud del ADN funcional residual degradado puede determinarse por técnicas convencionales, que incluyen electroforesis en gel.
Los procedimientos de la presente invención permiten composiciones de vacunas que carecen sustancialmente de ADN de cultivo celular funcional residual. Como se usa en el presente documento, carecer sustancialmente de ADN de cultivo celular funcional residual se refiere a una composición en la que los fragmentos de ADN residual de menos de 200 pares de bases pueden detectarse en menos de 10 ng por 0,5 ml. El tamaño de cualquier ADN de cultivo celular residual puede medirse por técnicas convencionales, incluyendo electroforesis en gel con capilar y tecnología de amplificación de ácidos nucleicos.
El uso de un agente alquilante tal como BPL en la presente invención proporciona la ventaja adicional de reducir la agregación de contaminantes. Las formulaciones de vacunas con menos agregados también pueden tener inmunogenicidad mejorada. La inmunogenicidad de una vacuna se basa en la especificidad de los anticuerpos por epítopes virales particulares. Si la superficie de una proteína está unida o tapada por moléculas desconocidas u ocultas por... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de preparación de una vacuna contra el virus de la gripe formulada en una forma subviriónica que comprende proteínas inmunogénicas derivadas de un virus de la gripe propagado en un cultivo celular que comprende:
(i) añadir un agente alquilante para degradar el ADN de cultivo celular funcional residual y también inactivar el virus.
(ii) modificar o fragmentar el virus completo con una concentración modificadora de un agente de fragmentación; y
(iii) aislar las proteínas inmunogénicas
2. El procedimiento de la reivindicación 1, en el que dicho agente alquilante es β-propilactona (BPL)
3. El procedimiento de la reivindicación 2, en el que dicho ADN de cultivo celular se degrada por tratamiento con menos del 0,1% de β-propilactona (BPL).
4. El procedimiento de cualquier reivindicación anterior, en el que la vacuna resultante presenta un nivel de agregación reducido.
5. El procedimiento de cualquier reivindicación anterior, en que la etapa (iii) implica separar el ADN de viriones.
6. El procedimiento de cualquier reivindicación anterior, en el que el cultivo celular se selecciona de un grupo que consiste en células MDCK, células Vero y células PER.C6.
7. El procedimiento de cualquier reivindicación anterior, en el que el agente de fragmentación es un tensioactivo no iónico o iónico.
8. El procedimiento de la reivindicación 7 en el que el agente de fragmentación en la etapa (iii) es bromuro de cetil trimetil amonio (BCTA).
9. El procedimiento de cualquier reivindicación anterior, en el que la vacuna subviriónica es una vacuna fragmentada.
10. El procedimiento de una cualquiera de las reivindicaciones 1 a 8, en el que la vacuna subviriónica es una vacuna a base de proteína viral purificada.
11. El procedimiento de cualquier reivindicación anterior en el que las proteínas inmunogénicas son antígenos virales seleccionados del grupo que consiste en hemaglutinina (HA), neuraminidasa (NA), nucleoproteína (NP), proteína de matriz (N1), proteína de membrana (M2), uno o más de los componentes de la transcriptasa (PB1, PB2 y PA).
12. El procedimiento de la reivindicación 11 en el que la proteína inmunogénica es hemaglutinina (HA).
13. El procedimiento de la reivindicación 11 en el que la proteína inmunogénica es neuraminidasa (NA).
14. El procedimiento de cualquier reivindicación anterior, que comprende adicionalmente la etapa que consiste en formular las proteínas inmunogénicas en una vacuna.
15. El procedimiento de cualquier reivindicación anterior, que comprende:
(i) propagación de virus en un cultivo celular.
(ii) añadir un agente alquilante para degradar el ADN de cultivo celular funcional residual y también para inactivar los virus.
(iii) modificar o fragmentar el virus completo con una concentración modificadora de un agente de fragmentación;
(iv) aislar las proteínas virales; y
(v) formular las proteínas virales en una vacuna en forma de una o más proteínas virales purificadas.
16. El procedimiento de cualquier reivindicación anterior, que comprende las etapas de:
(i) propagación de virus en células MDCK en suspensión;
(ii) clarificar el medio de cultivo para proporcionar viriones;
(iii) someter los viriones obtenidos en la etapa (ii) a cromatografía y a ultrafiltración/diafiltración;
(iv) inactivar los viriones con β-propiolactona;
(v) fragmentar los viriones con bromuro de cetil trimetil amonio (BCTA); y
(vi) formular los viriones fragmentados en una vacuna.
Patentes similares o relacionadas:
Composición farmacéutica que comprende un complejo de carga portador polimérico y al menos un antígeno proteínico o peptídico, del 1 de Julio de 2020, de CureVac AG: Composición farmacéutica que incluye: (A) un complejo de carga portador polimérico, que comprende: a) un portador polimérico que comprende componentes catiónicos reticulados […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]
Métodos para proporcionar virosomas con adyuvante y virosomas con adyuvante obtenibles de esta manera, del 3 de Junio de 2020, de BESTEWIL HOLDING B.V: Un método para preparar los virosomas con adyuvante, que comprende las etapas de: (i) proporcionar una composición acuosa de los virosomas sin adyuvante que comprende […]
Ácido nucleico que comprende o codifica para un tallo-bucle de histona y una secuencia poli(A) o una señal de poliadenilación para aumentar la expresión de un antígeno patogénico codificado, del 3 de Junio de 2020, de CureVac AG: Secuencia de ácido nucleico que comprende o codifica en la dirección 5' → 3' para: i) • una región codificante, que codifica para al menos […]
Vacuna que comprende un pestivirus atenuado, del 27 de Mayo de 2020, de BOEHRINGER INGELHEIM VETMEDICA GMBH: Un pestivirus atenuado, con al menos una mutación en la secuencia codificadora de la glicopoteína E ms y al menos otra mutación en la secuencia […]
Composiciones inmunogénicas de PCV2 multivalentes y métodos para producir dichas composiciones, del 27 de Mayo de 2020, de Boehringer Ingelheim Animal Health USA Inc: Una vacuna combinada multivalente para uso en un método para (i) la prevención de una infección por PCV2, o de reinfección por PCV2 o (ii) la reducción o eliminación […]
Proteínas de consenso del virus de la Fiebre Aftosa (VFA), secuencias codificantes y vacunas preparadas a partir de las mismas, del 6 de Mayo de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Molécula de ácidos nucleicos que comprende una secuencia de ácidos nucleicos seleccionada del grupo que consiste en SEC ID nº 1, SEC ID nº […]